
Биоэтика, лопатин
.pdfдолжен получить разрешение. Такое разрешение обычно дает комиссия или этический комитет, назначаемые руководителем лечебного учреждения.
Попытки оптимизации использования лекарств с помощью формуляров известны с давних времен. Еще в XIII-XIV в. применялся так называемый «Исламский формуляр», включавший 517 ЛС. В последующем этот механизм использовался в разных странах в разное время.
ВРоссии накоплен опыт нормирования различных областей лекарственного обеспечения. Например, в 1708 г. Даниилом Гурчиным были разработаны первые нормы обеспечения лекарственными средствами российской армии - «Аптека обозная или служивая, собранная вкратце с разных книг на пользу служивого чина». В последующем военно-медицинская служба всегда имела в своем распоряжении аналогичные и многие другие нормы на мирное и военное время.
Внастоящее время многими исследователями доказано, что формулярные ограничения дают существенную экономию средств, затрачиваемых на достижение тех или иных лечебных или профилактических эффектов. Например, в одном из госпиталей Хьюстона после введения формуляра этого учреждения в 1997 г. общие затраты на антибактериальные препараты снизились на 31%. Введение в Греции формулярной системы привело к снижению потребления антибиотиков более чем наполовину.
Важно подчеркнуть, что в ряде случаев формулярные ограничения в области антибактериальной терапии приводят к снижению
уровня резистентности, что было доказано в ходе осуществления проекта ICARE (Intensive Care Antimicrobial Resistance Epidemiology), в
котором изучался уровень резистентности госпитальных патогенов в 41 госпитале США.
Разработкой формуляров ЛС обычно занимаются формулярнотерапевтические комитеты, в состав которых входят врачи и специалисты в области фармации. Обычно формулярнотерапевтический комитет насчитывает около 20 человек, соотношение специалистов медиков и фармацевтов составляет 3:1.
Опыт ряда стран показал, что большое значение имеют недостаточная подготовка специалистов лечебного учреждения в области конкретной экономики, недоступность существующих методик
проведения соответствующих исследований, а также объективной полной и своевременной информации об эффективности и безопасности ЛС.
ВРоссийской Федерации в настоящее время эти недостатки минимизированы. Россия является второй в мире державой после Великобритании, в которой начиная с 2003 г. включаются в Федеральное руководство по использованию ЛС (формулярная система) их полуколичественные характеристики эффективности и безопасности. Вместе с тем данные об экономической целесообразности использования тех или иных ЛС чаще всего недоступны для широкого круга работников здравоохранения.
Впоследние годы в РФ изданы хорошие монографии, в которых изложены методология и методика разработки формуляров с использованием принципов доказательной медицины и фармакоэкономического анализа.
Наряду с этим введен ОСТ по разработке формуляров и Методические рекомендации ? 2001/108, утвержденные первым заместителем министра здравоохранения А.И. Вялковым «Использование комплексного квалиметрического подхода к составлению перечней и формуляров ЛС (на примере группы противоопухолевые лекарственные средства)».
Некоторыми исследователями выделены основные препятствия для использования фармакоэкономического анализа при принятии решений в области здравоохранения (D. M. Eddy и др.). Они указывают, что сообщения об ограниченности средств лечебнопрофилактических учреждений в ряде случаев сомнительны и в действительности частные клиники используют формуляры как механизм
максимизации своих прибылей. Не исключается также дискриминация пожилых, инвалидов и других групп населения, нуждающихся в социальной поддержке. Последнее оказалось особенно актуальным в условиях начавшейся реформы российского здравоохранения и монетизации льгот.
Во второй половине ХХ в. обострилась проблемная ситуация в области безопасности ЛС. Постоянно увеличивается число сообщений о нежелательных побочных реакциях (НПР). В глобальной базе данных ВОЗ по этой проблеме содержатся миллионы сообщений.
Как реакция на создавшуюся ситуацию сформировалось новое медико-фармацевтическое направление в науке «фармацевтическая бдительность» (фармаконадзор, Pharmacovigilance).
Цель этого направления - обеспечение безопасности больных при применении ЛС. В том числе снижение заболеваемости и смертности вследствие их использования.
Задачами фармаконадзора являются системные решения, обеспечивающие:
•создание национальной (государственной) службы фармаконадзора;
•обучение и подготовку специалистов здравоохранения в области оценки соотношения польза/риск и рационального использования ЛС;
•изменение стереотипов в работе врачей с целью сокращения ненужного и нерационального назначения лекарственных препаратов (полипрогмазия);
•изменения отношения больных к необоснованному применению лекарств, особенно при самолечении;
•реализацию образовательных и информационных программ для медицинских и фармацевтических работников и населения;
•выявление и изучение НПР.
•Объектом изучения фармаконадзора являются:
•недостаточная изученность ЛС;
•недостаточная информированность медицинских и фармацевтических работников и потребителей фармацевтической помощи;
•искажение и утаивание информации о НПР;
•медицинские ошибки;
•применение некачественных и фальсифицированных препаратов;
•использование ЛС по неизученным и неразрешенным показаниям;
•острые и хронические отравления ЛС;
•смертность, вызванная ЛС;
•злоупотребление ЛС;
•неблагоприятные взаимодействия лекарств с химическими веществами, другими лекарственными препаратами и пищевыми продуктами.
При решении поставленных задач в сфере фармаконадзора используется ряд методов и методических материалов, которые студенты изучают на последующих курсах.
Исходя из приведенных выше данных можно сделать заключение, что современный мировой и российский фармацевтический рынок развивается все еще хаотично и социально безответственно. Многие проблемы, которые тревожат работников здравоохранения, не решаются. В числе таких проблем, относящихся к сфере фармации, приоритетными можно считать развитие фармацевтической биоэтики, касающееся всех этапов обращения лекарств и в первую очередь инновационных разработок, оказывающих революционизирующее влияние на лекарственную терапию и профилактику заболеваний. Примерами такого влияния служат появление аминазина, возвратившего многих пациентов к обычной жизни и в ряде случаев к привычной профессии; ингибиторов протонного насоса (омепразола), Н2-блокаторов (ранитидин, фамотидин, цимитидин и др.), которые позволили сократить частоту и сроки госпитализации больных, и т.п.
Указанные проблемы детально рассматриваются в последующих главах.
ГЛАВА 3 ОСНОВНЫЕ БИОЭТИЧЕСКИЕ И ЭТИЧЕСКИЕ ПРОБЛЕМЫ СОЗДАНИЯ И ВОСПРОИЗВОДСТВА ЛЕКАРСТВ
Мировой и российский фармацевтические рынки в настоящее время бурно развиваются (рис. 6., табл. 1).
Однако дженериковые ЛС доминируют и продолжат доминировать (см. табл. 1). Доля инновационных ЛС все еще остается небольшой: так, в 2008 г. она составит в среднем около 13%.
Инновационные лекарства позволяют реально снижать расходы на лечение хронических заболеваний. Например, по данным США, годовая стоимость расходов на обслуживание пациентов, страдающих болезнью Альцгеймера, на 4 тыс. долл. ниже у пациентов, принимающих меди-
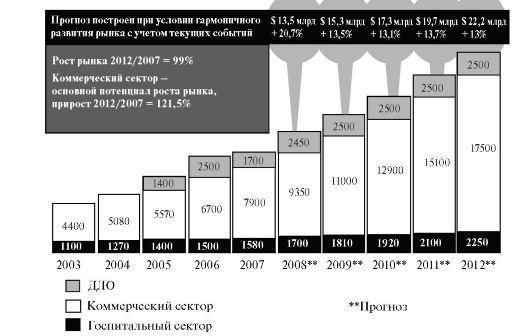
Рис. 6.
Объем российского фармацевтического рынка в 2003 - 2012 г. (млрд. долл. США, цены потребителя, включая 18% НДС). Расчеты ЦМИ «Фармэксперт» ДЛО - дополнительное лекарственное обеспечение.
Таблица 1. Доля основных категорий продукции на фармацевтическом рынке России (%), 2004 - 2012 гг. Расчеты ЦМИ «Фармэксперт»
|
2004200520062007*2008**2009**2010**2011**2012** |
||||||||
Дженерики и другие89 |
85 |
80 |
88 |
87 |
86 |
85 |
85 |
85 |
|
Инновационные |
11 |
12 |
50 |
12 |
13 |
14 |
15 |
15 |
15 |
'Расчеты ЦМИ «Фармэксперт» "Прогноз
каментозную терапию, по сравнению с контрольной группой без медикаментозного лечения. Или другие цифры: вследствие использования инновационных продуктов количество койко-дней на 100 человек в год сократилось в США со 130 в 1980 г. до 57 в 2000 г. (всего на 56%).
Хотя, в среднем, инновационные продукты стоят на 18 долл. дороже «старого» аналога, уже присутствующего на рынке, экономия от их использования составляет 129 долл., т.е. на 1 долл. прироста стоимости лекарства приходится около 7 долл. экономии совокупных расходов на лечение.
По данным Роспрома, более 70% объема продаж лекарственных препаратов на российском фармацевтическом рынке приходится на импортные средства, и только около 5% готовых препаратов производится на основе отечественных субстанций. На

фармацевтическом рынке России полностью отсутствуют отечественные антибиотики нового поколения, противотуберкулезные, онкологические и обезболивающие препараты, инсулин и многие другие лекарства. Такое положение вещей не только удручающе сказывается на здоровье средне- и малообеспеченных слоев населения, но и, безусловно, ставит под угрозу само существование фармацевтической отрасли в России.
Вышеизложенное позволяет сделать заключение, что интересы здравоохранения, в том числе клинической медицины, требуют активизации исследований по созданию инновационных ЛС.
При решении этой проблемы наибольшую значимость в настоящее время приобретают исследования, направленные на создание лекарств на основе отобранных в эксперименте веществ.
В конце 1970-х гг. П.В. Лопатиным была сформулирована концепция лекарства как материализованной программы доставки лекарственного вещества к биологической мишени и предложена закрытая графическая модель процесса его разработки (рис. 7);
Примечание; 1) На всех этапах проводятся необходимые контроли в соответствии с разработанными критериями и параметрами. 2) На отдельных этапах следует проводить сравнительную оценку конкурентоспособности создаваемого лекарства и возможности продвижения его на рынок, с использованием, как правило, экспрессоценки целесообразности инноваций и инвестиций. 3) На всех этапах следует рассматривать вопросы защиты интеллектуальной собственности.
Рис. 7. Закрытая графическая модель процесса разработки лекарства на основе отобранных в эксперименте веществ
теоретически и экспериментально обоснованы приемы направленной (программируемой) доставки действующих веществ к биологическим мишеням (табл. 2) и сформирована концепция науки о создании готовых лекарств на основе отобранных соединений (субстанций) - лекаристики (рис. 8).
Модель процесса создания лекарства
Эта модель с учетом современных требований представлена на рис.
7.
В дальнейшем она была использована для создания регламентирующих документов для соисполнителей государственных программ, связанных с созданием лекарств для лечения наиболее распространенных заболеваний.
Одним из первых таких документов был порядок организации работ по созданию и подготовке к клиническому изучению противоопухолевых лекарств во Всесоюзном онкологическом центре АМН СССР
Таблица 2. Приемы направленной доставки действующих веществ к биологическим мишеням
Для программируемой доставки можно использовать:
ворганы - ультраэмульсии, микросферы, микрокапсулы и др.;
вткани - ультраэмульсии с различным размером частиц и составом, в том числе покрытые глобулином; липосомы, термочувствительные нанокапсулы, наночастицы на основе полимеров, магнитные носители, фотосенсибилизаторы, сопряженные с лазерами, генерирующими излучение с конкретными длинами волн, обеспечивающими лечение опухолей, расположенных на разной глубине, и др.; для более точной доставки в конструкцию носителей вводятся
элементы узнавания мишени, например моноклональные антитела, ассоциированные с лекарственным веществом; нагруженные эритроциты, к поверхности которых присоединены антитела; липосомы, во внешнюю оболочку которых встроены векторы, обеспечивающие избирательное «причаливание» к клетке, на поверхности которой имеется комплементарный вектору маркер; лиганды, включающие остатки сахаров, узнаваемые некоторыми клетками (гепатоцитами, макрофагами и др.)
Отдельные элементы программы доставки могут быть реализованы за

счет более простых решений, например, с использованием неводных растворителей, пленочных и напрессованных покрытий, твердых дисперсных систем, спансул и т.п.
Рис. 8.
Место науки о создании готовых лекарств (лекаристики) в современном знании.
и участию в их внедрении в промышленное производство, который был разработан П.В. Лопатиным и сотрудниками. В нем излагалась методология создания лекарств, были реализованы принципы последовательно-параллельного выполнения необходимых фрагментов проекта, а также порядок управления процессом создания лекарств. Вместе с тем в документе впервые был приведен четкий понятийный
аппарат, позволивший всем участникам создания лекарств хорошо ориентироваться в проблеме, обеспечить тесное взаимодействие всех подразделений, занятых в проекте, что привело к повышению
эффективности исследования и сокращению сроков выполнения всего комплекса научно-исследовательских работ (НИР).
В последующем этот документ был принят как обязательный для всех соисполнителей государственной программы 069.02.
Модель включает несколько блоков последовательного решения необходимых задач. Первый блок (этап) предусматривает формулировку требований к создаваемому лекарству. На первом этапе выбирается биологическая мишень, к которой должны быть доставлены соответствующие лекарственные вещества. Это может быть выполнено на основе теоретических и экспериментальных изысканий. Поэтому в начале конструируются определенные модели лекарства, позволяющие обосновать программу доставки фармакологического вещества к биологической мишени. При этом, как правило, рассматривается и обосновывается минимум 9 элементов программы доставки. Особое внимание уделяется теоретическому и экспериментальному обоснованию пути введения фармакологического лекарственного вещества в организм. Он определяет особенности взаимоотношения лекарственного вещества с путями и механизмами транспортировки, в том числе преодоление гистогематического барьера, влияние среды транспортировки, метаболизм и распределение введенного вещества.
Второй блок предусматривает создание прототипов лекарства, т.е. вариантов композиций и конструкций его, из которых в дальнейшем будет отобран лучший. На этом этапе помимо поиска оптимальной конструкции и композиции потенциального лекарства определяется доза действующего вещества в потребительской таре и сама потребительская тара. Затем проводятся исследования соответствия характеристик прототипов лекарства ранее сформулированным требованиям (блоки 3 и 4); такое соответствие может оцениваться лишь по интегральным критериям, устанавливающим возможность введения препарата в организм - отсутствие выраженных местных тканевых реакций и т.п.; мини-программам, характеризующим основные технологические, фармакологические параметры; оценивают фармакопейное качество и главное, специфическую активность. Такие исследования позволяют осуществить выбор наиболее рационального варианта изученного прототипа, который получает статус фармакологического средства и передается на 5-й этап (блок изучения).
На 5-м и 6-м этапах научно-исследовательской работы ведутся параллельные исследования, направленные на углубленное
терапевтическое, токсикологическое и фармакологическое изучение фармакологического средства; разрабатываются антидоты и способы лечения осложнений, связанных с передозировкой фармакологического средства; составляются документы, необходимые для разрешения клинических испытаний.
Одновременно другая группа исследователей (технологов) разрабатывает технологию и аппаратурное оформление производства фармакологического средства, необходимые для крупнолабораторной наработки его с целью углубленных лабораторных испытаний, разработки критериев, методов, методик и параметров стандартизации и контроля качества.
После этого на 7-м этапе разрабатывается нормативная документация, обеспечивающая наработку ЛС для клинических испытаний и, в случае их успешного завершения, последующего продвижения, в том числе лабораторный регламент производства, предварительные нормативно-технические требования (проекты ВФС или Фармакопейные статьи предприятия).
Важнейшим этапом (блок 8) является наработка фармакологического средства для клинических испытаний. Следует подчеркнуть, что наибольшего успеха достигают организации, имеющие собственную наработочную базу. В России такие базы имеют ряд ведущих научноисследовательских центров и производственных фармацевтических организаций, в частности: ОАО «Нижфарм», ОАО «ХимФармКомбинат», ЗАО «Акрихин», ЗАО «Верофарм» и др. Это позволяет в сжатые сроки разрабатывать нормативные документы, необходимые и для промышленного выпуска продукции (блок 10), в том числе опытно-промышленные и другие регламенты, ФСП, ВФ и ФС, а также при регистрации ЛС и введения их в государственный реестр лекарств.
Изложенное позволяет не только обеспечить широкое внедрение инновационного препарата в широкую медицинскую практику, но и максимально использовать сроки патентной защиты разработки, а также максимизировать прибыль.
В связи с введением в действие нового законодательства о защите интеллектуальной собственности и предполагаемого вступления России во Всемирную торговую организацию необычайно возросло значение защиты прав разработчиков новых лекарств, способов их
изготовления, промышленных образцов и торговых марок, а также лекарственных технологий лечения и предупреждения заболевания.
