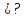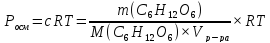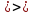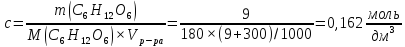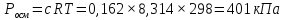- •Методические указания
- •190600 – Эксплуатация транспортных машин и комплексов
- •Тематический план дисциплины
- •Формы контроля знаний студентов
- •План самостоятельной работы студентов
- •1. Строение атома и периодическая система элементов д.И. Менделеева
- •Задание 1
- •2. Химическая связь
- •3. Энергетика химических реакций Химико-термодинамические расчеты
- •4. Скорость химических реакций
- •5. Химическое равновесие
- •3 Моль 1 моль 2 моль
- •6. Растворы. Способы выражения содержания растворенного вещества в растворе
- •7. Физические свойства рстворов
- •8. Реакции обмена в растворах электролитов. Гидролиз солей
- •9. Дисперсные системы. Коллоидные растворы
- •10. Окислительно-восстановительные реакции
- •11. Электрохимические системы
- •12. Коррозия металлов
- •Примеры тестовых опросов
- •1. Среди приведенных электронных конфигураций укажите невозможную:
- •«Химическая термодинамика и химическая кинетика»
- •«Окислительно-восстановительные реакции»
- •«Электрохимия»
- •Учебно–методическое обеспечение дисциплины Основная литература
- •Дополнительная литература
7. Физические свойства рстворов
Рекомендуемая литература:
Н.В. Коровин, Общая химия, гл.8, §8.1; Лекции по теме.
Н.Л. Глинка, Задачи и упражнения по общей химии, гл. VI, §3, примеры 1-4, вопросы для самоконтроля №№ 490-501.
Вопросы для подготовки
Идеальные и реальные растворы. Коллигативные свойства идеальных растворов. Давление насыщенного пара над раствором, положительные и отрицательные отклонения и их связь с характером межмолекулярных взаимодействий в растворах. Закон Рауля. Повышение температуры кипения и понижение температуры замерзания растворов. Криоскопический и эбуллиоскопический методы изучения растворов. Осмос. Осмотическое давление раствора и изучение растворов осмотическим методом. Закон Вант-Гоффа.
Пример 1.
Температура кипения водного раствора сахарозы С12Н22О11равна 101,40С. При какой температуре замерзает этот раствор? Вычислите моляльную концентрацию этого раствора и массовую долю сахарозы в растворе.
|
Дано: tкип.(р-ра)=101,40С
tкрист.(р-ра) = ? cm =?
|
Решение
Повышение температуры
кипения (
где Е – эбуллиоскопическая постоянная растворителя, К – криоскопическая постоянная растворителя.
Для воды Е=0,52
и К=1,86; Для водного раствора сахарозы:
|
|
|
Температура кристаллизации раствора сахарозы:
Массовая доля сахарозы в растворе:
|
Ответ:
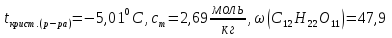
Пример 2.
Вычислите осмотическое давление раствора, содержащего 36 г глюкозы (С6Н12О6) в 300 г воды при 250С. Плотность раствора считать равной единице.
|
Дано: m(С6Н12О6)=9 г m(Н2О)=300 г
t= 250С
Росм
|
Решение Согласно закону Вант-Гоффа, осмотическое давление пропорционально молярной концентрации и температуре раствора:
где с – молярная концентрация раствора, моль/дм3: R– универсальная газовая постоянная,R=8,314 Дж/моль.К; Т=273 + t0С, К; Т=273 + 25 = 298 К Росм– осмотическое давление, кПа.
m(p-pa)
=m(С6Н12О6)+m(Н2О);V(p-pa)=m(p-pa)/ρ(р-ра)
|
Ответ: Росм. = 401 кПа
Контрольные задания
Задание 7
|
|
№ |
Условие задачи |
|
|
1 |
Раствор, содержащий 5,4 г вещества неэлектролита в 200 г воды, кипит при температуре 100,0780С. Вычислите молярную массу растворенного вещества. |
|
|
2 |
На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы (С6Н12О6)? |
|
|
3 |
Раствор, в 100 мл которого находится 2,30 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определите молярную массу вещества. |
|
|
4 |
Вычислите массовую долю сахара (С12Н22О11) в водном растворе, если известно, что температура кристаллизации раствора равна –0,930С. |
|
|
5 |
Вычислите температуру кристаллизации раствора, содержащего 5 г мочевины (NH2)2CO в 150 г воды. |
|
|
6 |
Температура кипения водного раствора сахарозы (С12Н22О11) равна 101,040С. при какой температуре замерзает этот раствор? |
|
|
7 |
Вычислите осмотическое давление раствора, содержащего 16 г сахарозы (С12Н22О11) в 350 г воды при 293 К. Плотность раствора считать равной единице. |
|
|
8 |
При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,450С. Определите молярную массу вещества. |
|
|
9 |
Сколько граммов глюкозы С6Н12О6должно находиться в 0,5 л раствора, чтобы его осмотическое давление при температуре 300С было равно 302 кПа? |
|
|
10 |
Температура кристаллизации водного раствора некоторого вещества равна –3,580С. При какой температуре закипает этот раствор? Какова его моляльная концентрация? |
|
|
11 |
Вычислите массовую долю глюкозы (С6Н12О6) в растворе, зная, что он кипит при 100,260С. |
|
|
12 |
При 250С осмотическое давление раствора, содержащего 2,8 г высокомолекулярного органического вещества в 200 см3раствора равно 0,07 кПа. Определите молярную массу растворенного вещества. |
|
|
13 |
Раствор, содержащий 3,04 г камфары (С10Н16О) в 100 г бензола кипит при 80,7оС. Температура кипения бензола 80,200С. Вычислите эбуллиоскопическую константу бензола. |
|
|
14 |
Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды равна –0,580С. Вычислите молярную массу растворенного вещества. |
|
15 |
Сколько молей неэлектролита должно содержаться в 3 литрах раствора, чтобы его осмотическое давление при 200С было равно 365 кПа? | |


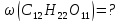
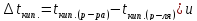 понижение температуры замерзания
(
понижение температуры замерзания
(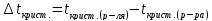 )
раствора пропорциональны его моляльной
концентрации:
)
раствора пропорциональны его моляльной
концентрации: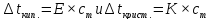 ,
, .
.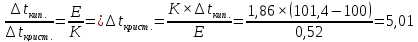
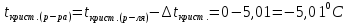
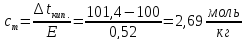
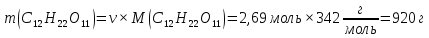
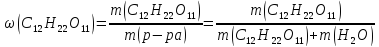
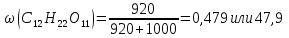

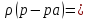 1 г/мл = = 1000 г/дм3
1 г/мл = = 1000 г/дм3