
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
Аккумуляторы
Аккумуляторами называются гальванические элементы многоразового и обратимого действия. Они способны превращать накопленную химическую энергию в электрическую при разрядке, а электрическую в химическую, создавая запас ее в процессе зарядки. Так как э.д.с. аккумуляторов невелика, при эксплуатации их обычно соединяют в батареи.
Свинцовый аккумулятор. Свинцовый аккумулятор состоит из двух перфорированных свинцовых пластин, одна из которых (отрицательная) после зарядки содержит наполнитель - губчатый активный свинец, а другая ( положительная) - диоксид свинца. Обе пластины погружены в 25 - 30 % раствор серной кислоты (рис. 35). Схема аккумулятора
(-) Pb/ p -p H2SO4/ PbO2/Pb(+).
Перед зарядкой в поры свинцовых электродов вмазывается паста, содержащая помимо органического связующего оксид свинца PbO. В результате взаимодействия оксида свинца с серной кислотой в порах электродных пластин образуется сульфат свинца
PbО + H2SO4 = PbSO4+ H2O.
Аккумуляторы заряжают, пропуская электрический ток
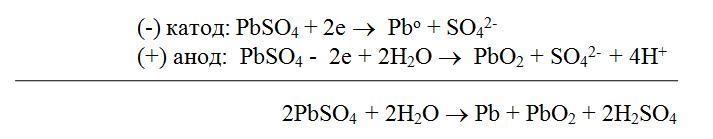
Процесс разрядки

Суммарно процессы, происходящие при зарядке и разрядке аккумулятора, можно представить следующим образом
![]()
При зарядке аккумулятора плотность электролита (серной кислоты) увеличивается, а при разрядке уменьшается. По плотности электролита судят о степени разряженности аккумулятора. Э.д.с. свинцового аккумулятора 2,1 В.
Преимущества свинцового аккумулятора - большая электрическая емкость, устойчивость в работе, большое количество циклов (разрядка- зарядка). Недостатки - большая масса и, следовательно, малая удельная ёмкость, выделение водорода при зарядке, не герметичность при наличии концентрированного раствора серной кислоты. В этом отношении лучше щелочные аккумуляторы.
Щелочные аккумуляторы. К ним относятся кадмиево-никеливые и железо-никелиевые аккумуляторы Т. Эдисона.

Схемы аккумулятора Эдисона и свинцового аккумулятора
|
Томас Эдисон(1847-1931) |
Они сходны между собой. Различие состоит в материале пластин отрицательного электрода. В первом случае они кадмиевые, во втором железные. Электролитом служит раствор КОН ω = 20 %. Наибольшее практическое значение имеют кадмиево-никелевые аккумуляторы. Схема кадмиево-никелевого аккумулятора
(-) Cd / раствор KOH /Ni2O3/Ni (+).
Работа кадмиевого-никелевого аккумулятора основана на окислительно-восстановительной реакции с участием Ni3+
![]()
Э.д.с. заряженного кадмиево-никелевого аккумулятора составляет 1.4 В.
В таблице представлены характеристики аккумулятора Эдисона и свинцового аккумулятора.
Характеристики аккумулятора Эдисона и свинцового аккумулятора
|
|
Аккумулятор Эдисона |
Свинцовый аккумулятор |
|
Окислитель |
Ni2O3 |
PbO2 |
|
Восстановитель |
Fe |
Pb |
|
Электролит |
КОН |
H2SO4 |
|
Напряжение (одного элемента) |
1,35 В |
2,0 В |
|
Особенности |
Легкий Постоянное напряжение
Дорогой
Необходимость перезарядки установить трудно (концентрация электролита постоянна) |
Тяжелый Переменное напряжение при разрядке
Недорогой
Необходимость перезарядки легко установить по напряжению и плотности H2SO4 |
Гальванические источники тока одноразового действия представляют собой унифицированный контейнер, в котором находятся электролит, абсорбируемый активным материалом сепаратора, и электроды (анод и катод), поэтому они называются сухими элементами. Этот термин используется применительно ко всем элементам, не содержащим жидкого электролита. К обычным сухими элементам относятся углеродно-цинковые элементы или элементы Лекланше, напряжение которых составляет 1,5 В.
Сухие элементы применяются при малых токах и прерывистых режимах работы. Поэтому такие элементы широко используются в телефонных аппаратах, игрушках, системах сигнализации и др.
