
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Структура органических соединений
Классификация органических соединений основана на анализе двух аспектов строения молекул – строения углеродного скелета и наличия функциональных групп.

Рис. 1. Классификация органических соединений по строению углеродного скелета.
Основные классы производных углеводородов по наличию функциональных групп:
– галогенопроизводные;
– спирты и фенолы;
– эфиры простые;
– эфиры сложные;
– карбонильные соединения: альдегиды и кетоны;
– карбоновые кислоты;
– сульфокислоты;
– амины;
– нитросоединения;
– элементорганические (в том числе металлорганические) соединения.
Конечно, представленная классификация далеко не полна. Более того, внутри каждого из указанных классов возможны и, конечно, существуют свои интересные и очень ценные классификации.
Очень полезно рассматривать классы органических соединений как гомологические ряды – ряды сходных по строению соединений, обладающих близкими химическими свойствами, в котором отдельные члены ряда отличаются друг от друга лишь количеством групп –СН2–, эта группа называется гомологической разностью. Отметим, что М(СН2) равна 14 г/моль. Следовательно, молярные массы ближайших членов гомологического ряда отличаются на 14 г/моль. У членов гомологического ряда подавляющее большинство реакций протекает одинаково. Следовательно, зная химические реакции лишь одного члена ряда, можно с большой степенью вероятности утверждать, что такого же типа превращения протекают и с остальными членами гомологического ряда.
Для любого гомологического ряда может быть выведена общая формула, отражающая соотношение между атомами углерода и водорода у членов этого ряда; такая формула называется общей формулой гомологического ряда.
Приведем примеры. Забегая несколько вперед и полагая, что читатели учебного пособия знакомы с курсом химии в программе средней школы, отметим следующие.
Общая формула гомологического ряда алкановых углеводородов СnН2n+2, где n – число атомов углерода в молекуле химического соединения. Замена одного атома водорода в любом алкане на гидроксильную группу приводит к образованию предельных одноатомных спиртов на их основе с общей формулой гомологического ряда СnН2n+1ОН. Замена двух атомов водорода приводит к возникновению двухатомных спиртов. Общая формула таких гомологов СnН2n(ОН)2 и так далее. В общем случае имеем формулу гомологического ряда спиртов СnН2n+2-m(ОН)m, где m — число атомов водорода в молекуле алкана, замещённых на гидроксильную группу.
Формула гомологического ряда алкеновых углеводородов (одна двойная связь в молекуле соединений) имеет соответственно вид СnН2n. Тогда замена одного атома водорода приводит к соответствующим одноатомным спиртам с формулой гомологического ряда СnН2n-1ОН. Далее – все как в предыдущем случае. Но заменять атом водорода в алкане можно не только на группу ОН. Замена его на атом галогена приводит к образованию галогенопроизводных с общей формулой гомологического ряда СnН2n+1Hal, где Hal – F, Cl, Br или I. Замена двух атомов водорода на галоген ведет к образованию дигалогенпроизводных и т. д.
Точно таким же образом можно получить формулы гомологических рядов предельных СnН2n+2-m(СООН)m либо непредельных (одна двойная связь) –СnН2n-m(СООН)m карбоновых кислот.
П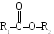 риведем
условные молекулярные формулы некоторых
других классов органических соединений.R1–O–R2
– простые эфиры, продукты взаимодействия
молекул спиртов одной (R1
R2)
или различной природы, Ri
– углеводородные радикалы. Если они не
имеют двойных либо иных ненасыщенных
связей, то можно записать во втором
случае СnН2n+1–О–СmH2m+1
или Сn+mН4n+2О.
В более простом первом случае имеем
(СnН2n+1)2О.
риведем
условные молекулярные формулы некоторых
других классов органических соединений.R1–O–R2
– простые эфиры, продукты взаимодействия
молекул спиртов одной (R1
R2)
или различной природы, Ri
– углеводородные радикалы. Если они не
имеют двойных либо иных ненасыщенных
связей, то можно записать во втором
случае СnН2n+1–О–СmH2m+1
или Сn+mН4n+2О.
В более простом первом случае имеем
(СnН2n+1)2О.
 –
сложные эфиры (продукты взаимодействия
одноатомных спиртов и одноосновных
карбоновых кислот). Вновь, если в
углеводородных радикалах отсутствуют
ненасыщенные связи, можно записать дляR1
R2
–
сложные эфиры (продукты взаимодействия
одноатомных спиртов и одноосновных
карбоновых кислот). Вновь, если в
углеводородных радикалах отсутствуют
ненасыщенные связи, можно записать дляR1
R2
или Сm+nH2(m+n)CO2.
Молекулярные формулы карбонильных соединений имеют вид:
R–CHO– альдегиды или СnН2n+1СНО;
R1–СO–R2– кетоны или дляR1R2СnН2n+1–СОСmH2m+1. Можно последнюю условную молекулярную формулу упростить Сm+nН2(m+n)+2СО. Приведем примеры условных молекулярных формул других классов:
R–SO3H– сульфокислоты или СnН2n+1SO3H;
R–NH2– первичные амины или СnН2n+1NH2;
R–(NH2)2– вторичные амины или СnН2n(NH2)2.
Подобные формулы соответствуют гомологическим рядам предельных аминов (не содержащих ненасыщенных связей в молекулах).
R–NО2– нитросоединения или общая формула предельных соединений СnН2n+1NО2.
Знание формул гомологических рядов важно во многих случаях:
1) для установления конкретных молекулярных формул соединений различных химических классов.
2) для проведения самых различных количественных расчетов. Приведем некоторые примеры.
Задача 1.Получить молекулярную формулу алкана, масса углерода в молекуле которого превышает массу водорода в 5 раз.
Общая формула гомологического ряда алканов, указанная ранее, имеет вид СnН2n+2.
Пусть имеется один моль алкана. Тогда масса углерода равна nM(C), или 12n, г; а масса водорода – (2n+2)M(H).Mi– молярная (так удобнее) масса химического элемента. Учитывая, что для атомарного водорода М(Н) = 1 г/моль, суммарная масса водорода в 1 моле алкана равна (2n+2), г.
Исходя из условий задачи, можно записать
12n/(2n+2) = 5
n= 5 и молекулярная формула алкана имеет вид С5Н12.
Задача 2.Усредненная массовая доля водорода в эквимолярной смеси (равное количество различных молекул) двух алканов равна 0,2. Определить молекулярные формулы входящих в смесь соединений.
Пусть первое соединение имеет формулу СkН2k+2, второе – СpН2p+2.
Примем, что в состав смеси входят по 1 моль первого и второго вещества. Если в состав смеси входят количества вещества в иных соотношениях, ничего не меняется помимо некоторого усложнения расчетов. Масса первого алкана равна М(СkН2k+2), г, второго М(СpН2p+2), г. Суммарная масса водорода в смеси (2k+ 2p+ 4), г, то есть 2(k+p+ 2), г.
Используя условие задачи, запишем
![]() .
.
Из последнего уравнения легко получить зависимость
2(k + p) + 4 = 2,8(k + p) + 0,8; k + p = 4.
Следовательно, k= 1 иp= 3 или наоборот. Отметим, чтоk=p= 2 невозможно, так как смесь не может быть представлена одним (индивидуальным) веществом. Молекулярные формулы алканов СН4и С3Н8.
Укажем на интересный факт. В этом случае вопреки математике можно оценить величины двух неизвестных, имея одно уравнение. Это становится возможным, так как вторую зависимость представляют закономерности органической химии. Однако, это наблюдается только в частных случаях. Например, в несколько более усложненном варианте подобной задачи необходимы дополнительные данные для составления двух уравнений. В качестве примера предлагаем читателям самостоятельно решить следующую задачу.
Задача 3.Усредненная массовая доля водорода в эквимолярной смеси двух алканов равна 0,182, а отношение их молярных масс составляет 0,222. Определить молекулярные формулы входящих в смесь соединений.
Ответ: СН4и С5Н12.
А мы рассмотрим решение следующей задачи.
Задача 4.Оценить отношение масс углерода и водорода в молекулах этиленовых углеводородов. Можно ли в случае этих соединений определить молекулярную формулу вещества, зная подобные соотношения?
Пусть имеется некоторый алкен с молекулярной формулой СnН2n. Тогда отношение масс углерода и водорода легко определить, если принять, что имеется 1 моль веществ. В этом случае масса углерода равна 12n, г, а водорода – 2n, г, что следует из равенства их молярных масс М(С) и М(Н) соответственно 12 г/моль и 1 г/моль. Отношение масс указанных химических элементов для соединений этого класса равно
![]() .
.
Следовательно, оно постоянно для всех соединений гомологического ряда алкенов и определить строение конкретного вещества нельзя.
