
- •1. Кровь. Понятие, физиологические функции.
- •Физиологические функции крови.
- •4. Гемоглобин, строение, свойства, биологическая роль.
- •5. Варианты первичной структуры гемоглобина человека. Гемоглобинопатии.
- •9. Нарушения биосинтеза гема. Порфирии.
- •10. Схема распада гемоглобина. “Непрямой” (неконьюгированный) билирубин.
- •13. Желтухи, причины. Типы желтух. Желтуха новорожденных.
- •14. Диагностическое значение определения билирубина и других желчных пигментов в крови, моче и кале при разных типах желтух.
- •16. Альбумины и глобулины сыворотки крови, содержание в норме, функции. Альбуминово-глобулиновый коэффициент.
- •Ферменты крови. Происхождение ферментов крови, диагностическое значение определения.
- •Кининовая система, представители, физиологическая роль кининов.
- •Белки «острой фазы», представители, диагностическое значение.
- •Ренин-ангиотензиновая система, состав, физиологическая роль.
- •Свертывающая система крови. Общее представление о ферментном каскаде процесса свертывания.
- •Плазменные факторы свертывающей системы крови.
- •Противосвертывающая система крови. Основные первичные и вторичные природные антикоагулянты крови.
- •Фибринолитическая система крови. Механизм действия.
- •Нарушения процессов свертывания крови. Тромботические и геморрагические состояния. Двс синдром.
- •Остаточный азот крови. Понятие, компоненты, содержание в норме. Азотемия, типы, причины возникновения.
- •Обмен железа: всасывание, транспорт кровью, депонирование. Роль железа в процессах жизнедеятельности.
- •Всасывание железа
- •Нарушения обмена железа: железодефицитная анемия, гемохроматоз.
- •Натрий и калий, содержание в крови в норме, суточная потребность, роль в процессах жизнедеятельности. Нарушения обмена натрия и калия.
- •Кальций, содержание в сыворотке крови в норме, роль в процессах жизнедеятельности. Причины и последствия гипо- и гиперкальциемии.
- •Регуляция фосфорно-кальциевого обмена. Роль паратирина, тиреокальцитонина и витамина d в этом процессе.
- •Содержание хлоридов в крови в норме, суточная потребность, роль в процессах жизнедеятельности, нарушения обмена.
- •Регуляция водно-электролитного обмена. Строение и функции альдостерона, вазопрессина и ренин-ангиотензиновой системы, механизм регулирующего действия.
- •Антидиуретический гормон
- •Альдостерон
- •Поддержание рН обеспечивается
- •48. Метаболизм эндогенных и чужеродных токсических веществ в печени: микросомальное окисление, реакции конъюгации.
4. Гемоглобин, строение, свойства, биологическая роль.
Гемоглобин является сложным белком, хромопротеидом, состоящим из белка (глобина) и простетической группы — гема. Одна молекула гемоглобина содержит 4 гема. Гем представляет собой комплекс закисного железа с протопорфирином — сложным органическим соединением, принадлежащим очень важному классу веществ — порфиринам. Гемоблобины выполняют 2 важные функции:
-
перенос О2 из лёгких к периферическим тканям;
-
участие в переносе СО2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина.
Как
мы уже рассматривали выше, в капиллярах
работающей мышцы увеличение концентрации
СО2 и
Н+ уменьшает
сродство гемоглобина к О2 и
увеличивает отдачу его в ткани. При
длительной гипоксии усиливается синтез
2,3-БФГ в эритроцитах, что также снижает
сродство гемоглобина к О2 и
при том же парциальном давлении
О2 увеличивает
его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
5. Варианты первичной структуры гемоглобина человека. Гемоглобинопатии.
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
-
Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей и 2 ? (2?2?).
-
Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 ?- и 2 ?-цепей.
-
Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
-
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2?2?. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
-
Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 ?- и 2 ?-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
Гемоглобинопатии
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12.
6. Схема связывания газов гемоглобином. Карбокси- и метгемоглобин.
Реакцию оксигенации можно записать следующим образом:
НЬ+4O2 ↔НЬ(O2)4.
Связывание гемоглобина с оксидом углерода (карбоксигемоглобин):
НЬ + СО ↔ НbСО.
Связывание СO2:
Hb—NH2 + СO2 ↔ Hb—NHCOOH– + Н+
Метгемоглобин (methemoglobin) - Форма гемоглобина (иногда обозначается как гемоглобин М), в геме которого железо окислено до трехвалентного; неспособен связывать кислород. Метгемоглобин образуется при метгемоглобинемиях. В норме его содержание в крови не превышает 3%.
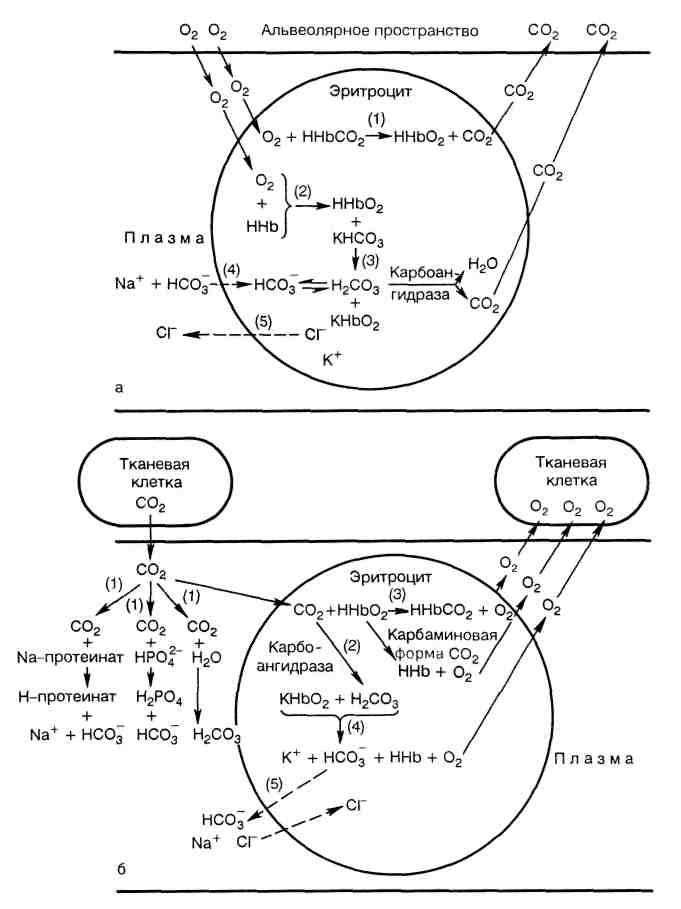
7. Транспорт кровью кислорода и двуокиси углерода (схема).
8. Биосинтез гема (формулы, ферменты) и его регуляция.
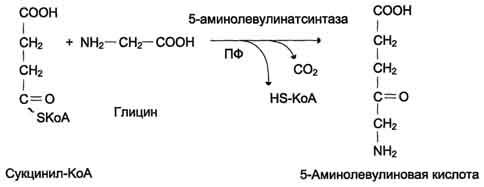
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим
ингибитором и корепрессором синтеза
аминолевулинатсинтазы является гем.
В ретикулоцитах синтез этого фермента
на этапе трансляции регулируетжелезо.
Дефицит пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.

