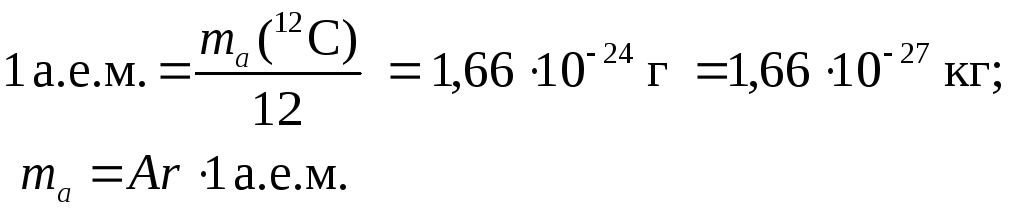- •Министерство здравоохравнения
- •Предисловие
- •Уважаемые школьники!
- •«Медик без довольного познания химии совершен быть не может»! Теоретические основы общей химии
- •Тема 1. Основные понятия и законы химии
- •Типовые задачи с решениями
- •Закон сохранения массы
- •Типовые задачи с решениями
- •Занятие 6. Закон Авогадро и следствия из него
- •6 На занятии проводится тестовый контроль по теме «Типы химических реакций».
- •Типовые задачи с решениями Задача № 1
- •Задача № 2
- •Для нахождения относительной плотности газа надо знать молярные массы: м(газа) и м(н2).
- •Занятие 8. Объемная доля газов в смеси. Молярная доля
- •Типовые задачи с решениями
- •Занятие 9. Вывод формул химических соединений
- •Типовые задачи с решениями
- •Обозначим простейшую формулу РxOy, молекулярную (PxOy)p.
- •1 Способ:
- •2 Способ.
- •3 Способ.
- •Занятие 10, 11
- •Тема 2. Строение атома. Периодический закон, псэ д.И. Менделеева Занятие 12. Строение атома.
- •Типовые задачи с решениями
- •Занятие 13. Строение электронных оболочек атомов
- •Типовые задачи с решениями
- •Символы элементов Электронные формулы
- •6 На занятии проводится тестовый контроль по теме «Строение атома».
- •Занятие 15. Зависимость свойств элементов и их соединений от положения элемента в периодической системе
- •Типовые задачи с решениями
- •Тема 3. Химическая связь Занятие 16. Основные типы химической связи
- •6 На занятии проводится тестовый контроль по теме «Периодический закон и периодическая система д.И. Менделеева».
- •Занятие 17. Строение молекул
- •Типы гибридизации и пространственная конфигурация молекул
- •Типовые задачи с решениями
- •Занятие 18. Ионная, металлическая и водородная связь
- •Типовые задачи с решениями
- •Вещество Типы кристаллической решетки
- •Вещество Типы кристаллической решетки
- •Занятие 19. Химическая связь, валентность и степени окисления элемента
- •6 На занятии проводится тестовый контроль по теме «Химическая связь».
- •Тема 4. Основные закономерности протекания химических реакций
- •Типовые задачи с решениями
- •Занятие 23. Скорость химических реакций
- •Типовые задачи с решениями
- •Занятие 24. Химическое равновесие.
- •Типовые задачи с решениями
- •Тема 5. Растворы. Электролитическая диссоциация Занятие 27. Растворимость веществ
- •Типовые задачи с решениями
- •Занятие 28. Массовая доля растворенного вещества
- •Типовые задачи с решениями
- •Занятие 29. Молярная концентрация растворов. Объемная доля растворенного вещества в растворе.
- •Типовые задачи с решениями
- •Занятие 30. Практическая работа № 1 «Приготовление растворов заданной концентрации»
- •Занятие 31. Теория электролитической диссоциации
- •Типовые упражнения с решениями
- •Занятие 32. Диссоциация воды. Понятие о водородном показателе
- •6 На занятии проводится тестовый контроль по теме «Растворы, растворимость и концентрация веществ в растворе».
- •Типовые задачи с решениями
- •Занятие 33. Гидролиз
- •Типовые задачи с решениями
- •Занятие 34. Реакции обмена в водных растворах электролитов
- •Типовые упражнения с решениями
- •Занятие 35. Практическая работа № 2 «Электролиты. Ионные реакции в растворах»
- •6 На занятии проводится тестовый контроль по теме «Электролитическая диссоциация. Ионные уравнения реакций».
- •Тема 6. Окислительно-восстановительные реакции. Электролиз расплавов и растворов.
- •Типовые упражнения с решениями
- •Занятие 39, 40. Электролиз расплавов и растворов
- •6 На занятии проводится тестовый контроль по теме «овр. Электролиз».
- •Типовые упражнения с решениями
- •Тема 7. Важнейшие классы неорганических соединений.
- •Занятие 41. Оксиды
- •Типовые упражнения с решениями
- •Занятие 42. Кислоты
- •См. Схему стр. 71. Типовые упражнения с решениями
- •Занятие 43. Основания. Амфотерные гидроксиды
- •Типовые упражнения с решениями
- •Занятие 44. Соли
- •Типовые упражнения с решениями
- •Занятие 45. Генетическая связь между классами неорганических соединений
- •Практическая работа № 3 «Классы неорганических соединений»
- •6 На занятии проводится тестовый контроль по теме «Важнейшие классы неорганических соединений».
- •Занятия 47. @Проверочная работа 5. «Важнейшие классы неорганических соединений». Анализ результатов проверочной работы. Коррекция знаний
- •Приложение Метрическая система мер
- •Основные формулы для решения задач
- •Рекомендуемая литература
- •Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
- •Содержание
Основные формулы для решения задач
|
Величина и ее размерность |
Соотношение |
|
Атомная масса элемента Х (относительная) |
|
|
Порядковый номер элемента |
Z = N(е–) = N(р+) |
|
Массовая доля элемента Э в веществе Х, в долях единицы, в %) |
|
|
Количество вещества Х, моль |
|
|
Количество вещества газа, моль |
н.у. – р = 101 325 Па, Т = 273 К |
|
Молярная масса вещества Х, г/моль, кг/моль |
|
|
Масса вещества X, г, кг |
m(X) = n(X)M(X) |
|
Молярный объем газа, л/моль, м3/моль |
Vm = 22,4 л/моль при н.у. |
|
Объем газа, м3 |
V = Vm×n |
|
Выход продукта |
|
|
Плотность вещества Х, г/л, г/мл, кг/м3 |
|
|
Плотность газообразного вещества Х по водороду |
|
|
Плотность газообразного вещества Х по воздуху |
М(воздуха) = 29 г/моль |
|
Объединенный газовый закон |
|
|
Уравнение Менделеева-Клапейрона |
PV = nRT, R = 8,314 Дж/моль×К |
|
Объемная доля газообразного вещества в смеси газов, в долях единицы или в % |
|
|
Молярная масса смеси газов |
|
|
Молярная доля вещества (Х) в смеси |
|
|
Количество теплоты, Дж, кДж |
Q = n(X)Q(X)
|
|
Тепловой эффект реакции |
Q =–H |
|
Теплота образования вещества Х, Дж/моль, кДж/моль |
|
|
Скорость химической реакции (моль/лсек) |
|
|
Закон действия масс (для простой реакции) |
aA + вB = сС + dD u = kс a(A)с в(B)
|
|
Правило Вант-Гоффа |
|
|
Растворимость вещества (Х) (г/100 г растворителя) |
|
|
Массовая доля вещества Х в смеси А + Х, в долях единицы, в % |
|
|
Масса раствора, г, кг |
m(р-р) = m(X) + m(H2O) m(р-р) = V(р-р)(р-р) |
|
Массовая доля растворенного вещества в растворе, в долях единицы, в % |
|
|
Плотность раствора |
|
|
Объем раствора, см3, л, м3 |
|
|
Молярная концентрация, моль/л |
|
|
Степень диссоциации электролита (Х), в долях единицы или % |
|
|
Ионное произведение воды |
K(H2O) = [H+][OH–] |
|
Водородный показатель |
рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова Н.Е. и др. Химия. 8 кл-10 кл.. – М.: Вентана-Граф, 2005-2007.
Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н. Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров А.С. Химия. Новое учебное пособие для подготовки в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров А.С. Самоучитель по решению химических задач. – Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор для поступающих в вузы. Ростов-н/Д, Феникс, 2005– 536 с.
Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский А.И. Учебно-тренировочные материалы для подготовки к централизованному тестированию по химии/ А.И. Врублевский –Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский А.И. 1000 задач по химии с цепочками превращений и контрольными тестами для школьников и абитуриентов.– Мн.: ООО «Юнипресс», 2003.– 400 с.
Егоров А.С. Все типы расчетных задач по химии для подготовки к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров А.С., Аминова Г.Х. Типовые задания и упражнения для подготовки к экзамену по химии. – Ростов н/Д: Феникс, 2005.– 448 с.
Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся/ФИПИ – М.: Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011. Химия. Учебно-тренировочный комплект под ред. А.А. Кавериной.– М.: Национальное образование, 2011.
Единственные реальные варианты заданий для подготовки к единому государственному экзамену. ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова. М.: Федеральный центр тестирования, 2007.–151с.
Каверина А.А. Оптимальный банк заданий для подготовки учащихся. Единый государственный экзамен 2012.Химия. Учебное пособие./ А.А. Каверина, Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.– М.: Интеллект-Центр, 2012.– 256 с.
Литвинова Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева М.В. Тестовые задания в дополнение к контрольным работам для слушателей 10-месячных заочных подготовительных курсов (методические указания). Краснодар, 2004. – С. 18 – 70.
Литвинова Т.Н. Химия. ЕГЭ-2011. Тренировочные тесты. Ростов н/Д: Феникс, 2011.– 349 с.
Литвинова Т.Н. Химия. Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. - 284 с.
Литвинова Т.Н. Химия. Законы, свойства элементов и их соединений. Ростов н/Д.: Феникс, 2012. - 156 с.
Литвинова Т.Н., Мельникова Е.Д., Соловьева М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в вузы.– М.: ООО «Изд-во Оникс»: ООО «Изд-во «Мир и образование», 2009.– 832 с.
Учебно-методический комплекс по химии для учащихся медико-биологических классов под ред. Т.Н.Литвиновой.– Краснодар.: КГМУ, – 2008.
Химия. ЕГЭ–2008. Вступительные испытания, учебно-методическое пособие / под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2008.– 271 с
Список сайтов по химии:
1. Alhimik. http://www.alhimik.ru
2. Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3. Школьная химия – справочник. http://www.schoolchemistry.by.ru
4. Репетитор по химии. http://www. chemistry.nm.ru
Интернет-ресурсы
Alhimik. http://www.alhimik.ru
Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
Школьная химия – справочник. http://www.schoolchemistry.by.ru
http://www.classchem.narod.ru
Репетитор по химии. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm - образовательные ресурсы Интернета по химии
http://schoolchemistry.by.ru/ - школьная химия. На этом сайте есть возможность пройти On-line тестирование по разным темам, а также демонстрационные варианты Единого Государственного Экзамена
Химия и жизнь–ХХ1 век: научно-популярный журнал. http://www.hij.ru