
- •Министерство здравоохравнения
- •Предисловие
- •Уважаемые школьники!
- •«Медик без довольного познания химии совершен быть не может»! Теоретические основы общей химии
- •Тема 1. Основные понятия и законы химии
- •Типовые задачи с решениями
- •Закон сохранения массы
- •Типовые задачи с решениями
- •Занятие 6. Закон Авогадро и следствия из него
- •6 На занятии проводится тестовый контроль по теме «Типы химических реакций».
- •Типовые задачи с решениями Задача № 1
- •Задача № 2
- •Для нахождения относительной плотности газа надо знать молярные массы: м(газа) и м(н2).
- •Занятие 8. Объемная доля газов в смеси. Молярная доля
- •Типовые задачи с решениями
- •Занятие 9. Вывод формул химических соединений
- •Типовые задачи с решениями
- •Обозначим простейшую формулу РxOy, молекулярную (PxOy)p.
- •1 Способ:
- •2 Способ.
- •3 Способ.
- •Занятие 10, 11
- •Тема 2. Строение атома. Периодический закон, псэ д.И. Менделеева Занятие 12. Строение атома.
- •Типовые задачи с решениями
- •Занятие 13. Строение электронных оболочек атомов
- •Типовые задачи с решениями
- •Символы элементов Электронные формулы
- •6 На занятии проводится тестовый контроль по теме «Строение атома».
- •Занятие 15. Зависимость свойств элементов и их соединений от положения элемента в периодической системе
- •Типовые задачи с решениями
- •Тема 3. Химическая связь Занятие 16. Основные типы химической связи
- •6 На занятии проводится тестовый контроль по теме «Периодический закон и периодическая система д.И. Менделеева».
- •Занятие 17. Строение молекул
- •Типы гибридизации и пространственная конфигурация молекул
- •Типовые задачи с решениями
- •Занятие 18. Ионная, металлическая и водородная связь
- •Типовые задачи с решениями
- •Вещество Типы кристаллической решетки
- •Вещество Типы кристаллической решетки
- •Занятие 19. Химическая связь, валентность и степени окисления элемента
- •6 На занятии проводится тестовый контроль по теме «Химическая связь».
- •Тема 4. Основные закономерности протекания химических реакций
- •Типовые задачи с решениями
- •Занятие 23. Скорость химических реакций
- •Типовые задачи с решениями
- •Занятие 24. Химическое равновесие.
- •Типовые задачи с решениями
- •Тема 5. Растворы. Электролитическая диссоциация Занятие 27. Растворимость веществ
- •Типовые задачи с решениями
- •Занятие 28. Массовая доля растворенного вещества
- •Типовые задачи с решениями
- •Занятие 29. Молярная концентрация растворов. Объемная доля растворенного вещества в растворе.
- •Типовые задачи с решениями
- •Занятие 30. Практическая работа № 1 «Приготовление растворов заданной концентрации»
- •Занятие 31. Теория электролитической диссоциации
- •Типовые упражнения с решениями
- •Занятие 32. Диссоциация воды. Понятие о водородном показателе
- •6 На занятии проводится тестовый контроль по теме «Растворы, растворимость и концентрация веществ в растворе».
- •Типовые задачи с решениями
- •Занятие 33. Гидролиз
- •Типовые задачи с решениями
- •Занятие 34. Реакции обмена в водных растворах электролитов
- •Типовые упражнения с решениями
- •Занятие 35. Практическая работа № 2 «Электролиты. Ионные реакции в растворах»
- •6 На занятии проводится тестовый контроль по теме «Электролитическая диссоциация. Ионные уравнения реакций».
- •Тема 6. Окислительно-восстановительные реакции. Электролиз расплавов и растворов.
- •Типовые упражнения с решениями
- •Занятие 39, 40. Электролиз расплавов и растворов
- •6 На занятии проводится тестовый контроль по теме «овр. Электролиз».
- •Типовые упражнения с решениями
- •Тема 7. Важнейшие классы неорганических соединений.
- •Занятие 41. Оксиды
- •Типовые упражнения с решениями
- •Занятие 42. Кислоты
- •См. Схему стр. 71. Типовые упражнения с решениями
- •Занятие 43. Основания. Амфотерные гидроксиды
- •Типовые упражнения с решениями
- •Занятие 44. Соли
- •Типовые упражнения с решениями
- •Занятие 45. Генетическая связь между классами неорганических соединений
- •Практическая работа № 3 «Классы неорганических соединений»
- •6 На занятии проводится тестовый контроль по теме «Важнейшие классы неорганических соединений».
- •Занятия 47. @Проверочная работа 5. «Важнейшие классы неорганических соединений». Анализ результатов проверочной работы. Коррекция знаний
- •Приложение Метрическая система мер
- •Основные формулы для решения задач
- •Рекомендуемая литература
- •Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
- •Содержание
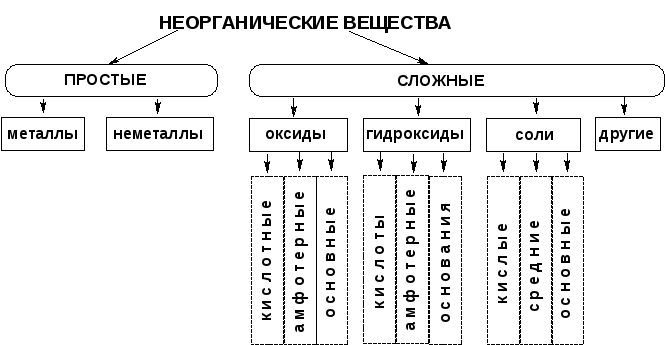
Тема 7. Важнейшие классы неорганических соединений.
Занятие 41. Оксиды
& Вопросы для самостоятельной подготовки
Назовите важнейшие классы сложных неорганических веществ.
Оксиды: определение, номенклатура.
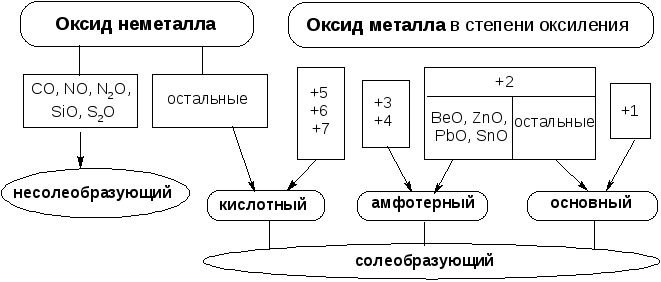
Классификация оксидов: несолеобразующие, солеобразующие, основные, амфотерные, кислотные.
Способы получения оксидов.
Химические свойства солеобразующих оксидов.
Типовые упражнения с решениями
Задача № 1
Установите соответствие между оксидом и характером свойств соответствующего ему гидроксида.
Оксид Характер свойств гидроксида
1) As2O5 А) кислотный
2) BeO Б) амфотерный
3) Cl2O7 В) основной
4) MgO
Решение:
Неметаллы образуют кислотные оксиды, следовательно, As2O5 и Cl2O7 – кислотные оксиды.
Кислотные оксиды – это оксиды, гидратами которых являются кислоты. Оксидам As2O5 и Cl2O7 соответствуют кислотные гидроксида (ответ А).
ВеО – амфотерный оксид, ему соответствует амфотерный гидроксид (ответ Б).
MgО – основный оксид, которому соответствует основный шгидроксид (ответ В).
Ответ
|
1 |
2 |
3 |
4 |
|
А |
Б |
А |
В |
Задача № 2
Установите соответствие между простым веществом и общей формулой кислородного соединения, который образуется при его полном сгорании.
Вещество Общая формула кислородного соединения
1) фосфор А) Э2O
2) натрий Б) Э2O2
3) сера В) ЭO
4) хром Г) Э2O3
Д) ЭO2
Е) Э2O5
Решение:
Фосфор – элемент VА группы, его высший оксид Р2О5 (ответ Е).
4Р + 5О2 (;(;t 2Р2О5
При взаимодействии натрия с кислородом преимущественно образуется пероксид натрия 2Na + O2 (;(;t Na2O2 (ответ Б).
S + O2 (;(;t SO2 (ответ Д); 4Cr + 3O2 (;(;t 2Cr2O3 (ответ Д).
Ответ
|
1 |
2 |
3 |
4 |
|
Е |
Б |
Д |
Г |
Упражнения и задачи для самостоятельного решения
Классифицируйте следующие оксиды: SO2, Na2O, MnO, CrO, Cr2O3, Mn2O7, N2O, ZnO, CO, Ag2O, P2O5, CrO3.
Напишите формулы и названия оксидов, соответствующих следующим гидроксидам: LiOH, HClO, H3AsO4, H3AsO3, HАsO3, HNO2, Al(OH)3.
Напишите уравнения реакций (не менее четырех) получения оксида серы(IV), оксида алюминия, оксида бария.
С какими из следующих веществ будет реагировать оксид серы(IV): CaO, NaCl, KOH, AgNO3, ZnO, P2O5.
Оксид азота содержит 30,43% азота и 69,57% кислорода. Плотность оксида по водороду 23. Выведите формулу оксида.
В 50 г воды растворили 18,8 г оксида калия. Определите массовую долю гидроксида калия в полученном растворе. (Ответ: 32,56%)
Приведите три примера реакций между оксидами элементов 2-го периода и оксидами элементов 4-го периода.
![]() Дополнительные
задания
Дополнительные
задания
Приведите два уравнения реакций, соответствующих схеме:
оксид + кислота оксид + кислота.
Закончите уравнения реакций:
SrO + H2O ; Cs2O + H2O ; SO2 + H2O ; SO3 + H2O;
SO3 + Na2O ; Al2O3 + P2O5 ; ZnO + H2SO4;
ZnO + Na2O; CaO + Al2O3.
Напишите не менее четырех уравнений реакций получения: а) оксида азота(II); б) оксида железа(III); в) оксида цинка.
С какими из следующих веществ будет реагировать оксид серы(IV): MgO, LiCl, KNO3, KOH, ZnO, H2O? Напишите уравнения соответствующих реакций.
