
- •Министерство здравоохравнения
- •Предисловие
- •Уважаемые школьники!
- •«Медик без довольного познания химии совершен быть не может»! Теоретические основы общей химии
- •Тема 1. Основные понятия и законы химии
- •Типовые задачи с решениями
- •Закон сохранения массы
- •Типовые задачи с решениями
- •Занятие 6. Закон Авогадро и следствия из него
- •6 На занятии проводится тестовый контроль по теме «Типы химических реакций».
- •Типовые задачи с решениями Задача № 1
- •Задача № 2
- •Для нахождения относительной плотности газа надо знать молярные массы: м(газа) и м(н2).
- •Занятие 8. Объемная доля газов в смеси. Молярная доля
- •Типовые задачи с решениями
- •Занятие 9. Вывод формул химических соединений
- •Типовые задачи с решениями
- •Обозначим простейшую формулу РxOy, молекулярную (PxOy)p.
- •1 Способ:
- •2 Способ.
- •3 Способ.
- •Занятие 10, 11
- •Тема 2. Строение атома. Периодический закон, псэ д.И. Менделеева Занятие 12. Строение атома.
- •Типовые задачи с решениями
- •Занятие 13. Строение электронных оболочек атомов
- •Типовые задачи с решениями
- •Символы элементов Электронные формулы
- •6 На занятии проводится тестовый контроль по теме «Строение атома».
- •Занятие 15. Зависимость свойств элементов и их соединений от положения элемента в периодической системе
- •Типовые задачи с решениями
- •Тема 3. Химическая связь Занятие 16. Основные типы химической связи
- •6 На занятии проводится тестовый контроль по теме «Периодический закон и периодическая система д.И. Менделеева».
- •Занятие 17. Строение молекул
- •Типы гибридизации и пространственная конфигурация молекул
- •Типовые задачи с решениями
- •Занятие 18. Ионная, металлическая и водородная связь
- •Типовые задачи с решениями
- •Вещество Типы кристаллической решетки
- •Вещество Типы кристаллической решетки
- •Занятие 19. Химическая связь, валентность и степени окисления элемента
- •6 На занятии проводится тестовый контроль по теме «Химическая связь».
- •Тема 4. Основные закономерности протекания химических реакций
- •Типовые задачи с решениями
- •Занятие 23. Скорость химических реакций
- •Типовые задачи с решениями
- •Занятие 24. Химическое равновесие.
- •Типовые задачи с решениями
- •Тема 5. Растворы. Электролитическая диссоциация Занятие 27. Растворимость веществ
- •Типовые задачи с решениями
- •Занятие 28. Массовая доля растворенного вещества
- •Типовые задачи с решениями
- •Занятие 29. Молярная концентрация растворов. Объемная доля растворенного вещества в растворе.
- •Типовые задачи с решениями
- •Занятие 30. Практическая работа № 1 «Приготовление растворов заданной концентрации»
- •Занятие 31. Теория электролитической диссоциации
- •Типовые упражнения с решениями
- •Занятие 32. Диссоциация воды. Понятие о водородном показателе
- •6 На занятии проводится тестовый контроль по теме «Растворы, растворимость и концентрация веществ в растворе».
- •Типовые задачи с решениями
- •Занятие 33. Гидролиз
- •Типовые задачи с решениями
- •Занятие 34. Реакции обмена в водных растворах электролитов
- •Типовые упражнения с решениями
- •Занятие 35. Практическая работа № 2 «Электролиты. Ионные реакции в растворах»
- •6 На занятии проводится тестовый контроль по теме «Электролитическая диссоциация. Ионные уравнения реакций».
- •Тема 6. Окислительно-восстановительные реакции. Электролиз расплавов и растворов.
- •Типовые упражнения с решениями
- •Занятие 39, 40. Электролиз расплавов и растворов
- •6 На занятии проводится тестовый контроль по теме «овр. Электролиз».
- •Типовые упражнения с решениями
- •Тема 7. Важнейшие классы неорганических соединений.
- •Занятие 41. Оксиды
- •Типовые упражнения с решениями
- •Занятие 42. Кислоты
- •См. Схему стр. 71. Типовые упражнения с решениями
- •Занятие 43. Основания. Амфотерные гидроксиды
- •Типовые упражнения с решениями
- •Занятие 44. Соли
- •Типовые упражнения с решениями
- •Занятие 45. Генетическая связь между классами неорганических соединений
- •Практическая работа № 3 «Классы неорганических соединений»
- •6 На занятии проводится тестовый контроль по теме «Важнейшие классы неорганических соединений».
- •Занятия 47. @Проверочная работа 5. «Важнейшие классы неорганических соединений». Анализ результатов проверочной работы. Коррекция знаний
- •Приложение Метрическая система мер
- •Основные формулы для решения задач
- •Рекомендуемая литература
- •Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
- •Содержание
Занятие 17. Строение молекул
Повторите: электроотрицательность элементов, свойства ковалентной связи.
Вопросы для самостоятельной подготовки
Пространственное строение молекул, валентный угол.
Понятие о гибридизации атомных орбиталей.
Как влияет тип гибридизации на форму молекул?
Типы гибридизации и пространственная конфигурация молекул
|
Атомные орбитали, участвующие в гибридизации |
Тип гибридизации |
Пространственная форма и валентный угол |
Примеры соединений |
|
s, p |
sp |
Линейная, 180 |
BeCl2, C2H2, [Ag(NH3)2]+ |
|
s, p, p |
sp2 |
Плоский треугольник, 120 |
BF3, C2H4, NO3– |
|
s, p, p, p |
sp3 |
Тетраэдрическая, 10928/ |
СН4,
|
Типовые задачи с решениями
Задача № 1
Опишите пространственную структуру следующих молекул: ВF3, ВеCl2.
Решение:
1. Фторид бора, ВF3. Пространственная структура этой молекулы определяется тем, что при образовании связей В–F происходит гибридизация одной s- и двух р-орбиталей атома бора (sр2-гибридизация), при этом образуются три одинаковые sp2-гибридные атомные орбитали (АО), расположенные под углом 120о друг к другу.
Т аким
образом, ВF3
– плоская молекула, с углом 120о
между связями.
аким
образом, ВF3
– плоская молекула, с углом 120о
между связями.
В* n = 2


sp2-гибридные АО
![]()
б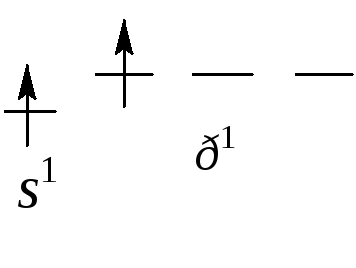 )
Хлорид бериллия ВеCl2.
При образовании молекулы происходит
sр-гибридизация
орбиталей атома бериллия, возникают
химические связи, направленные под
углом 180о
друг к другу. Молекула линейная.
)
Хлорид бериллия ВеCl2.
При образовании молекулы происходит
sр-гибридизация
орбиталей атома бериллия, возникают
химические связи, направленные под
углом 180о
друг к другу. Молекула линейная.
Ве* n = 4

sp-гибридные АО

![]()
Гибридизация электронных орбиталей характерна для соединений любых элементов, когда связи образуются электронами, принадлежащими к разным, но близким по энергии орбиталям.
Упражнения и задачи для самостоятельного решения.
Изобразите схемы перекрывания электронных облаков в молекулах BeF2, BCl3, CCl4, H2O, PH3. Укажите валентный угол и форму молекулы.
В каком гибридном состоянии находятся атомы азота и кислорода в молекулах аммиака и воды соответственно? Чем объясняется изменение величины угла в этих молекулах по сравнению с величиной угла, соответствующего этому типу гибридизации?
Дипольный моменты в молекулах СО2 и CS2 равны нулю. Какова пространственная структура этих молекул? Изобразите схему образования связей.
Какой тип гибридизации характерен для кремния в SiCl4? Нарисуйте схемы перекрывания облаков в данной молекуле. Какова геометрическая форма молекулы? Является ли она полярной или неполярной?
Укажите молекулы и ионы, в которых центральный атом находится в sp3-гибридном состоянии: Н2О, SF6, NH
 ,
CCl4,
[AlF6]3–.
,
CCl4,
[AlF6]3–.Выберите соединения с линейной структурной молекулы: Н2О, SO2, CO2, CS2.
Молекула BF3 легко присоединяет молекулу HF. Напишите формулу полученного соединения, укажите схему образования связей в образовавшейся молекуле.
Занятие 18. Ионная, металлическая и водородная связь
Вопросы для самостоятельной подготовки
Какая связь называется ионной? Между атомами каких элементов возникает ионная связь?
Какую связь называют металлической? Что общего и чем отличается эта связь от ковалентной?
Какую связь называют водородной, ее разновидности, значение?
Какие существуют типы кристаллических решеток?
Какие кристаллические решетки образуют вещества с ковалентной, ионной и металлической связью?
Как влияет тип кристаллической решетки на физические свойства веществ? Чем отличаются кристаллические вещества от аморфных?
