
МЕДИЦИНСКАЯ ХИМИЯ
.pdf71
В норме, по-видимому, существует сбалансированная функциональная активность пре- и постсинаптических ДР в головном мозге. При нарушении этого баланса возникают "положительные" (галлюцинации, бред, расстройства мышления) или "отрицательные" (эффективные уплощения, бедность речи и потеря интереса к жизни) симптомы шизофрении.
В связи с этим нейролептики эффективны для лечения "положительных" симптомов шизофрении и могут усиливать "отрицательные" симптомы её.
Большинство фармакологических эффектов дофаминовых агонистов опосредовано D2R. Примерно 50% D3R локализовано пресинаптически. Они выполняют функцию дофаминовых ауторецепторов в ЦНС.
С помощью дигитонина и гельфильтрации выделены D2R из полосатого тела головного мозга человека и собаки. Рецепторы человека и собаки оказались сходными, благодаря чему D2R собаки могут быть использованы в рецепторных исследованиях.
Подобным же образом выделены D3R полосатого тела головного мозга собаки. D2R и D3R оказались различными макромолекулами.
8.4Некоторые функции дофаминовых рецепторов:
-Постсинаптический D2R полосатого тела головного мозга:
Стимуляция двигательной активности, поведенческие реакции, блокируемые нейролептиками.
- Постсинаптический D2R гипофиза: ингибирование секреции гипофизарных гор-
монов.
-Постсинаптический D1R паращитовидной железы: высвобождение гормонов.
-Постсинаптический D1R кишечника и сосудов почек: расслабление гладких мышц.
-Пресинаптические ДR дофаминергических нервных окончаний: ингибиторы высвобождения дофамина.
-Пресинаптические D1- и D2R норадренергических нервных окончаний: ингибитор высвобождения норадреналин.
-ДP поджелудочной железы: регуляция секреции панкреатического полипептида и бикарбонатов.
-ДP канальцев почек: регуляция натрийуреза.
8.5. Конформация дофамина предпочтительная для его взаимодействия с дофаминовыми рецепторами.
С помощью синтеза и тестирования модельных соединений удалось установить какая из пространственных форм медиатора предпочтительнее для образования лиганд-
72
рецепторного комплекса. Рассматривались свернутая 1 конформация и развёрнутая в виде α-
(2) и β-ротамера 3.
HO |
|
|
NH2 |
HO |
NH2 |
|
|
|
|
||
HO |
NH2 |
HO |
|
HO |
|
|
OH |
2 |
3 |
||
|
1 |
||||
|
|
||||
В качестве модельных соединений были использованы норсалинол 4, |
|||||
аминодиокситетрагидронафтамин 5 и его изомер 6. |
|
|
|||
HO |
|
|
NH2 |
HO |
NH2 |
|
|
|
|
||
HO |
NH |
HO |
|
HO |
|
|
|
|
|||
Норсалинол |
OH |
|
|
||
5 |
|
6 |
|||
|
4 |
|
|
||
|
Аминодиокситетрагидронафталины |
|
|||
Оказалось, что наибольшей дофаминоподобной активностью обладает β-ротамер 6. Отсюда был сделан вывод о том, что комплементарен дофаминовому рецептору дофамин в конформации β-ротамера 6.
8.6. Некоторые особенности связывания лигандов с дофаминовыми рецепторами.
Агонисты ДР должны иметь гидроксильную группу, аналогичную таковой в 3-м положении дофамина. Эта группа участвует в образовании Н-связи с ДР. Вторая гидроксильная группа играет вспомогательную роль. Её может не быть.
Сродство к рецептору увеличивается с ростом липофильности лиганда. У наиболее активных агонистов атом азота расположен на расстоянии 6Å от плоскости кольца. Расстояние между гидроксильными группамми и атомом азота около 7Å.
HO |
|
o |
|
o |
6 A |
||
|
|||
|
7 A |
N |
|
|
O |
|
|
|
H |
|
Рис. 16. Схема связывания аналогов дофамина с ДР.
Связывание антагонистов с ДР также характеризуется стереоспецифичностью.
(+)-Бутакламол в 10 000 раз сильнее вытесняет 3Н-сульпирид из его комплекса с D2R мембран полосатого тела головного мозга крыс, чем (-)-бутакламол.
73
8.7.Дофаминергические лекарственные средства.
Фенотиазиновые нейролептики применяются в медицине ещё с 50-х годов ХХ века. Однако только недавно стало известно, что фенотиазины и бутирофеноны блокируют ДР.
Нет нейролептика, который бы не блокировал ДР.
Различные нейролептики отличаются по их влиянию на различные нейромедиаторные системы, что определяет спектр их психофармакологических свойств.
Нарушение медиаторных функций дофамина является одним из патологических механизмов болезни Паркинсона и других экстрапирамидных расстройств.
Мишенью для нейролептиков являются, в основном, Д2Р.
На дофаминергиеские процессы прежде всего влияют фторфеназин, галоперидол, сульпирид.
S |
|
|
|
|
|
|
|
CONH-CH2 |
|
|||
|
|
|
|
|
|
|
|
|
|
N |
||
|
|
|
|
|
|
CF3 |
|
|
|
O CH3 |
||
N |
|
|
|
|
|
|
C2H5 |
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
(CH2)3 N |
N |
CH2CH2OH |
H2NO2S |
|
||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Фторфеназин |
|
|
Сульпирид |
|
|||||
Впатогенезе болезни Паркинсона важную роль играет снижение активности дофаминергических процессов.
При парксинсонизме уменьшено содержание дофамина в базальных ганглиях.
Всилу этого обстоятельства при лечении болезни Паркинсона эффективны средства, стимулирующие функции дофаминергических систем мозга (L-дофа, мидантан).
HO
HO
 CH2CH(NH2)COOH. (-)-Леводопа (допа или дофа - сокр.)
CH2CH(NH2)COOH. (-)-Леводопа (допа или дофа - сокр.)
Дофамин плохо проникает через гематоэнцефалический барьер. Поэтому может быть применен его предшественник – дофа, который при пероральном приёме всасывается, проникает в ЦНС и превращается в дофамин.
 NH2. HCl
NH2. HCl
Мидантан (амантадин гидрохлорид).
74
Мидантан стимулирует выделение дофамина из нейрональных депо и повышает чувствительность дофаминергических рецепторов к дофамину.
Основным способом его введения является медленная капельная инфузия.
Дофамин применяют для улучшения гемодинамики при острой сердечной и сосудистой недостаточности.
9. СЕРОТОНИНОВЫЕ РЕЦЕПТОРЫ И ИХ ЛИГАНДЫ
Нейромедиатор и гормон эпифиза серотонин (5-гидрокситриптамин, 5-НТ) – лиганд большого семейства серотониновых рецепторов. В организме человека он управляет такими физиологическими процессами как сон, терморегуляция, аппетит, сексуальное поведение, обучение и память, регуляция тонуса сосудов и сердца, агрессивность, алкогольная зависимость, галлюцинации. Его иногда называют гормоном хорошего настроения. Серотонин вовлечён в патогенез тревожных состояний, депрессии, мигрени, шизофрении и ряда нейродегеративных нарушений (болезни Альцгеймера и Паркинсона, хорея Хантингтона). Этот биорегулятор функционирует в центральной и периферической нервной системах, в ряде внутренних органов и тканей.
В1884 г. Стивенсон и Ли впервые сообщили о присутствии в сыворотке, образующейся при свёртывании крови, эндогенного вещества, повышающего тонус кровеносных сосудов. Затем рядом исследователей из тромбоцитов, слизистой оболочки желудка, кишечника, кровеносных сосудов и других органов были выделены эндогенные вещества, обладающие сосудосуживающим действием.
Раппопорту в 1947 г. удалось показать, что ответственным за этот эффект является одно вещество – 5-гидрокситриптамин (5-НТ). Оно было выделено из сыворотки крови быка, очищено до индивидуального состояния, химически идентифицировано и получило название серотонин (от латинского слова serum). Синтез серотонина осуществили Фишер и Хэмлин в 1951 г. В 1953 г. это вещество было обнаружено в мозге млекопитающих, включая и человека. В 1954 г. Амин, изучавший распространение серотонина в мозге собак, впервые высказал предположения о том, что 5-НТ является нейротрансмитером.
Ворганизме серотонин образуется из L-триптофана.
Дезактивация серотонина осуществляется с помощью фермента МАО-А. Образовавшийся при этом 5-гидроксииндолилацетальдегид далее окисляется до 5-гидроксииндолил- уксусной кислоты ферментом альдегиддегидрогеназой.
75
|
O |
|
|
|
O |
|
Триптофан-5- |
|
|
OH |
|
|
OH |
|
|
||
|
гидроксилаза |
HO |
N |
NH2 |
|
|
NH2 |
|
|||
N |
|
|
|||
|
|
H |
|
||
H |
|
|
|
5-Гидрокситриптофан- |
|
|
|
|
|
||
|
|
|
|
дeкарбоксилаза |
|
HO |
CHO |
МАО-А |
HO |
|
|
|
|
|
|||
|
|
|
|
NH2 |
|
N |
|
|
|
N |
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
Альдeгид- |
|
|
|
|
|
|
Сeротонин |
|
|
|
|
дeгидрогeназа |
|
|
|
|
|
|
|
|
|
O
HO
OH
N
H
Основное количество серотонина синтезируется в цитоплазме энтерохромаффинных клеток слизистой оболочки желудочно-кишечного тракта и находится в запасающих гранулах этих клеток. Серотонин, поступивший в плазму крови, захватывается тромбоцитами. Сами тромбоциты не способны синтезировать серотонин, они лишь обеспечивают его транспорт и сохранение. Помимо тромбоцитов способностью захватывать и сохранять серотонин обладают гранулы тучных клеток грызунов и человека, но они, в отличие от тромбоцитов, способны также и синтезировать серотонин.
Максимальное содержание серотонина в периферических органах локализовано в тромбоцитах, 12-ти перстной кишке, тонком кишечнике, поджелудочной железе и соединительной ткани.
В ЦНС человека содержится около 2% всего серотонина. Наибольшее его количество обнаружено в шишковидной железе (эпифизе), расположенной между передними буграми четверохолмия головного мозга. Богаты серотонином гипоталамическая область, средний мозг и ядра шва, значительно меньше его содержание в коре головного мозга и мозжечка.
Серотонин почти не проникает через гематоэнцефалический барьер. В областях мозга, богатых серотонином, обнаружены ферменты его синтеза. Установлено, что в ЦНС биосинтез серотонина происходит в цитоплазме клеток нервных окончаний. Он накапливается в синаптических пузырьках, выделяется под влиянием нервных импульсов в синаптическую щель, где взаимодействует с серотониновыми рецепторами.
76
В ЦНС человека серотонин выполняет функции медиатора серотонинергических нейронов и модулятора действия других нейромедиаторов.
Агонисты серотониновых рецепторов:
HO |
|
|
|
|
|
|
|
|
CH3O |
|
|
|
|
|
|
|
|
|
|
|
|
N(CH ) |
|
|
|
|
|
|
|
|
N(CH3)3 |
||||
N |
|
|
|
|
|
|
N |
|
|||||||||
|
|
|
|
|
|
3 3 |
|
|
|
|
|
|
|
||||
H |
|
Буфoтeнин |
|
|
|
H |
|
|
|
|
|||||||
|
|
N,N-Димeтил-5-мeтокситриптамин |
|
||||||||||||||
|
|
N |
|
N |
|
NH |
|
|
CF3 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
NH |
|
Квипазин |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
1-(м-Трифтормeтил)фeнилпипeразин |
|||||||||||
|
|
|
|
|
|
|
Cl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МК-212 |
|
|
|
|
|
|
|
|
|
Антагонисты серотониновых рецепторов: |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
H |
|
O |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
N(C2H5)2 |
|
|
N |
|
OCH2C6H5 |
|
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
N |
|
|
CH3 |
|
|
|
N |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
N |
N |
|
H |
H |
|
LSD-25 |
Мeтeрголин |
|
|
S |
|
|
CH3 |
|
N |
S |
|
N |
||
|
||
CH3 |
N |
|
Миансeрин |
CH3 |
|
Мeтиотeпин |
77
9.1. Гетерогенность серотониновых рецепторов.
В 1957 г. Гэддум и Пикарелли установили существование двух типов серотониновых рецепторов: D-рецепторов, идентифицируемых с помощью дибензимина и М-рецепторов, идентифицируемых с помощью морфина. Перутка и Снайдер предложили деление серотониновых рецепторов на 5-НТ1, идентифицируемые с помощью серотонина с радиоактивной меткой и 5-НТ2, идентифицируемые с помощью радиомеченого спиперона.
В настоящее время семейство серотониновых рецепторов содержит 7 типов (5-НТ1-7) (табл. 9). Кроме того, обнаружен ещё один тип серотониновых рецепторов у дрозофилы (5-
НТd202).
|
Типы и подтипы серотониновых рецепторов |
Таблица 9 |
|||
|
|
||||
|
|
|
|
|
|
Рецептор |
Структура |
Агонисты |
Антагонисты |
Фармакологические свойства |
|
5-НТ1А |
422АК, 7ТМД |
8-OH-DPAT |
WAY 100635 |
анксиолитические, |
|
|
|
|
|
антидепрессивные |
|
5-НТ1В |
390АК, 7ТМД |
суматриптан |
GR 55562 |
коронарорасширяющие, |
|
|
|
|
|
антидепрессивные |
|
5-НТ1D |
377АК, 7ТМД |
суматриптан |
BRL 15572 |
антимигренозные |
|
5-НТ1E |
365АК, 7ТМД |
|
|
|
|
5-НТ1F |
366АК, 7ТМД |
LY 334370 |
|
антимигренозные |
|
5-НТ2А |
471АК, 7ТМД |
α-Ме-5-НТ |
кетансерин |
регуляторы |
мышечного |
|
|
|
|
сокращения, |
|
|
|
|
|
психомиметические, |
|
|
|
|
|
нейролептические |
|
5-НТ2B |
481АК, 7ТМД |
BW 723C86 |
SBB 200646 |
анксиолитические |
|
5-НТ2C |
458АК, 7ТМД |
α-Ме-5-НТ |
месулергин |
снотворные |
|
5-НТ3 |
478АК, |
м-хлорфенил- |
ондасетрон |
нейролептические, |
|
|
α-субъеденицы, |
бигуанид |
|
противорвотные, |
|
|
гомопентамер |
|
|
антидепрессивные, |
|
|
|
|
|
анальгетические |
|
5-НТ4 |
387АК, 7ТМД |
DIMU8 |
GR 113808 |
антиаритмические, |
|
|
|
|
|
восстановление когнитивных |
|
|
|
|
|
процессов |
|
5-НТ5А |
357АК, 7ТМД |
|
|
|
|
5-НТ5B |
370АК, 7ТМД |
|
|
|
|
5-НТ6 |
440АК, 7ТМД |
|
Ro 046790 |
|
|
5-НТ7 |
445АК, 7ТМД |
|
SB 258719 |
|
|
5-НТ1-Рецепторы ингибируют активность центральных и периферических нейронов. Пресинаптические 5-НТ1-рецепторы центральных нейронов выполняют функции ауторецепторов, контролирующих выделение медиатора из пресинаптических терминалей.
78
5-НТ2-Рецепторы вовлечены в патогенез шизофрении, болезней Паркинсона и Альцгеймера. Агонист 5-НТ2-рецепторов α-метил-5-гидрокситриптамин. Антагонист этих рецепторов кетансерин
H |
|
|
O |
|
|
|
O |
|
HO |
|
|
N |
|
|
NH2 |
||
|
|
N |
|
|
|
|
N |
F |
N |
CH3 |
|
|
|
||||
O |
|
|
|
H |
|
|
Кeтансeрин |
|
α-Мeтил-5-гидрокситриптамин |
||
|
|
|
|||
5-НТ3-Рецепторы контролируют высвобождение дофамина, ГАМК (в меньшей степени) и ацетилхолина. Агонист 5-НТ3-рецепторов – м-хлорфенилбигуанид, антагонист – ондасетрон
H2N |
H |
H |
|
N |
CH3 |
N |
N |
Cl |
N |
||
|
NH |
NH |
|
|
|
|
CH3 |
O |
|
||
|
|
|
|
||
|
м-Хлорфенилбигуанид |
Ондасетрон |
|
||
5-НТ4-Рецепторы ингибируют деятельность калиевых каналов. Принимают участие в развитии алкогольной зависимости.
5-НТ5, 5-НТ6 и 5-НТ7 рецепторы мало изучены. Известно, что активация 5-НТ7 рецепторов приводит к приступам мигрени.
5-НТ1, 5-НТ2 и 5-НТ3 рецепторы гетерогенны и представлены несколькими изоформами [5-НТ1A,B,D,E,F; 5-НТ2A,B,C и 5-НТ3А,B]. Все серотониновые рецепторы, за исключением 5-НТ3, относятся к метаботропным, т.е. передающим импульс внутрь клетки путём модуляции G-белков; 5-НТ3-рецептор относится к классу ионотропных и является лиганд-управляемым К+, Nа+-каналом.
9.2. 5-НТ1А рецепторы.
5-НТ1А-Рецепторы наиболее изучены. Они вовлечены в регуляции состояний тревоги и страха. Механизм передачи нервного импульса, опосредованный данным подтипом серотониновых рецепторов, связан с ингибированием форсколин-зависимой аденилатциклазы, осуществляемым с помощью Gi-белка.
5-НТ1А-Рецептор включает 1 α-субъединицу, содержащую 421 аминокислотный остаток (АКО) у человека и 422 – у крысы.
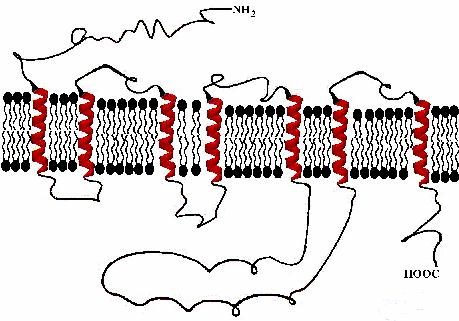
79
Рис. 17. Схема 5-НТ1А-рецептора.
Молекула рецептора 7 раз пронизывает клеточную мембрану. 7 гидрофобных фрагментов, содержащих 21-24 АКО встроены в мембрану и соединены между собой внеили внутриклеточными петлями. Отличительной особенностью трансмембранной топологии 5-НТ1А-рецептора является наличие короткой (16 АКО) внутриклеточной карбокситерминальной области и длинной (131 АКО) третьей внутриклеточной петли, на которой имеются места сопряжения с Gi-белком. Методом точечного мутагенеза было показано, что ответственными за сопряжение с G1-белком являются 2 аминокислоты – Thr-343 и Val-344. Важное значение в распознавании рецептором его лигандов имеют 3 и 4 домены. Принципиальное значение в распознавании имеют аминокислоты Asp 116, Ser 199, Phe 336.
Изменение количества и функционального состояния 5-НТ1АR приводит к нарушениям регуляторной активности серотонинергической системы, её интегральных связей с другими нейромедиаторными системами и возникновению ряда психоневротических расстройств.
В экспериментах на животных, лишенных гена, кодирующего аминокислотную последовательность 5-НТ1АR, получены убедительные доказательства ведущей роли 5-НТ1АR в патогенезе тревожных состояний.
Полным агонистом 5-НТ1АR является 8-гидрокси-2-дипропиламинотетралин (8-ОН- DPAT), частичным агонистом – буспирон, высокоселективный антагонист этих рецепторов – WAY-100635, обратный агонист – спиперон.
80
OH |
|
O |
|
|
|
|
|
N |
|
|
N(C3H7)2 |
|
|
|
|
N |
(CH2)4 N |
N |
|
|
|
|||
|
|
|
|
N |
|
|
O |
Буспирон |
|
|
DPAT |
|
|
N-(CH2)2 N |
N |
 O CH3O
O CH3O
WAY-100635
9.2.1. Гетарил(арил)пиперазины – лиганды 5-НТ1А рецепторов.
Обнаружение анксиолитической активности у частичного агониста 5-НТ1АR – буспирона и внедрение его в медицинскую практику ознаменовало появление нового поколения анксиолитиков – арил(гетарил)пиперазинов и производных других классов соединений, являющихся лигандами 5-НТ1АR. Высоким сродством к этим рецепторам, например, обладают аналоги буспирона – ипсапирон, гепирон, тандоспирон, флезиноксан и многие другие соединения.
|
O |
|
O |
|
|
O |
|
|
|
N |
|
S |
|
N |
H3C |
|
|
|
|||
|
|
|
|
(CH2)4 N |
N |
|
||||
|
|
|
N |
(CH2)4 N |
N |
N |
N |
|||
|
|
|
|
|
N |
H3C |
|
|
|
|
|
|
|
O |
Ипсапирон |
O |
|
Гепирон |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
H |
H |
O |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
(CH2)4 N |
N |
|
|
|
|
|
|
H |
|
|
|
N |
|
|
|
|
|
H |
O |
Тандоспирон |
F |
NH(CH2)3 |
N |
N |
|
O |
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
O |
|
|
O |
ОН |
|
|
|
|
|
|
Флезиноксан |
|
|
||
Буспирон и его аналоги были синтезированы и запатентованы в качестве седативных и нейролептических средств Ву и сотрудниками в конце 60-х годов прошлого столетия. Антидепрессивные свойства препарата были обнаружены лишь в 1980 г. Как выяснилось буспирон и его аналоги по спектру фармакологических свойств весьма существенно отличаются от анксиолитиков 1,4-бенздиазепинового ряда. В частности, для них не
