
- •Глава 2. Физические основы радиохимии
- •2.1 Элементарные частицы
- •2.2 Протонно-нейтронный состав ядер
- •2.3 Свойства атомного ядра
- •2.3.1 Заряд, число нуклонов и масса ядра
- •2.3.2 Размеры ядер
- •2.3.3 Изотопы, изобары, изотоны
- •2.4 Энергия ядра
- •2.4.1 Энергия покоя
- •2.4.2 Энергия связи ядра
- •2.5 Устойчивость ядер
- •2.6 Ядерные силы
- •2.7 Ядерные модели
- •2.7.1 Капельная модель
- •2.7.2 Модель ферми-газа
- •2.7.3 Оболочечная модель
- •Вопросы
- •Глава 3. Радиоактивность
- •3.1 Законы радиоактивного распада
- •3.2 Абсолютная радиоактивность
- •3.3 Период полураспада
- •3.4 Радиоактивное равновесие
- •3.5 Радиоактивные семейства
- •Вопросы
- •Глава 4. Типы ядерных превращений
- •4.1 Альфа - распад
- •4.2 Бета - распад
- •4.3 Гамма - излучение ядер (изомерный переход)
- •4.4 Спонтанное деление
- •4.5 Испускание запаздывающего протона
- •4.6 Испускание запаздывающего нейтрона
- •Вопросы
- •Глава 5. Взаимодействие ядерного излучения с веществом
- •5.1 Взаимодействие альфа – частиц с веществом
- •5.2 Взаимодействие электронов с веществом
- •5.2.1 Ионизационные потери
- •5.2.2 Тормозное излучение (радиационные потери)
- •5.2.3 Излучение вавилова – черенкова
- •5.2.4 Электронно–позитронная аннигиляция
- •5.2.5 Пробеги электронов в веществе
- •5.3 Взаимодействие γамма – квантов с веществом
- •5.3.1 Фотоэффект (фотоэлектрическое поглощение)
- •5.3.2 Комптоновское рассеяние
- •5.3.3 Образование электрон-позитронной пары
- •5.3.4 Когерентное рассеяние
- •5.3.5 Ослабление гамма-излучения в веществе
- •5.4 Взаимодействие нейтронов с веществом
- •Вопросы
2.3.3 Изотопы, изобары, изотоны
Разновидность атомов, ядра которых имеют определенное число нуклонов (протонов и нейтронов), называется нуклидом.
Символическая запись нуклидов включает химический символ ядра Х и индексы слева внизу “Z” ( число протонов в ядре) и “А” слева вверху- полное число нуклонов. Например,
 Х,
Х, H,
H, Ba,
Ba, U,
U, Na
Na
В зависимости от содержания нуклонов нуклиды могут быть объединены в различные группы: изотопы, изобары, изотоны.
Изотопными нуклидами (изотопами) называются нуклиды, имеющие одинаковое число протонов. Они различаются только числом нейтронов. Поэтому все изотопы принадлежат одному и тому же химическому элементу. Так, например, изотопы
 U
,
U
,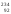 U,
U, U,
U, U,
U, U
U
являются изотопами одного и того же элемента урана (Z= const).
Поскольку
изотопы имеют одинаковое число протонов
и одинаковое строение электронных
оболочек, то они являются атомами
близнецами- их химические свойства
практически совпадают. Исключение
составляют изотопы водорода - протий
 Н,
дейтерий
Н,
дейтерий D,
тритий
D,
тритий Т,
которые из-за слишком большого
относительного различия атомных масс
существенно отличаются по физико-химическим
свойствам (таблица 2.1 ).
Т,
которые из-за слишком большого
относительного различия атомных масс
существенно отличаются по физико-химическим
свойствам (таблица 2.1 ).
Таблица 2.1 Сравнение свойств обычной и тяжелой воды
|
№ п.п. |
Свойства |
Н2О |
D2O |
|
1 |
Температура кипения, 0С |
100 |
101,4 |
|
2 |
Критическая температура, 0С |
374,2 |
371,5 |
|
3 |
Плотность жидкости при 298,15 К, кг/ дм3 |
997 |
1105 |
|
4 |
Диэлектрическая проницаемость при 298,15 К |
78,5 |
78,3 |
|
5 |
Температура максимальной плотности, 0С |
3,96 |
11,6 |
|
6 |
Температура плавления, 0С |
0 |
3,82 |
|
7 |
Плотность льда в точке плавления, кг/ дм3 |
918 |
1015 |
Химические превращения с тяжелым водородом происходят медленнее, чем с его легким изотопом.
Изотонными
нуклидами (изотонами) называют нуклиды
с одинаковым числом нейтронов и разным
числом протонов. Примеры изотонов:
 Са
и
Са
и Тi,
которые относятся к разным нуклидам.
Термин этот употребляется крайне редко.
Тi,
которые относятся к разным нуклидам.
Термин этот употребляется крайне редко.
Изобарами
называют разновидность нуклидов, ядра
которых имеют разное число и протонов
и нейтронов, но имеют одинаковое число
нуклонов. Пример изобаров:
 Тi
и
Тi
и Са.
Са.
Поэтому можно сказать, что нуклиды с одинаковым числом протонов– это разные изотопы одного элемента; нуклиды с одинаковым числом нуклонов– это изобары; нуклиды с одинаковым числом нейтронов – изотоны.
2.4 Энергия ядра
Энергия является одной из важнейших характеристик протекания любых физических процессов. В ядерной физике ее роль особенно велика, поскольку незыблемость закона сохране6ния энергии позволяет делать точные расчеты даже в тех случаях, когда многие детали явлений остаются неизвестными. Применительно к ядру рассмотрим несколько различных форм энергии.
2.4.1 Энергия покоя
В соответствии с теорией относительности массе атома m можно сопоставить полную энергию покоя
Е0=mc2
Если в этой формуле с выражать в метрах на секунду, а m в килограммах, то Е0 получится в джоулях. Обозначим через m0 единицу атомной массы, выраженную в килограммах: m0= 1,66∙10-27 кг. Тогда m= m0Аr и Е0= Аr ·m0 c2 . Величину m0 c2 легко вычислить в джоулях, а затем в электрон-вольтах: m0 c2= 931,5 Мэв. Отсюда
Е0= 931,5Аr. (2.6)
Здесь Аrотносительная атомная масса, Е0полная энергия покоя атома, МэВ.
