
- •3.4.1 Ионная полимеризация
- •3.4.2 Особенности ионной полимеризации по сравнению с радикальной полимеризацией
- •3.4.3 Катионная полимеризация
- •3.4.3.1 Инициаторы (катализаторы) катионной полимеризации
- •Кислоты Льюиса
- •Стабильные и ониевые соли
- •3.4.3.2 Реакция обрыва и передачи цепи в катионной полимеризации
- •3.4.3.3 Кинетика катионной полимеризации
- •3.4.3.4 Влияние природы среды
Кислоты Льюиса
Кислотами Льюиса называют галогениды, алкилгалогениды и некоторые другие производные металлов III – IV групп периодической системы элементов:
AlCl3, Al(C2H5)Cl2, BF3, SnCl4, TiCl4 и др.
Установлено, что эти соединения становятся каталитически активными в присутствии протонсодержащих соединений (H2O, ROH, RCOOH), галоидалкилов ((CH3)3·CCl), эфиров ((C2H5)2O), называемых сокатализаторами. Каталитические комплексы, непосредственно инициирующие полимеризацию, образуются при взаимодействии кислот Льюиса с сокатализаторами.

Таким образом, комплексы кислот Льюиса с сокатализаторами можно рассматривать как сильные кислоты со стабильными координационно-насыщенными анионами (противоионами).
Стабильные и ониевые соли
Стабильные
соли с зарядом на атоме углерода, такие
как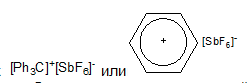
мало
активны и могут вызывать полимеризацию
только наиболее активных в катионной
полимеризации мономеров:
Ониевые соли R3O+X-, R4N+X- являются активными центрами полимеризации гетероциклических мономеров и могут использоваться как инициаторы их полимеризации. Соли арилиодония R2I+X- могут служить инициаторами катионной фотополимеризации, генерируя в процессе фотораспада сильную протонную кислоту:

3.4.3.2 Реакция обрыва и передачи цепи в катионной полимеризации
В радикальной полимеризации имеет место бимолекулярный обрыв, в ионной полимеризации чаще всего происходит мономолекулярный обрыв:

Фактически это реакция передачи цепи на катализатор и на мономер. Если регенерируемый в результате первой реакции каталитический комплекс (BF3·H2O) мало активен, то этот процесс приводит к снижению не только молекулярной массы полимера, но и скорости полимеризации.
Обрыв может происходить из-за взаимодействия карбкатиона с противоионом:

Такие реакции приводят к выделению исходного катализатора (кислоты Льюиса). При наличии в системе сокатализатора каталитический комплекс восстанавливается, и процесс катионной полимеризации продолжается.
Роль сокатализатора могут играть концевые группы полимера. Рост той же цепи возобновиться и реакция может идти по механизму «живых цепей».

Возможна передача цепи на растворитель. Реакции передачи цепи, также как и реакции роста, происходят по механизму электрофильной атаки:

В ряду ароматических растворителей активными в реакциях передачи цепи будут соединения с электронодонорными заместителями (толуол, ксилол) и не активны соединения с электроноакцепторными заместителями (нитробензол).
Для реакций катионной полимеризации, в которых образуются макромолекулы, содержащие гетероатомы в цепях (O, S, N), т. е. при полимеризации кратных связей C=O, C=S и гетероциклов имеет место передача цепи на макромолекулы (передача цепи с разрывом).

При этом происходит химическое «перемешивание» макромолекул, приводящее к изменению как молекулярных масс, так и состава.
3.4.3.3 Кинетика катионной полимеризации
Скорость инициирования зависит от концентрации инициатора:
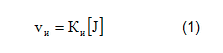
Скорость роста цепи пропорциональна концентрации активного карбкатиона и мономера:

Обрыв цепи описывается уравнением мономолекулярной реакции по отношению к концентрации активных центров:
![]()
Поскольку скорость инициирования и механизм, и скорость обрыва, как правило, не известны, то константы в уравнениях 1 – 3 являются эффективными величинами.
В стационарном режиме полимеризации скорость обрыва можно принять равной скорости инициирования, т. е. v0=vи.
Выражение для скорости полимеризации будет иметь следующий вид:
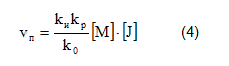
Выражение для степени полимеризации принимает следующий вид
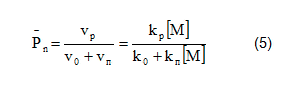
Или, преобразуя, получим:
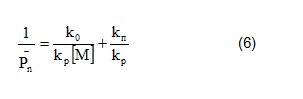
Получаем, что степень полимеризации, в отличие от процесса радикальной полимеризации, не зависит от концентрации инициатора.
Энергия активации зависит от энергий активации стадий процесса:

Е0 в процессе ионной полимеризации значительно выше, чем в процессе радикальной полимеризации, из-за этого энергия активации в целом может иметь отрицательное значение, поэтому для таких реакций может быть характерен отрицательный температурный коэффициент.
