
khimia ответы на тесты по алфавиту
.doc|
К какому классу соединений относится следующее вещество: Cu(OH)2 |
|
*гидроксид |
|
Дать название оксиду по международной номенклатуре: N2O |
|
*оксид азота (I) |
|
Д S=O |
|
* калия гидросульфит KHSO3 |
|
калия гидросульфид |
|
Определить формулу соли натрия тиосульфат (гипосульфит): |
|
*Na2S2O3 |
|
Назвать соль, образующуюся при взаимодействии кальция гидрокарбоната и хлороводородной кислоты: |
|
*кальция хлорид |
|
К какому классу неорганических соединений относится следующее вещество: Cr2O3 |
|
*оксид амфотерный
|
|
Дайте название кислоте: HCN |
|
*циановодородная (синильная) |
|
Дать название соли по ее графической формуле: Na-O-С=O | Na-O-С=О |
|
*натрия оксалат Na2C2O4 |
|
Определить формулу соли – кальция гидрокарбонат: |
|
*Ca(HCO3)2 |
|
Дайте название кислоте: H2SO3 |
|
*сернистая |
|
Дать название соли по ее графической формуле: Cl-Cu-Cl |
|
*меди хлорид |
|
Дайте название кислоте: H2S2O3 |
|
*тиосерная |
|
К какому классу неорганических соединений относится следующее вещество: Na2O2 |
|
*пероксид |
|
Определить формулу соли натрия гидросульфат: |
|
*NaHSO4 |
|
Назвать соль, образующуюся при взаимодействии сульфида железа (II) и серной кислоты: |
|
*железа (II) сульфат |
|
Дайте название кислоте: HSCN-родановодородная |
|
*родановодородная |
|
Определить формулу соли натрия оксалат: |
|
*Na2С 2O4 |
|
Дать название оксиду по международной номенклатуре: NO2 |
|
*оксид азота (IV) |
|
К какому типу солей относится следующее вещество: Cu(OH)Cl |
|
*соль основная |
|
К какому типу солей относится следующее вещество: KHCO3 |
|
*соль кислая |
|
Какая из приведенных кислот образует кислые соли? |
|
*Сернистая H2SO3 |
|
Какая из приведенных кислот является одноосновной? |
|
*Плавиковая HF |
|
Какая из приведенных кислот образует два типа кислых солей? |
|
*Фосфорная |
|
Какая из приведенных кислот не может образовать кислую соль? |
|
*Уксусная слабая |
|
Соли какой кислоты называются ацетаты? |
|
*Уксусной |
|
Какой из реагентов можно использовать для качественного определения ионов Cu2+ |
|
*NH4OH |
|
К какому разделу аналитической химии относятся методы титриметрического анализа: |
|
*Количественный анализ |
|
Аналитические реакции между электролитами записывают: |
|
*слабые электролиты и малодиссоциированные вещества в молекулярном виде |
|
При добавлении к анализируемому раствору раствора нитрата свинца (ΙΙ) образовался черный осадок. Присутствие каких ионов вероятно в растворе? |
|
*S2- черный осадок |
|
Какая реакция является качественной на ионы SO42- |
|
*с ионами Ва2+ белый осадок |
|
Какое количество вещества исследуют в микроанализе: |
|
*0,001-0,01 г |
|
Ионы Рb2+ в растворе можно определить с помощью ионов: |
|
* I- ярко желтый осадок |
|
Чему равны эквивалентные массы H2SO4 и NaOH? |
|
*49 и 40 |
|
Как изменится окраска индикатора фенолфталеина в щелочной среде? |
|
*С бесцветной на малиновую |
|
Что называется стандартизацией? |
|
*Приготовление раствора определённой концентрации |
|
При добавлении разбавленного раствора HCl к анализируемому раствору образовался белый творожистый осадок. О присутствии каких ионов это свидетельствует? |
|
*Серебра |
|
Для определения хлорид-ионов в растворе используют реактив: |
|
*AgNO3 |
|
Какой реактив может быть использован для определения в растворе карбонат-ионов? |
|
*CaCl2 |
|
Какой реактив может быть использован для определения в растворе ионов Fe2+? |
|
*NaOH зеленый осадок |
|
Какую окраску будет иметь индикатор фенолфталеин в кислой среде? |
|
*Бесцветная |
|
Чему равны эквивалентные массы KOH и HCl? |
|
*56 и 36,5 |
|
Какой реактив может быть использован для определения в растворе ионов Fe3+? |
|
*NaSCN |
|
Ионы К+ окрашивают пламя горелки в: |
|
*Фиолетовый цвет |
|
Ионы Na+ окрашивают пламя горелки в: |
|
*Желтый цвет |
|
Какой раствор является рабочим раствором? |
|
*Раствор с точно известной концентрацией |
|
Какой закон используют для расчётов в объёмном анализе? |
|
*Закон эквивалентов |
|
Какие вещества используются в методе нейтрализации в качестве исходных? |
|
*NaOH и HCl |
|
Какой метод количественного анализа используется для определения кислотности желудочного сока: |
|
*Алкалиметрия |
|
Ацидиметрия – это метод определения содержания: |
|
*Оснований в растворах титрованием стандартным раствором кислоты |
|
Алкалиметрия – это метод определения содержания: |
|
*Кислот в растворе титрованием стандартным раствором основания |
|
Объем рабочего раствора, затраченного на реакцию с анализируемым раствором, определяют с помощью: |
|
*бюретки |
|
Если реагирующие вещества и продукты их взаимодействия бесцветны, то для установления точки эквивалентности визуальным методом в раствор анализируемого вещества добавляют: |
|
*индикатор |
|
Момент титрования, в котором окраска раствора резко изменяется, называется: |
|
*конечная точка титрования |
|
Раствор какого вещества используется как титрант (рабочий раствор) в методе алкалиметрия: |
|
*гидроксида натрия |
|
Раствор какого вещества используется как титрант (рабочий раствор) в методе ацидиметрия: |
|
*соляной кислоты |
|
Резкое изменение рН на кривой титрования в методе нейтрализации наблюдается вблизи точки эквивалентности. Этот участок называется: |
|
*скачок титрования |
|
Какой процесс лежит в основе метода кислотно-основного титрования: |
|
*образование молекул воды |
|
Укажите метод анализа к которому относится титрование в соответствии с реакцией 2 KOH + H2SO4 = K2SO4 + 2 H2O |
|
*кислотно-основное титрование |
|
Рабочими растворами в методе нейтрализации являются растворы: |
|
*сильных кислот и оснований |
|
Чему равна эквивалентная масса гидроксида калия? КОН |
|
*56 г/моль |
|
Какой метод не используют при проведении количественного анализа: |
|
*окрашивание пламени |
|
Какой процесс является основой метода кислотно-основного титрования: |
|
*Реакция нейтрализации |
|
Укажите метод анализа к которому относится титрование по реакции: 2 Na2S2O3 + I2 = Na2S4O6 + 2 NaI |
|
*Окислительно-восстановительное (оксидиметрия) |
|
Укажите метод анализа к которому относится титрование по реакции: Н+ + ОН ‾ = Н2O |
|
*Кислотно-основное титрование |
|
Укажите метод титриметрического анализа, в котором титрантом является серная кислота: |
|
*Кислотно-основное титрование |
|
Какие реакции являются основой методов перманганатометрии и йодометрии: |
|
*Реакции окисления-восстановления |
|
Какая из формул относится к первому следствию из закона Гесса: |
|
*Δ Н (реак.) = ∑ΔНобр (кон. в-в.) - ∑ΔНобр ( исх. в-в.) |
|
Какая из формул является математическим выражением закона Гесса: |
|
*ΔН (реак.) = ΔH1 + ΔН2 + ΔН3 |
|
Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔНо298) |
|
|
В экзотермической реакции... |
|
*энтальпия реакционной системы уменьшается ( ΔН < 0 ) |
|
При рассмотрении химической реакции понятие система означает... |
|
*исходные реагенты и продукты реакции |
|
Энтропия системы является мерой её: |
|
*Неупорядоченности |
|
Энтальпия системы является мерой её: |
|
*Теплосодержания |
|
Условно принято, что энтропия идеального кристалла при температуре абсолютного нуля равна: |
|
*0 |
|
Стандартные термодинамические величины характеризуют состояние системы при следующих значениях температуры и давления: |
|
*Т=298оК, p=101,3 кПа |
|
Учет и оценку энергетических превращений, сопровождающих физические и химические процессы, изучает наука: |
|
*Термодинамика |
|
Определите, какое математическое выражение соответствует первому закону термодинамики. |
|
*ΔU = Q - A |
|
Определите, какое математическое выражение соответствует второму закону термодинамики. |
|
*Q = ΔU - A |
|
Раздел химии, изучающий тепловые эффекты химических процессов – термохимия, базируется на законе, согласно которому тепловые эффекты химических реакций, протекающих при постоянном объёме и давлении, зависят от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций. Укажите автора этого закона. |
|
*Гесс |
|
Определите, какому закону соответствует следующая формулировка: “Самопроизвольно процессы всегда идут в направлении от менее вероятного к более вероятному состоянию системы”? |
|
*Первый закон термодинамики |
|
Процессы, протекающие при постоянной температуре, называются: |
|
*Изотермическими |
|
Символом ΔH обозначается одна из функций состояния термодинамической системы. Укажите название этой функции |
|
*Энтальпия ΔH |
|
Символом ΔS обозначается одна из функций состояния термодинамической системы. Укажите название этой функции. |
|
*Энтропия ΔS |
|
Символом ΔU обозначается одна из функций состояния термодинамической системы. Укажите название этой функции |
|
*Внутренняя энергия ΔU |
|
Укажите, каким символом обозначается изобарно-изотермический потенциал, называемый свободной энергией Гиббса? |
|
*ΔG -Гиббс |
|
В эндотермической реакции... |
|
*энтальпия реакционной системы уменьшается ( ΔН < 0 ) |
|
Какое из условий способствует самопроизвольному протеканию реакции: |
|
*Δ S > 0 |
|
Какое из условий способствует самопроизвольному протеканию реакции: |
|
*Δ H < 0 |
|
Какое из условий способствует самопроизвольному протеканию реакции: |
|
*Δ G < 0 |
|
Основным понятием химической кинетики является скорость химической реакции. Укажите, как в общем виде выражается скорость химической реакции при постоянном объёме системы. |
|
*υ = ±ΔC/Δτ |
|
|
|
Указать во сколько раз возрастает скорость химической реакции при повышении температуры на 10оС |
|
*В 2-4 раза |
|
Укажите кинетическое уравнение в общем виде для реакций первого порядка: |
|
*υ = k [A] |
|
Укажите кинетическое уравнение в общем виде для реакций второго порядка: |
|
*υ = k [A] [B] |
|
Укажите кинетическое уравнение в общем виде для реакций третьего порядка: |
|
*υ = k [A]2 [B] |
|
Укажите кинетическое уравнение в общем виде для реакций нулевого порядка: |
|
*υ = k |
|
Кинетическое уравнение реакции υ = k [A] [B]. Укажите во сколько раз уменьшится скорость химической реакции при уменьшении концентрации реагирующих веществ в три раза |
|
*9 |
|
Кинетическое уравнение реакции υ = k [A]2 [B]. Укажите во сколько раз уменьшится скорость химической реакции при уменьшении концентрации реагирующих веществ в два раза |
|
*8 |
|
Порядок реакции по веществу А в кинетическом уравнении υ = k [A]х [B]у равняется. |
|
*х |
|
Порядок реакции по веществу В в кинетическом уравнении υ = k [A]х [B]у равняется. |
|
*у |
|
Общий порядок реакции в кинетическом уравнении υ = k [A]х [B]у равняется. |
|
*х+у |
|
Общий порядок реакции в кинетическом уравнении υ = k [NO]2 [O2] равняется. |
|
*3 |
|
Порядок реакции по NO в кинетическом уравнении υ = k [NO]2 [O2] равняется. |
|
*2 |
|
Порядок реакции по O2 в кинетическом уравнении υ = k [NO]2 [O2] равняется. |
|
*1 |
|
Кинетическое уравнение имеет виде: υ = k. Это соответствует реакции: |
|
*Нулевого порядка |
|
Кинетическое уравнение имеет виде: υ = k[A]. Это соответствует реакции: |
|
*Первого порядка |
|
Кинетическое уравнение имеет виде: υ = k[A][B]. Это соответствует реакции: |
|
*Второго порядка |
|
Катализатор увеличивает скорость химической реакции, потому что: |
|
*Увеличивает энергию активации |
|
Единицами измерения скорости химической реакции являются: |
|
*моль / л · сек |
|
Указать кинетическое уравнение реакции, в котором общий порядок реакции и порядок реакции по данному реагенту одинаковы: |
|
*υ = k [A] |
|
В системе CO2(г) + С(т) ↔ 2CO(г) равновесие установилось при ΔH = +110.5кДж/моль. В какую сторону сместится равновесие при понижении температуры? |
|
*Влево |
|
В какую сторону сместится химическое равновесие в системе 4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(ж) при повышении давления? |
|
*Влево |
|
В системе 2CO2(г) ↔ 2CO(г) + O2(г) равновесие установилось при ΔH = +567,8кДж/моль. В какую сторону сместится равновесие при понижении температуры? |
|
*Влево |
|
В системе H2 + Cl2 ↔ 2HCl равновесие установилось при ΔH = -91,8кДж/моль. В какую сторону сместится равновесие при понижении температуры? |
|
*Влево |
|
В какую сторону сместится химическое равновесие в системе 2SO2(г) + O2(г) ↔ 2SO3(г) при понижении давления? |
|
*Вправо |
|
В какую сторону сместится химическое равновесие в системе Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г) при повышении давления? |
|
*Влево |
|
В какую сторону сместится химическое равновесие в системе при понижении давления CH4(г) + 2H2O(г) = CO2(г) + 4H2(г) |
|
*Вправо |
|
В системе H2 + I2 = 2HI равновесие установилось при H = -51.8кДж. В какую сторону сместится равновесие при повышении температуры? |
|
*Влево |
|
В системе 2SO2(г) + O2(г) ↔ 2SO3(г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования SO2. |
|
*Понижением температуры |
|
В системе СаСО3 (тв) ↔ СаО (тв) + СO2 (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СаО. |
|
*Повышением температуры |
|
В системе СO2 (г) + С (тв) ↔ СO (г) + Н2 (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СО. |
|
*Увеличением концентрации СО2 |
|
В системе 2 HI (г) ↔ I2 (г) + Н2 (г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования HI. |
|
*Понижением температуры |
|
При каком значении Кр обратимые реакции проходят с наиболее полным превращением исходных веществ в продукты |
|
*Кр > 1 |
|
В системе Fe3O4 + 4 H2 (г) ↔ 3 Fe (тв) + 4 Н2О (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования Fe. |
|
*Повышением температуры |
|
В системе 2SO2(г) + O2(г) ↔ 2SO3(г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования SO3. |
|
*Понижением температуры |
|
В системе NH4Cl (тв) ↔ NH3 ( г) + HCl (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования NH4Cl. |
|
*Понижением давления |
|
В системе NH4Cl (тв) ↔ NH3 ( г) + HCl (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования NH3. |
|
*Повышением температуры |
|
Какая из записей константы химического равновесия будет верной для реакции: СО (г) + 2 Н2 (г) ↔ СН3ОН (г) |
|
|
|
К растворимости какого газа в воде нельзя применить закон Генри: |
|
*NН3 |
|
Среди перечисленных ниже твердых веществ в воде хорошо растворим: |
|
*силикат натрия |
|
К растворимости какого газа в воде применим закон Генри: |
|
*CH4 |
|
Химическая (сольватная) теория растворов веществ предложена более 100 лет назад |
|
*Вант-Гоффом |
|
В какой из жидкостей растворимость газа будет наибольшей: |
|
*в воде |
|
Растворимость малорастворимых веществ (типа AgCl или BaSO4) характеризуют с помощью специальной константы, которая называется: |
|
*Произведением растворимости |
|
Между молекулами воды образуются следующие типы химических связей: |
|
*Ковалентные полярные |
|
Растворимость газов в воде при повышении температуры |
|
*Уменьшается |
|
Влияние электролитов на растворимость газов описывается законом: |
|
*Сеченова |
|
Масса вещества, которая способна раствориться при данной to в 100 г воды, называется |
|
*Растворимостью |
|
Концентрация кислорода в растворе будет наибольшей при: |
|
*5оС |
|
Растворимость кислорода при одинаковой to и парциальном давлении наибольшая в: |
|
*Дистиллированной воде |
|
Как будет изменяться растворимость газов с повышением температуры: |
|
*Уменьшается |
|
Между атомами в молекуле воды образуются следующие типы химических связей: |
|
*Ковалентные неполярные |
|
Растворимость твердых веществ в воде при повышении температуры (в основном): |
|
*Увеличивается |
|
При комнатной температуре ограничено растворимы: |
|
*Вода и фенол |
|
Среди перечисленных ниже твердых веществ в воде хорошо растворим |
|
*Хлорид бария |
|
Формулировка «раствор с массовой долей вещества 10%» обозначает: |
|
*В 90 г раствора растворено 10 г вещества |
|
К сильным электролитам относится: |
|
*сульфит калия |
|
Процесс электролитической диссоциации это: |
|
*распад электролита на ионы при действии воды |
|
Процесс электролитической диссоциации нитрата бария описывается уравнением: |
|
*Ba(NO3)2 ↔ Ba2+ + 2 NO3¯ |
|
Молекулы каких веществ при диссоциации по первой ступени образуют катионы с зарядом 2+ |
|
*нитрат магния |
|
С точки зрения теории кислот и оснований Бренстеда-Лоури, кислоты – это вещества, которые: |
|
*Отдают протон H+ |
|
С точки зрения теории кислот и оснований Брендстеда-Лоури, основания – это вещества, которые: |
|
*Присоединяют протон H+ |
|
Из предложенных электролитов выбрать сильный: |
|
*CaCl2 |
|
Из предложенных веществ выбрать неэлектролит: |
|
*CO |
|
Из предложенных электролитов выбрать сильный: |
|
*NaCl |
|
HF |
|
Электролитическая диссоциация – это распад на ионы под действием молекул растворителя (Н2О) веществ, которые имеют тип связи, свойственный соединениям: |
|
*NaОН, HCl |
|
Количественной характеристикой силы электролита является: |
|
*Ионная сила раствора электролита |
|
Константа диссоциации слабого электролита – это отношение к равновесной молярной концентрации молекул электролита, которые не распались на ионы: |
|
*Произведения равновесных молярных концентраций ионов электролита |
|
По силе электролитической диссоциации чистая (дистиллированная) вода относится к: |
|
*Слабым электролитам |
|
Константа диссоциации воды (моль/л) при температуре 25оС равна: |
|
*1,8·10-16 |
|
Ионному произведению воды соответствует: |
|
*Кводы = [H+] · [OH-] |
|
С точки зрения теории кислот и оснований Аррениуса, кислоты – это вещества, которые: |
|
*Отдают протон H+ |
|
С точки зрения теории кислот и оснований Аррениуса, основания – это вещества, которые: |
|
*Отдают ОН- |
|
Процесс электролитической диссоциации нитрита бария описывается уравнением: |
|
*Ba(NO2)2 ↔ Ba2+ + 2 NO2- |
|
Гидроксид аммония относится к: |
|
*Слабым электролитам |
|
Укажите, какая из приведенных кислот является слабым электролитом? |
|
*HF |
|
Кислые соли являются сильными электролитами: |
|
*Только по первой ступени |
|
Вода плохо проводит электрический ток. Добавление какого вещества к воде увеличивает ее электропроводность: |
|
*Хлорид калия |
|
Укажите заряд аниона, который образуется при диссоциации сульфида натрия: |
|
* - 2 |
|
Укажите заряд аниона, который образуется при диссоциации Al(NO3)3: |
|
*- 1 |
|
Одинаковое ли осмотическое давление будут иметь растворы сахарозы, калия хлорида, натрия сульфата одинаковой молярной концентрации при одинаковой температуре? |
|
*Различное |
|
Для уничтожения бактерий, вызывающих ботулизм, в качестве консерванта используется раствор с высоким содержанием сахара. С чем это связано? |
|
*С явлением плазмолиза. |
|
Какие электролиты будут иметь одинаковое осмотическое давление при одинаковой температуре и молярной концентрации. |
|
*NaCl и KCl |
|
Какое из следующих свойств относится к коллигативным? |
|
*Температура кипения раствора по сравнению с чистым растворителем. |
|
Плазмолиз живой клетки происходит, если поместить её в: |
|
*10 % раствор NaCl |
|
Одинаковое ли осмотическое давление будут иметь растворы натрия хлорида, кальция хлорида, фруктозы при одной и той же температуре и одинаковой молярной концентрации? |
|
*Различное |
|
Для какого из растворов NaCl осмотическое давление будет наибольшим: |
|
*С(NaCl) = 0,0001 моль/л |
|
Для какого из растворов изотонический коэффициент будет наибольшим: |
|
*С(NaCl) = 0,1 моль/л |
|
Для какого из электролитов изотонический коэффициент будет наибольшим: |
|
*С(K2SO4) = 0,01 моль/л |
|
Для какого из водных растворов температура замерзания будет наименьшей: |
|
*Сm (MgSO4) = 0,01 моль/кг |
|
Для какого из водных растворов температура замерзания будет наибольшей: |
|
*Сm (глюкозы) = 0,1 моль/кг |
|
Для какого из водных растворов температура замерзания будет наименьшей: |
|
*Сm (LiNO3) = 0,1 моль/кг |
|
Какой из растворов хлорида натрия будет гипотоническим по отношению к крови: |
|
*ω (NaCl) = 0,00009 |
|
Какой из растворов хлорида натрия будет гипертоническим по отношению к крови: |
|
*ω (NaCl) = 0,09 |
|
Какой из растворов при to 37oC имеет меньшее осмотическое давление: |
|
*С (глюкозы) = 0,1 моль/л |
|
Какое осмотическое давление должны иметь растворы, которые используются в медицинской практике как изотонические растворы или кровезаменители: |
|
*740-800 кПа |
|
Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида кальция, если это вещество полностью продиссоциировало в водном растворе: |
|
*i = 3 |
|
Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида калия, если это вещество полностью продиссоциировало в водном растворе: |
|
*i = 2 |
|
Осмотическое давление раствора можно рассчитать используя: |
|
*Закон Вант-Гоффа |
|
Изменение температуры кипения раствора можно рассчитать пользуясь: |
|
*2-м законом Рауля |
|
Чему будет равняться изотонический коэффициент Вант-Гоффа для сульфида калия, если это вещество полностью продиссоциировало в водном растворе: |
|
*i = 3 |
|
Какая среда раствора при рН = 5 |
|
*кислая |
|
В каком пределе лежит значение [H+] в кислой среде? |
|
*[H+] > 10-7 кислая щелочная |
|
Водородный показатель 0.001 М раствора соляной кислоты равен (=1): |
|
*3 |
|
Какая среда раствора при рН = 2? |
|
*сильно кислая |
|
В каком пределе лежит значение [ H+] в нейтральной среде? |
|
*[ H+] = 10-7 |
|
Для коррекции кислотно-щелочного равновесия при ацидозе рекомендован раствор: |
|
*NaOH |
|
Смещение кислотно-щелочного равновесия крови в сторону снижения pH называют: |
|
*Ацидозом |
|
Смещение кислотно-щелочного равновесия крови в сторону повышения pH называют: |
|
*Алкалозом |
|
Водородный показатель плазмы крови в норме может колебаться в пределах: |
|
*7.36 - 7.4 |
|
Водородный показатель желудочного сока в норме может колебаться в пределах: |
|
*0.9 - 1.5 |
|
Чему равно значение pH раствора соляной кислоты С = 0.01 моль/л, α = 1? |
|
*2 |
|
Чему равно значение pH раствора гидроксида натрия С = 0. 1 моль/л, α = 1? |
|
*1 |
|
Водородный показатель рН равняется: |
|
*- lg [H+] |
|
Гидроксильный показатель рОН равняется: |
|
*- lg [OH-] |
|
В каком пределе лежит значение [ H+] в щелочной среде? |
|
*[ H+] < 10-7 щелоч 7- 10 |
|
Чему равно значение рН при значении [ H+] = 10-9 |
|
*9 |
|
Константа диссоциации воды Кд(Н2О) при температуре 25оС равняется: |
|
*1,8·10-16 |
|
Молярная концентрация ионов [H+] желудочного сока равняется 10-2 моль/л. Чему равняется рОН. |
|
*12 |
|
Физиологическое значение рН мочи: |
|
*5 - 8 |
|
Молярная концентрация гидроксид ионов желудочного сока равняется 10-12 моль/л. Чему равняется рН: |
|
*2 |
|
На значение рН в растворе оказывают влияние ионы: |
|
*OH‾ |
|
Молярная концентрация ионов водорода артериальной крови равняется 4,0·10-8 моль/л. Чему равняется рН: |
|
*7,4 |
|
Молярная концентрация ионов водорода венозной крови равняется 2,3·10-7 моль/л. Чему равняется рН: |
|
*6,6 |
|
Ацидоз – это отклонение рН крови до: |
|
*7,1 |
|
Алкалоз – это отклонение рН крови до: |
|
*7,7 |
|
рН слюны человека равняется 6. Чему равна молярная концентрация ионов [H+] : |
|
*1·10-6 |
|
рН секрета поджелудочной железы человека равняется 8. Чему равна молярная концентрация ионов [H+] : |
|
*1·10-8 |
|
Какая из следующих солей подвергается гидролизу: |
|
*ZnSO4 |
|
По какому из ионов протекает гидролиз KCH3COO? |
|
*по аниону |
|
Какова реакция среды в растворе KCH3COO? |
|
*щелочная |
|
Какая из солей гидролизуется в большей степени? K HCN = 7·10-10 K H2SO3 = 6·10-8 K HF = 1·10-4 |
|
*NaF |
|
Какая из следующих солей подвергается гидролизу: |
|
*CrCl3 |
|
По какому из ионов протекает гидролиз соли CrCl3. |
|
*по аниону |
|
Какова реакция среды в растворе соли NaBr? |
|
*нейтральная |
|
Какая из солей гидролизуется в большей степени? KH2S = 5·10-8 KH3AsO3 = 6·10-10 KH3PO4 = 1·10-2 |
|
*K3PO4 |
|
Какая из приведённых солей подвергается гидролизу и обуславливает кислую реакцию среды: |
|
*NH4Cl |
|
Какая из следующих солей подвергается гидролизу: |
|
*NaBr |
|
По какому из ионов протекает гидролиз (NH4)2SO4? |
|
*по катиону |
|
Какая из солей гидролизуется в меньшей степени? KH2SO3 = 2·10-2 KNH4OH = 5·10-8 KH3AsO3 = 6·10-10 |
|
*K3AsO3 |
|
Гидролиз соли – это реакция взаимодействия соли с водой, в результате которой: |
|
*Образуется слабый электролит и, как правило, изменяется кислотность среды |
|
Гидролиз солей относится к реакциям: |
|
*Обмена |
|
Какое значение рН имеет раствор при гидролизе соли, образованной слабой кислотой и сильным основанием: |
|
*рН > 7 |
|
Какое значение рН имеет раствор при гидролизе соли, образованной сильной кислотой и слабым основанием: |
|
*рН < 7 |
|
Из предлагаемых веществ выбрать возможные компоненты для приготовления буферных растворов: |
|
*NaHCO3, CO2·H2O, CH3COOH, CH3COONa |
|
Значение рН большей части внутриклеточных жидкостей находится в интервале от: |
|
*6,8 – 7,8 |
|
Нормальное значение рН плазмы крови составляет: |
|
*7,4 |
|
Компонентами кислотного буферного раствора являются: |
|
*Слабая кислота и соль этой кислоты и слабого основания |
|
Компонентами основного буферного раствора являются: |
|
*Слабое основание и соль этого основания и слабой кислоты |
|
рН кислотного буферного раствора можно рассчитать по формуле: |
|
|
|
рН основного буферного раствора можно рассчитать по формуле: |
|
* |
|
|
|
Основными величинами, которые влияют на величину рН буферного раствора являются: |
|
*рК слабого электролита |
|
Из приведенных пар веществ выберите компоненты ацетатного буферного раствора |
|
*CH3COONa, CH3COOH |
|
Из приведенных пар веществ выберите компоненты гидрокарбонатного буферного раствора: |
|
*CO2·H2O, NaHCO3 |
|
Буферные растворы – это растворы, которые способны: |
|
*Поддерживать значение рН при добавлении небольших количеств сильных кислот или щелочей |
|
Буферные системы могут быть представлены следующим образом: |
|
*Слабое основание и его катион |
|
В состав буферных систем крови не входят: |
|
*аммиачный |
|
Во внутренней среде эритроцитов в норме поддерживается постоянное рН, равное: |
|
*7,25 |
|
Определите окислитель в данной реакции: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl |
|
*H2S |
|
Методом йодометрии можно количественно определить: |
|
*концентрацию окислителей и восстановителей |
|
Для определения хлора в питьевой воде пользуются методом: |
|
*Йодометрии |
|
Какая реакция лежит в основе метода йодометрии: |
|
*2I- - 2e = I2 |
|
К какому типу реакций относится представленная схема: KClO3 → KCl + O2 |
|
*Окислительно-восстановительная |
|
Какой процесс происходит по схеме S+6 → S+4 и сколько электронов принимает в нем участие? |
|
*Восстановление, + 2е |
|
Какой из приведенных процессов является полуреакцией окисления: |
|
*Cl- → Cl2 |
|
Какой из приведенных процессов является полуреакцией восстановления: |
|
*N2 → NН4+ |
|
Сколько электронов принимает атом азота в полуреакции NO2- → NO |
|
*2 |
|
В медицинской практике используют раствор перманганата калия в качестве антисептического средства. Какую степень окисления имеет марганец в перманганате калия. |
|
*+7 |
|
В медицинской практике используют раствор соединения, в котором степень окисления кислорода равна –1. Определите это соединение. |
|
*H2O2 |
|
В каком превращении степень окисления серы увеличивается: |
|
*SO2 → SO3 |
|
В каком превращении степень окисления серы уменьшается: |
|
*S → H2S |
|
Какую степень окисления имеет фосфор в фосфате кальция CaPO4: |
|
* +5 |
|
Восстановителями являются атомы или ионы в таких степенях окисления, в которых они способны: |
|
*Отдавать электроны |
|
Окислителями являются атомы или ионы в таких степенях окисления, в которых они способны: |
|
*Присоединять электроны |
|
Какой процесс осуществляется в ходе превращения H2S → H2SO4 |
|
*Окисление, - 8 ē |
|
Какой из приведенных металлов является более сильным восстановителем: |
|
*Zn |
|
В электрохимическом ряду напряжений металлы расположены по возрастанию: |
|
*Стандартных электродных потенциалов |
|
Как называется биопотенциал, который возникает на границе между двумя растворами, разделёнными полупроницаемой мембраной? |
|
*Мембранным |
|
В качестве стандартного электрода для измерения электродных потенциалов используют электрод: |
|
*Водородный |
|
На аноде гальванического элемента происходит процесс: |
|
*Окисления |
|
Каков критерий самопроизвольного процесса для окислительно-восстановительной реакции? |
|
*э.д.с.> 0, ∆G < 0 |
|
Почему в стоматологической практике не рекомендуется использовать металлы и сплавы с разной электрохимической активностью? |
|
*Создаётся гальваническая система и возникает э.д.с. |
|
Какой процесс происходит на катоде гальванического элемента? |
|
*Восстановление |
|
*Превращения химической энергии в электрическую |
|
В каком направлении движутся электроны во внешней системе гальванического элемента Cd|Cd2+||Cu2+|Cu? |
|
*От кадмиевого электрода к медному |
|
В основе работы цинк-никелевого гальванического элемента лежит реакция: |
|
*Ni2+ + Zn ↔ Ni + Zn2+ |
|
Что такое гальванический элемент? |
|
*Устройства для превращения химической энергии в электрическую |
|
Количественной характеристикой способности различных систем присоединять или отдавать электроны в растворах являются: |
|
*Величина окислительно-восстановительного потенциала |
|
Редокс – потенциал – это потенциал: |
|
*окислительно-восстановительный |
|
Каким показателем определяется направленность окислительно-восстановительных процессов? |
|
*величиной э.д.с окислительно-восстановительной реакции |
|
Как будет заряжен цинковый электрод при опускании цинковой пластинки в раствор ZnSO4 |
|
*«–» |
|
По какому уравнению рассчитывается мембранный потенциал |
|
*e = RT/nF х lnС1/С2 |
|
Чему равняется n в уравнении Нернста для медного электрода |
|
*2 |
|
Какова концентрация ионов Сu2+ в растворе, если потенциал медного электрода равняется его стандартному значению |
|
*1 моль/л |
|
В результате работы цинк-медного гальванического элемента масса цинкового электрода: |
|
*Уменьшается |
|
В результате работы цинк-медного гальванического элемента масса медного электрода: |
|
*Увеличивается |
|
Выберите из предложенных элементов те, которые относятся к макроэлементам: |
|
*Na, K, Ca, Mg |
|
Какой элемент в виде нерастворимого фосфата содержится в твердых тканях зуба: |
|
*Мg3(РО4)2 |
|
В медицинской практике NH4Cl используют в качестве мочегонного средства. Какую степень окисления проявляет азот в соединении NH4Cl: |
|
*–3 |
|
Недостаток ионов Са в организме при нарушении кальциевого обмена в организме человека приводит к развитию: |
|
*Рахита |
|
Вещество, применяемое в медицине при повышенной кислотности желудка: |
|
* |
|
Общее содержание азота в организме человека составляет: |
|
*10% |
|
|
|
Обмен этого элемента тесно связан с обменом кальция. Суточная потребность в нём 1,3 г. Он является основой скелета человека и животных, зубов. |
|
*P |
|
Основным внеклеточным ионом является: |
|
*Na+ |
|
Суточная потребность организма в натрии составляет: |
|
*4 – 7 г |
|
Центральный ион – комплексообразователь молекулы хлорофилла: |
|
*Mg2+ |
|
Присутствие избытка газообразного азота в крови может быть причиной болезни: |
|
*Кессонная болезнь |
|
Процентное содержание воды в организме взрослого человека (в среднем): |
|
*65% |
|
Суточная потребность организма в фосфоре: |
|
*1,3 г |
|
Оксид элемента, входящего в состав постоянных пломбировочных материалов: |
|
*CaO |
|
Отравление угарным газом объясняют: |
|
*Высоким сродством оксида углерода (II) к Fe2+ |
|
Оксид азота N2O в смеси с кислородом используют для наркоза. Какова степень окисления азота в соединении?: |
|
*+1 |
|
Суточная потребность организма в калии: |
|
*2 – 3 г |
|
Содержание этого элемента в организме человека – 21,15%. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов: |
|
*C |
|
Концентрация этого элемента в организме человека около 10%, в земной коре – 1%. Он является связующим элементом между цепями ДНК и участвует в формировании вторичной структуры белков: |
|
S |
|
Основным внутриклеточным ионом является ион: |
|
*K+ |
|
Выберите из предложенных элементов те, которые относятся к органогенам: |
|
*N, H, S, P, C, O |
|
Элемент, входящий в состав белков, аминокислот, витаминов. Содержится в каротине волос, костях, нервной ткани: |
|
*Р |
|
Суточная потребность организма человека в кальции: |
|
*1 г |
|
Раствор этого вещества применяют при обезвоживании в виде инъекций подкожно и внутривенно: |
|
*NaCl (0,9%) |
|
Выберите из предложенных элементов, те, которые относятся к микроэлементам: |
|
*Br, I, Cu, Co, Fe |
|
Комплекс с ионом, какого элемента является основой молекулы витамина B12? |
|
*Co2+ |
|
Для омертвления (некротизации) мягких тканей зуба, в стоматологии используют препарат: |
|
*As2O3 |
|
Комплекс с ионом, какого элемента является основой молекулы гемоглобина? |
|
*Fe2+ |
|
Заболевание “Эндемический зоб” наблюдается при недостатке в организме иона: |
|
*J- |
|
Соединение, применяемое в стоматологии, как средство против кариеса зубов: |
|
*NaF |
|
Недостаток иона железа (II) в организме приводит к развитию: |
|
*Анемии |
|
При пониженной кислотности желудочного сока, в медицинской практике используют: |
|
*HCl |
|
Труднорастворимые фосфаты, входящие в состав пломбировочных материалов, применяемых в стоматологии: |
|
*Са3(PO4)2 |
|
При выраженном дефиците иона этого элемента наблюдается понижение воспроизводительной способности; оказывает специфическое влияние на процессы размножения. Это ион: |
|
*Zn2+ |
|
Недостаток фтора в организме приводит к заболеванию: |
|
*Кариес зубов |
|
Ион какого элемента, участвует в биосинтезе половых гормонов (тестостерона) и регулирует функцию половых желез? |
|
*Br- |
|
К микроэлементам относятся элементы, содержание которых в организме равно: |
|
*10-3 – 10-12 % |
|
Содержание фтора в зубной эмали: |
|
*0,01% |
|
Соединение, применяемое в стоматологии для лечения воспалительных процессов слизистых оболочек: |
|
*ZnCl2 |
|
Какая формула соответствует комплексному соединению – дихлородиамминплатина(II): |
|
*[Pt(NH3)2Cl2] |
|
Чему равна степень окисления центрального атома в комплексном соединении Na2[Со(СN)4]? |
|
*+2 |
|
Назовите комплексное соединение – Na[Ag(СN)2] |
|
*Дицианоаргенат (II) натрия |
|
Используя значения константы нестойкости, определите какой из комплекcных ионов более устойчив: |
|
*[PbI4]2- |
|
Какое название соответствует комплексному соединению K3[Fe(CN)6]? |
|
*Гексацианоферрат (III) калия |
|
Чему равен заряд комплексного иона в комплексном соединении K2[Cu(CN)4]? |
|
*+2 |
|
Назовите комплексное соединение – K2[PtCl4] |
|
*Тетрахлороплатинат (II) калия |
|
Используя значения константы нестойкости, определите какой из комплекcных ионов более устойчив: |
|
*[HgCl4]2- |
|
Какая формула соответствует комплексному соединению – аквапентацианоферрат (II) калия: |
|
K2[Fe(CN)4(H2O)2] |
|
Какая формула соответствует комплексному соединению – гексанитрокобальтат (III) калия: |
|
*K3[Co(NO2)6] |
|
Лигандами в комплексном соединении [Cr(H2O)4Br2]Cl являются: |
|
*H2O, Br |
|
Назовите комплексное соединение – Na2[Cu(SCN)4]: |
|
*Тетрароданокупрат (II) натрия |
|
Используя значения константы нестойкости, определите какой из комплекcных ионов более устойчив: |
|
*[Co(NH3)6]2+ |
|
Какая формула соответствует комплексному соединению – хлоропентаамминкобальта (III ) гидроксид: |
|
*[Co(NH3)5Cl](OH)2 |
|
Какое из комплексных соединений является анионным? |
|
*[Cr(H2O)4Br2]Cl |
|
Назовите комплексное соединение – [Cu(NH3)4]Cl2: |
|
*Хлорид тетраамминмеди (II) |
|
Используя значения константы нестойкости, определите какой из комплекcных ионов более устойчив: |
|
*[Cd(NH3)4]2+ |
|
Какая формула соответствует комплексному соединению – гексацианоферрат (II) калия: |
|
*K4[Fe(CN)6] |
|
Чему равно координационное число центрального атома в комплексном соединении [Pt(NH3)2Cl4]? |
|
*6 |
|
Назовите комплексное соединение – [Cr(H2O)4Br2]Cl |
|
*Хлорид дибромотетрааквахрома (II) |
|
Какое название соответствует комплексному соединению [Co(NH3)4Cl2]Cl? |
|
*Хлорид дихлоротетраамминкобальта (III) |
|
Какое из комплексных соединений является катионным? |
|
*Na3[Cr(OH)6] |
|
Назовите комплексное соединение – [Co(NH3)5Cl](NO2)2 |
|
*Нитрит хлоропентаамминкобальта (Ш) |
|
Какое название соответствует комплексному соединению K4[Fe(CN)6]? |
|
*Гексацианоферрат (II) калия |
|
Чему равно координационное число центрального атома в комплексном соединении [Co(NH3)5Cl](NO2)2? |
|
*6 |
|
Используя значения константы нестойкости, определите какой из комплекcных ионов более устойчив: |
|
*([Ag(CN)2]- |
|
Поверхностно-активные вещества: |
|
*Понижают поверхностное натяжение жидкости |
|
Какой поглотитель наиболее эффективен при осушении воздуха? |
|
*Силикагель |
|
Выберите математическое выражение для изотермы Лэнгмюра: |
|
* |
|
|
|
В методе тонкослойной хроматографии хроматографирование веществ происходит в тонком слое сорбента, нанесенного на твердую плоскую подложку. В качестве сорбента используют… |
|
*Оксид алюминия |
|
Какой процесс сопровождается адсорбцией из смеси газов? |
|
*Кондиционирование воздуха |
|
Поверхностное натяжение может быть выражено математически как: |
|
* |
|
Какой из ионов обладает лучшей адсорбционной способностью? |
|
*Pb2+ |
|
Пропускание подвижной фазы через колонку с сорбентом и нанесенной на него анализируемой смесью, называется: |
|
*Элюированием |
|
Поверхностная активность с удлинением углеводородного радикала на группу – СН2: |
|
*Повышается в 2 – 3,5 раза |
|
На какие ионы обмениваются ионы анионита? |
|
*Ca2+ |
|
В каких целях используют метод гемосорбции? |
|
*Очистка крови от токсинов |
|
Хроматография основана на процессах: |
|
*Сорбции |
|
Вещество, жидкое или твердое, которое в гетерогенной системе является поглотителем, называется: |
|
*Адсорбент |
|
Природа поверхностно-активных молекул: |
|
*Дифильная |
|
Укажите спирт с наибольшей поверхностной активностью: |
|
*C6H13OH |
|
В колоночной хроматографии применяют гидрофильные адсорбенты, которыми являются:
|
|
*Целлюлоза, силикагель |
|
Выберите формулу, соответствующую уравнению Гиббса: |
|
* |
|
|
|
Какой из ионов обладает лучшей адсорбционной способностью? |
|
*I- |
|
Укажите кислоту с наименьшей поверхностной активностью: |
|
*C2H5СОOH |
|
Выберите нужные сорбенты для очистки крови от токсинов: |
|
*Активированный уголь |
|
*Электродиализ |
|
Определить агрегатное состояние дисперсной фазы и дисперсионной среды молока: |
|
*Ж / Ж |
|
Пептизация это: |
|
*Конденсационный метод получения коллоидных растворов |
|
Гемодиализ - это: |
|
*Очистка крови от продуктов метаболизма |
|
Размер коллоидных частиц: |
|
*10-9 - 10-7 м |
|
Золь Fe(OH)3 приготовлен добавлением 1% раствора FeCl3 к кипящей воде. Какой метод был использован? |
|
*химическая конденсация |
|
Электородиализ может быть использован для очистки коллоидных растворов от: |
|
*Электролитов |
|
Добавление раствора FeCl3 к осадку Fe(OH)3 приводит к образованию коллоидного раствора Fe(OH)3. Какой метод был использован? |
|
*Химическая конденсация |
|
Укажите тип коллоидного раствора золота: |
|
*Гидрофобный |
|
Диализ может быть использован для очистки коллоидных растворов от примесей: |
|
*Низкомолекулярных веществ (электролитов) |
|
Определить агрегатное состояние дисперсной фазы и дисперсионной среды дыма: |
|
*Т / Г |
|
Указать наиболее эффективный метод очистки коллоидного раствора белка от примеси (NH4)2SO4: |
|
*Электродиализ; |
|
Указать наиболее эффективный метод очистки коллоидного раствора крахмала от примеси глюкозы. |
|
*Диализ |
|
Определить агрегатное состояние дисперсной фазы и дисперсионной среды тумана: |
|
*Ж / Г |
|
Золь серы получен смешиванием 5 мл спиртового раствора серы с 20 мл воды. Какой метод был использован? |
|
*физическая конденсация |
|
Какая из предложенных реакций может быть использована для приготовления коллоидного раствора: |
|
*NH4Cl + H2O |
|
Определить агрегатное состояние дисперсной фазы и дисперсионной среды пены: |
|
*Г / Ж |
|
Согласно правила Панетта-Фаянса, на поверхности кристаллического твердого адсорбента из раствора адсорбируется тот ион, который: |
|
*входит в состав кристаллической решетки адсорбента |
|
Указать ион, формирующий потенциалопределяющий слой мицеллы гидрофобного золя: CuCl2 + K2S (избыток) → |
|
*S2- |
|
Указать ион, формирующий диффузный слой мицеллы гидрофобного золя: AgNO3 (избыток) + KCl → |
|
*NO3- |
|
Указать ядро мицеллы гидрофобного золя: CaCl2(избыток) + Na2CO3 → |
|
*[(CaCO3)m, nCa2+] |
|
Указать ион, формирующий слой противоионов мицеллы гидрофобного золя. BaCl2 + Na2SO4 (избыток)→ |
|
*Na+ |
|
*Ca2+ |

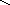 ать
название соли по ее графической
формуле: K-O
ать
название соли по ее графической
формуле: K-O H-O
H-O