
- •Группа веществ, изолируемых минерализацией («металлические» яды)
- •Оглавление Введение
- •1. Изолирование соединений, содержащих «металлические» яды из биологического материала
- •1.1. Разрушение биологического материала азотной и серной кислотами
- •1.2. Разрушение биологического материала хлорной, азотной и серной кислотами
- •1.3. Разрушение биологического материала пергидролем и серной кислотой
- •1.4. Разрушение биологического материала методом сухого озоления
- •1. Дробный метод анализа минерализата
- •III. Изменение степени окисления ионов
- •V. Удаление катионов в виде осадка
- •2.1. Исследование осадка
- •Соединения Свинца Токсикологическое значение соединений свинца
- •Исследование минерализата на наличие ионов свинца. Малые количества осадка свинца сульфата (менее 2 мг)
- •Большие количества осадка свинца сульфата (свыше 2 мг)
- •2.1.2. Соединения бария Токсикологическое значение соединений бария
- •Исследование минерализата на наличие ионов бария
- •2.2. Исследование фильтрата
- •2.2.1. Соединения марганца Токсикологическое значение соединений марганца
- •Исследование минерализата на наличие ионов марганца
- •2.2.2. Соединения хрома Токсикологическое значение соединений хрома
- •Исследование минерализата на наличие ионов хрома
- •2.2.3. Соединения серебра Токсикологическое значение соединений серебра
- •Исследование минерализата на наличие ионов серебра
- •2.2.4. Соединения меди Токсикологическое значение соединений меди
- •Исследование минерализата на наличие ионов меди
- •2.2.5. Соединения сурьмы Токсикологическое значение соединений сурьмы
- •Исследование минерализата на наличие ионов сурьмы
- •2.2.6. Соединения таллия Токсикологическое значение соединений таллия
- •Исследование минерализата на наличие ионов таллия
- •2.2.7. Соединения мышьяка Токсикологическое значение соединений мышьяка
- •Исследование минерализата на наличие ионов мышьяка
- •2.2.8. Соединения висмута Токсикологическое значение соединений висмута
- •Исследование минерализата на присутствие ионов висмута
- •2.2.9. Соединения цинка Токсикологическое значение соединений цинка
- •Исследование минерализата на наличие ионов цинка.
- •2.2.10. Соединения кадмия Токсикологическое значение соединений кадмия
- •Исследование минерализата на наличие ионов кадмия
- •2.2.11. Соединения ртути Токсикологическое значение соединений ртути
- •Исследование биологического материала на наличие ионов ртути Изолирование ртути методом деструкции
- •3. Методы количественного определения «металлических» ядов в минерализате
- •3.1. Гравиметрический метод
- •3.2. Титриметрические (объемные) методы
- •3.3. Фотоколориметрический метод
- •3.4. Атомно-абсорбционная спектроскопия
- •Эмиссионный спектральный анализ
- •3.6. Рентгено-флуоресцентный метод
- •Вопросы для самоконтроля:
- •Выберите несколько правильных ответов:
- •Выберите правильный ответ
- •Литература
2.2.4. Соединения меди Токсикологическое значение соединений меди
Соединения меди широко используются в промышленности для приготовления красок, травления стекла, в пиротехнике и в керамической промышленности. Ряд неорганических соединений меди используется в сельском хозяйстве в качестве фунгицидов в сочетании с соединениями мышьяка. Сульфат меди применяется в медицине как вяжущее и прижигающее средство. В медицине применяется и цитрат меди. Пары металлической меди, образующиеся при получении различных сплавов, могут попадать в организм с вдыхаемым воздухом и вызывать отравления. Медная посуда, применяемая для варки фруктов, содержащих органические кислоты, также может быть причиной отравления. В определенных количествах медь необходима для нормального функционирования организма человека и животных. Клиническая практика показала, что в ряде случаев возникновение анемии у человека было связано с недостатком меди в продуктах питания. Суточная потребность взрослого человека в меди, по данным ВОЗ, определяется в 2—5 мг или 30 мкг/кг массы тела. Максимально допустимое суточное поступление — 50 мкг/кг. Лишь небольшая часть меди в организме человека находится в виде свободных ионов, основная же часть связана в виде комплексных соединений с белками. Основным белком, содержащим медь, является церулоплазмин. Медь входит в состав ряда важных ферментов, принимающих участие в окислительно-восстановительных реакциях, цитохромоксидазы, аминооксидазы и его содержание в органах в виде естественного фона от 0,25 до 1,12 мг на 100 г органа. Однако в избыточных количествах медь оказывает токсическое действие. При попадании в организм с пищей, содержащей более 50 мкг/кг, наблюдаются характерные признаки отравления: металлический вкус во рту, неукротимая рвота, боли в животе; после всасывания, соединения меди действуют на капилляры, вызывают гемолиз, поражение печени и почек. При поступлении в меньших количествах медь накапливается в печени, что вызывает физиологические расстройства в организме: тошноту, рвоту, желудочную боль.
Некоторые соединения меди играют роль катализаторов окислительных процессов в пищевых продуктах. Кроме того, ряд соединений меди разрушают витамины С и А, ухудшают органолептические показатели, способствуют образованию токсичных продуктов окисления липидов. Вследствие отмеченных свойств допустимые нормы содержания меди в продуктах устанавливают часто ниже норм, определенных по токсикологическим показателям.
Исследование минерализата на наличие ионов меди
Метод дробного определения меди основан на избирательном экстрагировании её из минерализата в виде меди диэтилдитиокарбамината с последующей реэкстракцией 1% раствором сулемы.
Выделение ионов меди из минерализата. 10 мл фильтрата (после отделения серебра хлорида) нейтрализуют 10% раствором аммония гидроксида до рН = 3 по универсальному индикатору и встряхивают с 5 мл хлороформного раствора свинца диэтилдитиокарбамата. При наличии ионов меди хлороформный слой окрашивается в желтый или коричневый цвет.
Хлороформный слой отделяют и промывают 6 М раствором кислоты хлористоводородной для удаления избытка свинца диэтилдитиокарбамата, а затем водой очищенной. После промывания хлороформный слой взбалтывают с 1 % раствором ртути (II) хлорида. Раствор сулемы добавляют по каплям до обесцвечивания хлороформного слоя. Затем к бесцветной жидкости прибавляют 0,5— 1 мл воды, вновь энергично встряхивают, водный слой отделяют и делят на 3 части для проведения качественных реакций на ионы меди.
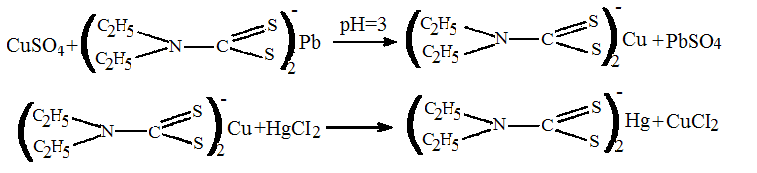
Реакция с пиридин-роданидым реактивом. В пробирку вносят 0,5 мл реэкстракта, к которому по каплям прибавляют 1—2 мл пиридин-роданидного реактива. При этом образуется осадок (или муть). К осадку прибавляют 2 мл хлороформа и хорошо взбалтывают. При наличии ионов меди хлороформный слой приобретает изумрудно-зеленую окраску.
Чувствительность реакции – 1 мкг/мл. Граница обнаружения – 0,4мг/100 г объекта.
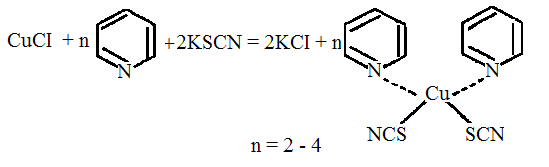
Реакция с аммония тетратиоцианатомеркуриатом (II). К 0,5 мл реэкстракта прибавляют несколько капель 5 % раствора цинка сульфата и несколько капель раствора аммония тетратиоцианатомеркуриата (II). При наличии ионов меди выпадает розовато-лиловый или фиолетовый осадок тетратиоцианатомеркуриата (II) меди и цинка.
CuCl2+ 2(NH4)2[Hg(CNS)4] + ZnSO4 CuZn[Hg(CNS)4]2↓ + 2NH4Cl + (NH4)2SO4.
Чувствительность реакции – 0,1 мкг/мл.
Реакция с калия гексацианоферратом (II). К 0,5 мл реэкстракта прибавляют 2 капли 5 % раствора калия гексацианоферрата (II) и 2 капли 2 % раствора кадмия хлорида. При наличии ионов меди выпадает красно-бурый осадок.
СuСl2+ CdCl2 + K4[Fe(CN)6] CuCd[Fe(CN)6]↓ + 4КСl.
Чувствительность реакции – 0,1 мкг/мл.
