
- •Определение кислотности водной среды
- •Доц., к.Х.Н. Озерянская в.В.
- •1 Цель работы
- •2 Общие положения
- •Константа диссоциации воды (т.Е. Константа равновесия данного процесса) при постоянной температуре равна:
- •3 Задание
- •4 Экспериментальная часть к работе допускаются студенты, прочитавшие методические указания и ответившие на контрольные вопросы (см. Раздел 6). Оборудование и материалы
- •Ход работы
- •5 Выводы
- •6 Контрольные вопросы
- •Содержание отчета по работе:
- •1. Цель работы
- •Литература
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ"
КАФЕДРА "БЕЗОПАСНОСТЬ ЖИЗНЕДЕЯТЕЛЬНОСТИ
И ЗАЩИТА ОКРУЖАЮЩЕЙ СРЕДЫ"
Определение кислотности водной среды
Методические указания
к лабораторным и практическим занятиям
Ростов-на-Дону
2003
Составители: доц., к.х.н. Пустовая Л.Е.
Доц., к.Х.Н. Озерянская в.В.
доц., к.х.н. Кравченко В.М.
доц., к.т.н. Михайлов А.Н.
доц., к.х.н. Лоскутникова И.Н.
УДК 504.054(07)
Определение кислотности водной среды: Методические указания к лабораторным и практическим занятиям / Издательский центр ДГТУ, 2003, 7 с.
Предназначены для студентов всех специальностей и форм обучения.
Печатается по решению методической комиссии гуманитарного факультета.
Научный редактор – проф., д.ф.н. Аствацатуров А.Е.
Рецензент – доц., к.б.н. Воронова Н.В.
© Издательский центр ДГТУ
2003
1 Цель работы
Сформировать представление о кислотности водных растворов, водородном показателе и методах его измерения.
2 Общие положения
Известно, что чистая вода является слабым электролитом, то есть в очень малой степени, но все-таки проводит электрический ток. Наличие у чистой воды слабой электропроводности обусловлено протеканием процесса самоионизации (диссоциации) незначительной части её молекул:
Н2О Н+ + ОН–
Константа диссоциации воды (т.Е. Константа равновесия данного процесса) при постоянной температуре равна:
К =
![]() ,
(1)
,
(1)
где
![]() ,
,
![]() ,
,![]() – равновесные молярные (моль/л)
концентрации катионов водорода (Н+),
гидроксид-анионов (ОН–)
и недиссоциированных молекул воды
(Н2О).
– равновесные молярные (моль/л)
концентрации катионов водорода (Н+),
гидроксид-анионов (ОН–)
и недиссоциированных молекул воды
(Н2О).
Так как степень диссоциации воды очень мала (10-16), то концентрацию недиссоциированных молекул воды в чистой воде и разбавленных водных растворах можно считать величиной постоянной:
![]() = const ,
= const ,
поэтому её объединяют с константой диссоциации воды, откуда уравнение (1) приобретает следующий вид:
К .
![]() = KW
=
= KW
=
![]() .
.![]() (2)
(2)
Константу KW называют ионным произведением воды. Ионное произведение воды зависит только от температуры и при 25 С составляет KW = 1 . 10-14. Таким образом, уравнение (2) показывает, что для чистой воды и разбавленных водных растворов при постоянной температуре произведение концентраций ионов Н+ и ОН– есть величина постоянная.
Раствор, в котором концентрации катионов
водорода и гидроксид-анионов равны
между собой (![]() =
=![]() ),
называют нейтральным. В случае
преобладания в растворе катионов
водорода (
),
называют нейтральным. В случае
преобладания в растворе катионов
водорода (![]()
![]() )
его считают кислым. Если же большим
значением характеризуется концентрация
гидроксид-анионов (
)
его считают кислым. Если же большим
значением характеризуется концентрация
гидроксид-анионов (![]()
![]() ),
то раствор называют щелочным. При
этом произведение концентраций ионов
Н+
и ОН–
всегда остается постоянным и равным
KW.
),
то раствор называют щелочным. При
этом произведение концентраций ионов
Н+
и ОН–
всегда остается постоянным и равным
KW.
Таким образом, поскольку величины
![]() и
и
![]() связаны между собой ионным произведением
воды KW,
то достаточно знать концентрацию одного
типа ионов в растворе, чтобы вычислить
концентрацию другого типа ионов. По
этой причине кислотность
водных растворов условились выражать
через концентрацию катионов водорода
(
связаны между собой ионным произведением
воды KW,
то достаточно знать концентрацию одного
типа ионов в растворе, чтобы вычислить
концентрацию другого типа ионов. По
этой причине кислотность
водных растворов условились выражать
через концентрацию катионов водорода
(![]() ):
чистая вода и нейтральные растворы
характеризуются значением
):
чистая вода и нейтральные растворы
характеризуются значением
![]() =
1 . 10-7 моль/л, кислые
–
=
1 . 10-7 моль/л, кислые
–
![]()
1 . 10-7 моль/л, а
щелочные –
1 . 10-7 моль/л, а
щелочные –
![]()
1 . 10-7 моль/л.
1 . 10-7 моль/л.
Однако в настоящее время пользуются
более удобным способом выражения
кислотности растворов – не через
абсолютное значение
![]() ,
а через его отрицательный десятичный
логарифм, который называют водородным
показателем и
обозначают как pH:
,
а через его отрицательный десятичный
логарифм, который называют водородным
показателем и
обозначают как pH:
pH = – lg![]()
Например, при
![]() =
1 . 10-2 моль/л величина
водородного показателя соответствует
2 (1 ион Н+
на 100 молекул Н2О), при
=
1 . 10-2 моль/л величина
водородного показателя соответствует
2 (1 ион Н+
на 100 молекул Н2О), при
![]() =
1 . 10-4 моль/л она
равна 4 (1 ион Н+
на 10000 молекул Н2О) и т.д.
=
1 . 10-4 моль/л она
равна 4 (1 ион Н+
на 10000 молекул Н2О) и т.д.
Исходя из величины KW, диапазон изменения значений pH составляет от 0 до 14 логарифмических единиц. На этом основании датским химиком C. Сёренсеном была предложена диаграмма кислотности водных растворов или шкала pH, согласно которой различают следующие реакции водных сред:
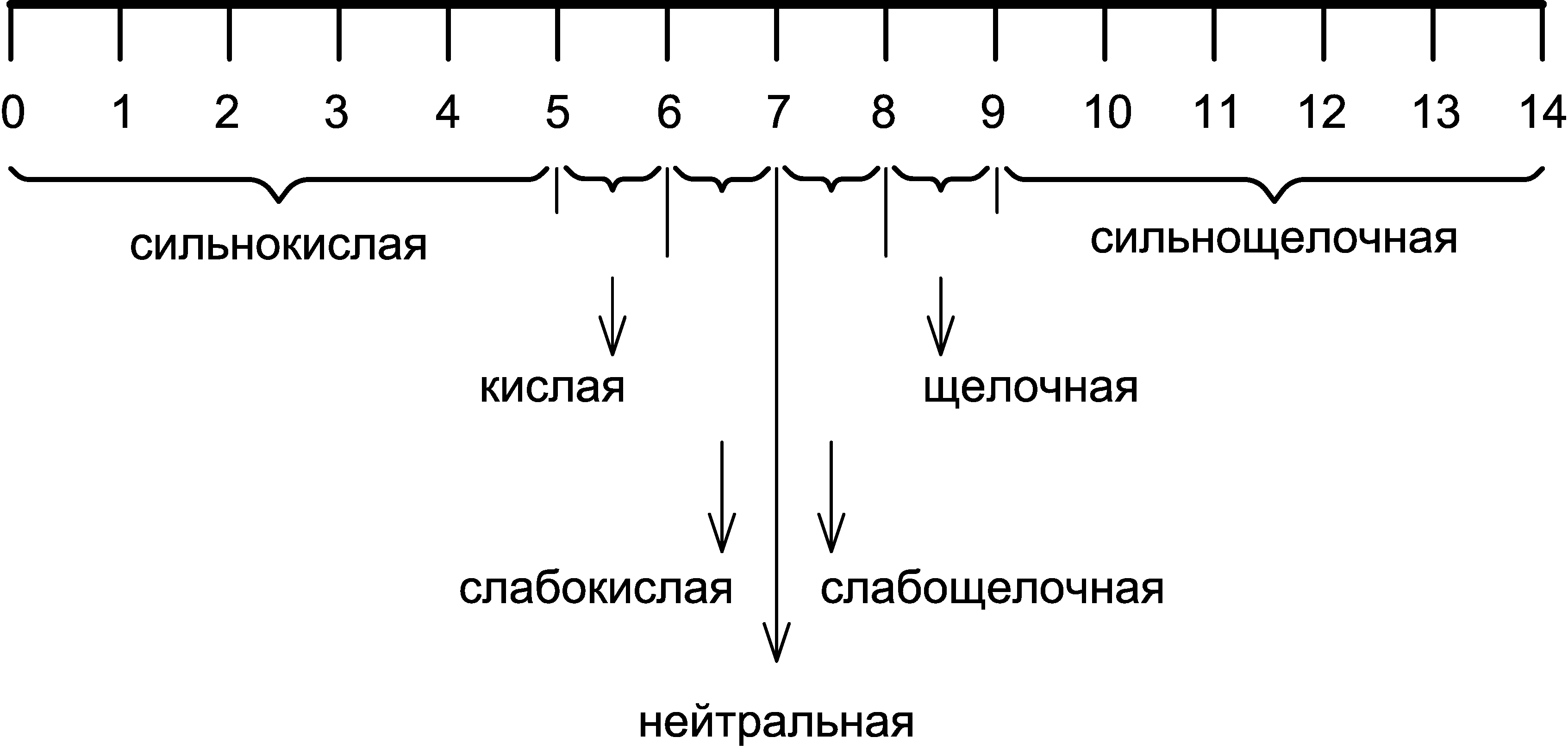
Нормальная жизнедеятельность огромного большинства живых организмов, населяющих биосферу, в том числе и человека, возможна только в условиях реакции среды, близкой к нейтральной, поэтому постоянный контроль уровня кислотности компонентов окружающей природной среды и различных техногенных объектов приобретает огромную важность.
В инженерной экологии большое значение имеет определение кислотности сточных вод промышленных предприятий для выбора оптимальных схем их очистки. В зависимости от величины pH сточные воды подразделяют на группы по степени агрессивности:
- сильноагрессивные: рН < 6 и рН > 9
- слабоагрессивные: рН = 6–6,5 и рН = 8–9
- неагрессивные: рН = 6,5–8
Неагрессивные с точки зрения кислотности сточные воды сбрасываются в канализационную сеть или природные водоемы без обработки, слабоагрессивные проходят легкую корректировку величины pH, а сильноагрессивные подвергаются глубокой очистке (нейтрализации). Нейтрализацию осуществляют смешением кислых и щелочных стоков, добавлением реагентов (растворы кислот, щелочей, соды и др.), пропусканием кислых газов (CO2, SO2 и др.), фильтрованием через нейтрализующие материалы (мел, известь и др.).
Общий принцип измерения величины водородного показателя заключается в следующем: необходимо сравнить свойство исследуемого раствора со свойством раствора с известным значением pH (стандартный буферный раствор) и выполнить соответствующий расчёт.
Для определения величины pH водных сред на практике обычно используют следующие методы: потенциометрический, спектрофотометрический, флуориметрический и с помощью индикаторной бумаги.
Для быстрой оценки значения pH применяют индикаторную бумагу, которая представляет собой бумажные полоски, пропитанные раствором того или иного индикатора. Общеизвестна универсальная индикаторная бумага, пропитанная смесью нескольких разноокрашенных индикаторов. Точность определения кислотности растворов с помощью индикаторной бумаги невелика: 1 единица pH. Сейчас используют современный вариант индикаторной бумаги – тест-полоски, на которые нанесены цветные штрихи, содержащие различные индикаторы. Определённое изменение окраски цветных полосок образует своеобразный штрих-код, отвечающий определённому значению pH. Точность измерения кислотности растворов с применением тест-полосок составляет десятые доли единиц pH.
Спектрофотометрическое определение кислотности среды проводится с использованием кислотно-основных индикаторов и основано на условии, что pH двух одинаково окрашенных растворов равны, если концентрация индикатора и температура обоих растворов одинаковы. Интенсивность окраски растворов оценивается световым поглощением диссоциированной и недиссоциированной форм индикатора, измеряемым на спектрофотометрах при определённых длинах волн:
HInd Н+ + Ind–
Окраска 1 Окраска 2
Таким образом, измерение величины pH сводится к определению соотношения в растворе концентраций двух окрашенных форм индикатора.
Флуориметрическое определение величины pH сходно со спектрофотометрическим. Разница заключается в использовании флуоресцентных индикаторов и измерении интенсивности флуоресценции диссоциированной и недиссоциированной форм такого индикатора.
Потенциометрическое определение величины pH заключается в измерении электродвижущей силы (ЭДС) электрохимической цепи, состоящей из погружённых в исследуемый раствор двух электродов – индикаторного, потенциал которого (ЕInd) зависит от концентрации катионов водорода, и электрода сравнения, потенциал которого (EStd) постоянен:
ЭДС = ЕInd – EStd
В качестве индикаторного электрода обычно используют стеклянный электрод, в качестве электрода сравнения – хлоридсеребряный.
Стеклянный электрод представляет собой тонкостенную сферу (шарик), изготовленную из специального стекла, обладающего селективностью по отношению к катионам водорода (то есть способностью обмениваться закреплёнными на внешней поверхности стекла катионами щелочных металлов только с ионам Н+ из всех типов ионов, находящихся в растворе). Стеклянный электрод заполнен внутренним раствором с постоянным значением pH (обычно 0,1 моль/л раствор HCl), в который погружён внутренний электрод сравнения. Когда стеклянный электрод погружают в исследуемый раствор, то между внешней и внутренней поверхностями стеклянной мембраны возникает разность потенциалов, измерение которой и позволяет определять ЭДС и, как следствие, значение pH.
Точность измерения кислотности растворов спектрофотометрическим и флуориметрическим методами составляет 0,1 ед. pH, а в потенциометрическом методе она достигает 0,01–0,001 ед. pH.
