
- •Основные количественные законы
- •Закон сохранения массы вещества
- •2.1. Основные понятия
- •2.1.1. Способы выражения содержания растворенного вещества
- •2.1.2. Способы приготовления растворов заданной концентрации
- •2.2. Экспериментальная часть
- •2.2.1. Приготовление раствора гидроксида натрия заданной концентрации (опыт 2.1)
- •2.2.2. Определение концентрации гидроксида натрия (опыт 2.2)
- •2.2.3. Определение общей жесткости воды (опыт 2.3)
- •2.3. Контрольные вопросы
- •3.1. Термодинамические закономерности химических процессов
- •Диспер-
- •сная
- •фаза
- •Тип системы
- •Примеры
- •Золи, суспензии
- •Эмульсии
- •Газовые эмульсии, пена
- •Туман, облака
- •Атмосфера Земли
- •В данной лабораторной работе понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя используется для определения молярной массы неизвестного растворенного вещества.
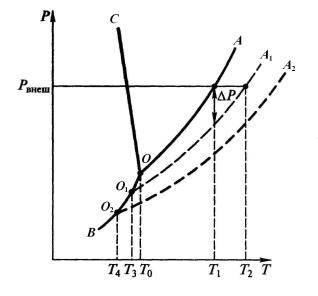
- •Из всех растворителей наибольшее значение имеет вода. Рассмотрим фазовую диаграмму «P – T» воды (рис. 5.1).
- •Температурой кристаллизации называют температуру, при которой давление пара над жидкостью становится равным давлению пара надо льдом (точка Т0 на рис. 5.1). Для воды Т0 = 0 оС.
- •Шкала рН
- •7.4. Направление протекания ОВР
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Электродные потенциалы и гальванические элементы
- •8.2. Электрохимическая коррозия металлов
- •8.3. Электролиз водных растворов электролитов
- •8.4. Химические источники тока
- •8.5. Экспериментальная часть
- •8.5.1. Изготовление и изучение работы медно-цинкового гальванического элемента (опыт 8.1)
- •8.5.2.Электрохимическая коррозия при образовании гальванических пар (опыт 8.2)
- •Взаимодействие цинка с серной кислотой в отсутствие и в присутствии меди
- •Коррозия оцинкованного и луженого железа
- •8.5.3. Электролиз растворов солей (опыт 8.3)
- •Электролиз водного раствора сульфата натрия
- •Электролиз водного раствора иодида калия
- •Электролиз водного раствора сульфата меди
- •8.5.4. Изготовление и изучение работы свинцового аккумулятора (опыт 8.4)
- •8.6. Контрольные вопросы
- •10.1. Общая характеристика семейства
- •10.2. Химические свойства соединений d-металлов
- •10.3. Экспериментальная часть
- •10.3.1. Взаимодействие d-металлов с кислотами (опыт 10.1)
- •10.3.2. Свойства оксидов и гидроксидов d-металлов (опыт 10.2)
- •10.3.3. Свойства солей d-металлов (опыт 10.3)
- •10.3.4. Окислительно-восстановительные свойства соединений d-металлов (опыт 10.4)
- •Восстановительные свойства солей хрома (III)
- •Окислительные свойства дихромата калия
- •10.3.5. Комплексные соединения d-металлов (опыт 10.5)
- •10.4. Контрольные вопросы
- •3. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ………..
- •6. ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ……………………………
- •10. d-ЭЛЕМЕНТЫ……………………………………………………...
- •10.1. Общая характеристика семейства…………………………….
- •10.2. Химические свойства соединений d-металлов………………
- •10.3. Экспериментальная часть………………………………………
- •10.3.1. Взаимодействие d-металлов с кислотами (опыт 10.1)……….
- •10.3.2. Свойства оксидов и гидроксидов d-металлов (опыт 10.2)…..
- •10.3.3. Свойства солей d-металлов (опыт 10.3)…………………
- •10.3.5. Комплексные соединения d-металлов (опыт 10.5.)…………..
Какое явление называют адсорбцией?
Обсудите адсорбционные свойства активированного угля. При каких условиях выпадает осадок?
5. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ. |
ОПРЕДЕ- |
ЛЕНИЕ МОЛЯРНОЙ МАССЫ |
РАСТВОРЕН- |
НОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ
Свойства растворов, которые зависят только от концентрации частиц в растворе, но не зависят от их природы, называются коллигативными. К таким свойствам относятся понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры кристаллизации раствора в сравнении с чистым растворителем, осмотическое давление.
В данной лабораторной работе понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя используется для определения молярной массы неизвестного растворенного вещества.
5.1. Теоретическое обоснование работы
Из всех растворителей наибольшее значение имеет вода. Рассмотрим фазовую диаграмму «P – T» воды (рис. 5.1).
Рис. 5.1. Фазовая диаграмма «P – T» воды и водного раствора
При любом сочетании значений давления и температуры вода существует в том или ином агрегатном состоянии – в виде льда (область ВОС),
42
