
Лабораторная работа 3.
Тепловой эффект реакции нейтрализации
Цель работы. Освоить методику калориметрических измерений; определить тепловой эффект реакции нейтрализации серной кислоты щелочью; овладеть термохимическими расчетами.
Выполнение работы.
Определение теплового эффекта реакции производят в приборах, называемых калориметрами. Простейший из них изображен на рисунке 3.
Опыт 1. Нейтрализация серной кислоты в две стадии.
 В
калориметрический стакан налила 50 см3
1М
раствора серной кислоты. Измерила
температуру (t1).
В два цилиндра отмерила по 25 см3
2М раствора гидроксида натрия. В раствор
кислоты быстро и без потерь вылила из
первого цилиндра щелочь. Перемешала
путем встряхивания полученный раствор
соли NaHSO4
и быстро измерила максимальную температуру
(t2).
К полученному раствору соли NaHSO4
быстро прилила раствор NaOH
из второго цилиндра и после перемешивания
измерила максимальную температуру (t3)
раствора средней соли Na2SO4.
Результаты опыта записала в таблицу 4.
В
калориметрический стакан налила 50 см3
1М
раствора серной кислоты. Измерила
температуру (t1).
В два цилиндра отмерила по 25 см3
2М раствора гидроксида натрия. В раствор
кислоты быстро и без потерь вылила из
первого цилиндра щелочь. Перемешала
путем встряхивания полученный раствор
соли NaHSO4
и быстро измерила максимальную температуру
(t2).
К полученному раствору соли NaHSO4
быстро прилила раствор NaOH
из второго цилиндра и после перемешивания
измерила максимальную температуру (t3)
раствора средней соли Na2SO4.
Результаты опыта записала в таблицу 4.
Опыт 2. Нейтрализация серной кислоты в одну стадию.
В калориметрический стакан налила 50 см3 1М раствора серной кислоты. Измерила температуру (t1). В цилиндр отмерила 50 см3 2М раствора щелочи NaOH. В раствор кислоты быстро и без потерь вылила из цилиндра щелочь. Перемешала путем встряхивания полученный раствор средней соли Na2SO4. Измерила максимальную температуру (t2). Результаты опыта внесла в таблицу 4.
Обработка результатов опыта
Теплота, выделяющаяся в результате реакции нейтрализации, вычисляется по формуле 16
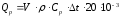 ,
(16)
,
(16)

где
 - теплота, кДж;
- теплота, кДж;
 - общий объем раствора в калориметре,
см3;
- общий объем раствора в калориметре,
см3;
 - плотность раствора в калориметре,
г/см3;
- плотность раствора в калориметре,
г/см3;
 р
– эффективная удельная теплоемкость
раствора, Дж/г·К;
р
– эффективная удельная теплоемкость
раствора, Дж/г·К;
 - разность температур до и после реакции,
К; 20 – коэффициент, приводящий количество
кислоты к 1 моль; 10–3
– переводной коэффициент Дж в кДж.
- разность температур до и после реакции,
К; 20 – коэффициент, приводящий количество
кислоты к 1 моль; 10–3
– переводной коэффициент Дж в кДж.
Введение эффективной удельной теплоемкости раствора связано с тем, что тепловой эффект реакции нейтрализации расходуется не только на нагревание самого раствора, но и нагревании стенок внутренней части колориметра (стеклянного стакана), причем масса этой част и системы строго говоря неизвестна, на нагревание термометра, на испарение воды при росте температуры раствора и т.д. Из-за относительно малых объемов кислоты и основания влияние этих факторов значительно, и для учета этого влияния вводят так называемую «постоянную калориметра», которая в нашей случае заменена эффективной теплоемкостью растворов.
1 Рассчитала тепловой эффект первой и второй стадии реакции нейтрализации в первом опыте.
2 Рассчитала тепловой эффект реакции нейтрализации во втором опыте.
3 На основании следствия из закона Гесса рассчитала теоретический тепловой эффект реакции нейтрализации серной кислоты щелочью, если известны теплоты образования продуктов реакции и исходных веществ таблица 5.
 4
Сравнила тепловой эффект реакции
нейтрализации во втором опыте с
теоретическим тепловым эффектом.
4
Сравнила тепловой эффект реакции
нейтрализации во втором опыте с
теоретическим тепловым эффектом.
 5
Сравнила суммарный тепловой эффект
реакции нейтрализации в первом опыте
с тепловым эффектом во втором опыте и
сделать вывод о выполнении закона Гесса.
5
Сравнила суммарный тепловой эффект
реакции нейтрализации в первом опыте
с тепловым эффектом во втором опыте и
сделать вывод о выполнении закона Гесса.
Таблица 4
|
Стадия опыт I (1,2) опыт II (3) |
Общий объем, см3 |
Раствор соли |
Температура, К |
||||
|
Плотность, г/см3 |
Уд. теп., Дж/г·К |
tнач |
tкон |
|
|||
|
1 |
75 |
1,049 |
5,02 |
23 |
31,3 |
8,3 |
|
|
2 |
100 |
1,051 |
6,27 |
31,3 |
35,6 |
4,3 |
|
|
3 |
100 |
1,051 |
5,64 |
23,1 |
36,1 |
13 |
|
Таблица 5
|
Вещество |
|
|
Na2SO4 |
-1384,60 |
|
H2SO4 |
-811,30 |
|
NaOH |
-427,80 |
|
H2O |
-285,83 |

 t
t ,
кДж/моль
,
кДж/моль