
- •Экзаменационный билет №7
- •1. В межбольничной аптеке после стерилизации было выявлено пожелтение раствора для инъекций, содержащего лекарственное вещество со следующей структурой:
- •5. Охарактеризуйте условия хранения различных групп лекарственного растительного сырья.
- •6. Как можно оценить антибиотическую активность лс, поступивших на контроль с целью проверки их концентрации? Ответ
Экзаменационный билет №7
1. В межбольничной аптеке после стерилизации было выявлено пожелтение раствора для инъекций, содержащего лекарственное вещество со следующей структурой:
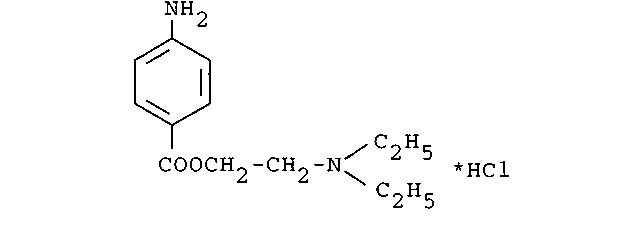
Дайте обоснование возможным изменениям лекарственного вещества при приготовлении лекарственной формы.
Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, значение рН раствора, спектральные и оптические характеристики) и их использование для оценки качества.
В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Ответ
Новокаин
При приготовлении лекарственной формы – раствора для инъекций новокаина гидрохлорида, при стерилизации произошло пожелтение раствора. Новокаина гидрохлорид легко гидролизуется по сложноэфирной группировке, после чего предположительно, идет окисление с образованием окрашенных продуктов хиноидной структуры.Это и могло послужить причиной вышеуказанных изменений. Также новокаина г/хл легко гидролизуется в щелочной среде, поэтому для его стабилизации используют 0,1 М р-р НСl.
Л атинское
название – Novocainum, рациональное название
- Новокаин (Procaine), Новокаин Гидрохлорид
(Procaine Hydrochloride).
атинское
название – Novocainum, рациональное название
- Новокаин (Procaine), Новокаин Гидрохлорид
(Procaine Hydrochloride).
Хим. Группа – произв. ПАБК.
Состоит из: 1) Сложноэфирная группа; 2) Третичная аминогруппа; 3) ПААГ; 4) г/хл
Фарм. Группа – анестезирующее средство.
Описание. Белый кристаллический порошок или бесцветные кристаллы. ОчЛР в воде, Р в спирте 96%, МР в хлороформе.
рН.От 6,0 до 7,5 (1% р-р)
Подлинность.
ИК спектр должен соответствовать рисунку спектра стандарта.
УФ спектр должны иметься характерные максимумы.
ТСХ
Выделение основания новокаина – маслообразной жидкости – при действии на раствор новокаина раствором едкого натра. Реакция основана на том, что более сильное основание (NaOH) вытесняет более слабое органическое основание (новокаин), нерастворимое в воде (бесцветные маслянистые капли):

Рреакция на первичную ароматическую аминогруппу – (Н2N-Ar) - образования азокрасителя по реакциидиазотирования с последующим азосочетанием. Реакция основана на том, что первичные ароматические амины при действии натрия нитрита в кислой среде легко образуют соли диазония (реакция диазотирования), которые далее при реакции азосочетания с β-нафтолом в щелочной среде образуют азокраситель. Появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. Это групповая (общая) реакция для всех первичных ароматических аминов.

Хлорид-ион доказывают по реакции образования белого осадка хлорида серебра при действии на раствор новокаина раствором серебра нитрата в азотнокислой среде.
R·HCl + AgNO3 → AgCl↓ + R·HNO3
Реакция окисления перманганата калия KMnO4. Новокаин легко окисляется (отличие от кокаина) при добавлении 0,15 мл разв. серной кислоты и 1 мл р-раKMnO4; фиолетовое окрашивание исчезает сразу.
Примеси. Препарат д.б. бесцветным при добавлении 1) 2 мл серной к-ты конц.; 2) 5 мл азотной к-ты. Определяют тяж. Ме, сульфатную золу.
Количественное определениеКоличественное содержание препарата определяют методом нитритометрии (ГФ X) и другими методами, характерными для препаратов — эфиров n-аминобензойной кислоты.
Новокаин можно определить также по хлороводородной кислоте методами аргентометрии (м. Фаянса- среда уксусно-кислая) или нейтрализации (инд-р бромфеноловый синий, орг. Основание новокаина извлекается в хлороформенный слой). В последнем случае титрование ведется в присутствии хлороформа для извлечения выделяющегося основания.
Метод нитритометрии. Прямое титрование. Основан на реакции диазотирования ПААГ с образованием соли диазония. Титрант – нитрит натрия – NaNO2 . Среда – кислая.
Реакция при титровании:

ТЭ – 1) По ГФ X– внешний индикатор – йодкрахмальная бумага 2) с использованием внутренних индикаторов – нейтральный красный или смесь тропеолина 00 с метиленовым синим. 3) потенциометрически
Параллельно проводят контрольный опыт, т.к. часть нитрита натрия расходуется на окисление индикатора.
![]()
1 мл 0,1 М р-ра натрия нитрита соответствует 27,28 мг новокаина г/хл
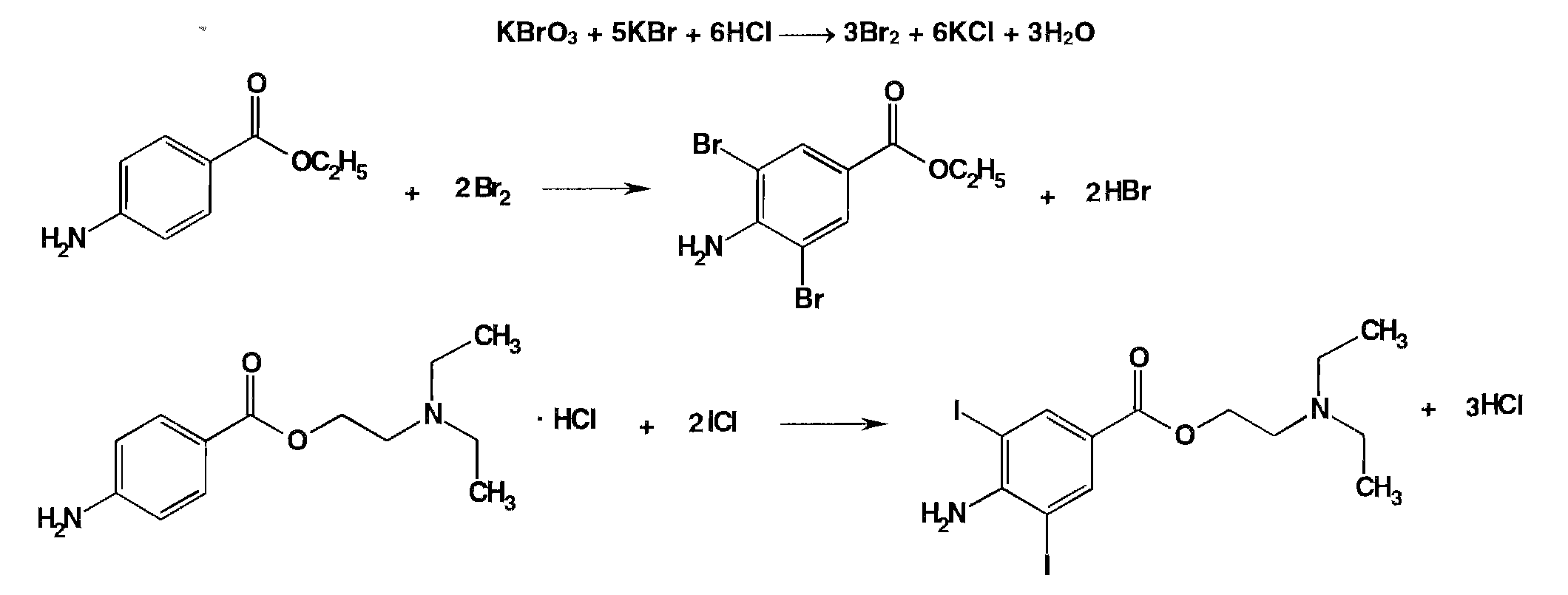
2) Метод бромид-броматометрического и йодхлорметрического титрования, основанный на образовании дибром- и дийодпроизводных:
Кроме кристаллического препарата новокаина, ГФ X описывает и другой его препарат — Solutio Novocaini 0,25%, 0,5%, 1% aut 2% pro injectionibus.
Хранить следует в хорошо закупоренных банках из оранжевого стекла.
2-3. Дайте характеристику различным видам стабилизации растворов для инъекций - химической, физической и микробиологической - в условиях промышленного производства.
Объясните основные положения теории гидролитического и окислительно- восстановительного процессов, имеющих место при стерилизации растворов.
Перечислите факторы, влияющие на устойчивость лекарственных веществ в растворах инъекционного применения. Дайте заключение о причинах недоброкачественности лекарственного препарата.
Обоснуйте условия стабилизации и хранения.
Ответ
Согласно требованиям ГФ - XI все лекарственные формы для инъекций должны быть:
- Стерильными;
- Апирогенными;
- Нетоксичными;
- Не содержать механических включений, т.е. чистыми;
- Стабильными, а некоторые, таким, как физиологическим растворам, предъявляются еще дополнительные требования:
Изотоничность;
Изогидричность;
Изовязкость;
Изоионичность.
Стабильность - это (устойчивость) неизменяемость состава и концентрации, находящихся в растворе лекарственных веществ, в течение установленных сроков хранения.
Она зависит от качества исходных растворителей и лекарственных веществ, которые должны полностью отвечать требованиям ГФ, ФС, ФСП, ГОСТ и иметь квалификацию «химически чистый (х.ч) или «чистый для анализа» (ч.д.а.). Некоторые вещества для изготовления инъекционных растворов считаются пригодными на основании дополнительных исследований на чистоту, т.е. дополнительной очистки.
Повышенной степенью чистоты должны обладать:
Кальция хлорид - проверяется на растворимость в этаноле (органические примеси) и содержание железа;
Натрия гидрокарбонат; 5% раствор для инъекций должен быть прозрачен и бесцветен после термической стерилизации, примеси ионов Са++ и Mg++ в нем допускается не более 0,01 %. В субстанции (порошке) натрия гидрокарбоната в квалификации «ч.д.а.», «х.ч» и «для фармацевтических целей» содержание примесей ионов Са++ и Mg + допускается соответственно не более 0,01%, 0,005%, 0,008%.
Гексаметилентетрамин: его проверяют на отсутствие аминов, солей аммония и параформа;
Магния сульфат не должен содержать примеси марганца;
Глюкоза не должна содержать пирогенные вещества;
— Кофеин - натрия бензоат не должен содержать органические примеси; 20% раствор должен быть прозрачным и бесцветным при нагревании в течение 30 мин.
— Натрия бензоат не должен содержать ионы железа более чем 0,0075%
— Эуфиллин не должен содержать повышенное количество этилендиамина (18 - 22%), выдерживать испытания на растворимость (10% раствор его должен быть прозрачным);
— Камфора должна быть оптически активной, а не рацемической.
Чем выше чистота препарата, тем его раствор стабильнее. Повышенной чистотой должен обладать и натрия цитрат, кальция глюконат и др. На стабильность лекарственных веществ влияют следующие факторы:
- Реакция среды водного раствора (рН), которая является химическим и биологическим стабилизатором.
Сильно кислая и сильно щелочная среда являются консервирующими, т.е. чувствительными для микроорганизмов. Но в, то, же время в таких средах многие лекарственные вещества подвергаются химическим изменениям (реакция гидролиза, окисления), которые усиливаются при тепловой стерилизации. Кроме того очень кислые и щелочные растворы в виде инъекций очень болезненны, поэтому для каждого лекарственного вещества на практике подбирают с помощью стабилизаторов то значение рН среды, которое позволяет сохранить их в неизменном виде после стерилизации и при хранении.
Выбор стабилизатора зависит от физико-химических свойств лекарственных веществ. Условно их делят на 3 группы:
Соли сильных кислот и слабых оснований (водные растворы имеют слабокислую или кислую среду);
Соли сильных оснований и слабых кислот (водные растворы имеют слабощелочную или щелочную среду;
3. Легкоокисляющиеся вещества.
Для стабилизации растворов солей слабых оснований и сильных кислот применяют 0,1М раствор хлористоводородной кислоты, как правило, в количестве 10 мл на 1л стабилизируемого раствора. При этом рН раствора смещается в кислую сторону до 3,0. Например:
- раствор дибазола 0,5%, 1%, 2%;
- атропина сульфат от 0,05% - 2,5%, 5%;
- апоморфина гидрохлорид 1%;
глюкозы 10%, 50%;
дикаина 0,1%, 0,25%.
Для растворов новокаина количество 0,1М раствора хлористоводородной кислоты может варьировать в зависимости от концентрации:
Для 0,25% раствора - 3 мл;
Для 0,5% - 4 мл;
Для 1% - 9 мл;
Для 2%-12 мл.
При термической стерилизации ускоряются процессы, гидролиза и окисления нестабилизированных растворов. Степень диссоциации резко возрастает и концентрация Н+ и ОН" в растворе лекарственного вещества увеличивается. Ионы гидроксила - связываются в слабо - диссоциируемые основания. В растворе накапливаются свободные ионы водорода, рН снижается. Одновременно происходит щелочной гидролиз (омыление) сложноэфирных групп, возможно окисление аминогрупп:
ВА + НОН ► ВОН + Н+ + А
Вещество слабодиссоциирующее вещество
Для стабилизации добавляют кислоту для подавления гидролиза. Если учесть, что новокаин по структуре относится к сложным эфирам, которые гидролизуются в щелочной среде сильнее, чем в кислой, для стабилизации следует использовать кислоту. В обозначенной задаче произошло именно такое изменение новокаина в растворе, выразившимся в пожелтении инъекционного раствора, приготовленного без добавления стабилизатора - такой раствор не подлежит отпуску.
Соли, образованные сильным основанием и слабой кислотой (какими являются:
- натрия нитрит; кофеина - натрия бензоат, натрия тиосульфат и др.), гидролизутся при стерилизации и после при хранении с образованием слабодиссоциируемой кислоты и увеличения ОН" ионов, что приводит к увеличению рН среды (щелочности):
ВА (вещество) + НОН ► В+ + ОН" + НА (слабодиссоциируемая кислота)
Для подавления гидролиза в качестве стабилизатора добавляют NaOH или NаНСОз, в результате происходит сдвиг реакции влево в сторону малодиссоциируемой соли. В щелочной среде, создаваемой стабилизаторами, реакция гидролиза этих веществ подавляется.
Для стабилизации легко окисляющихся веществ ( кислоты аскорбиновой, аминазина) в раствор добавляют антиоксиданты - вещества, значительно легче окисляющиеся, чем лекарственные вещества, тем самым, прерывающие окислительный процесс на том или ином цикле( натрия сульфит, натрия метабисульфит, ронгалит, трилон Б и др).
К физическим факторам стабилизации относятся:
Фильтрование через беззольные фильтры, так как обычная фильтровальная бумага содержит соли кальция, магния, железа, которые являются катализаторами окислительно-восстановительного процесса;
Использование не щелочного стекла для отпуска и хранения растворов, так как процесс окисления в щелочной среде, создаваемой выделяемой щелочью, присутствующей в составе стекла;
— Использование светонепроницаемой тары, так как свет усиливает процесс окисления;
— Уменьшение содержания кислорода в воде для инъекций, для чего заранее прокипятив её и заполняя флакон доверху.
4. В аптеке, в процессе приемки товара с аптечного склада, при вскрытии упаковки с раствором лекарственного вещества указанной формулы (0,5%-го в ампулах по 5 мл), были обнаружены следы подтеков. При дальнейшем осмотре была найдена упаковка, в которой все 10 ампул были разбиты.
Каков порядок действий материально-ответственных лиц при обнаружении расхождений в количестве и качестве при приемке товара?
Как должно быть документально оформлено выявленное расхождение? Каков порядок предъявления претензий?
Каков порядок учета движения товаров в аптеке?
Ответ
Для приема товара в аптеке создается приемная комиссия не менее 3 человек. В состав входят материально ответственное лицо отдела запасов, представитель незаинтересованной организации, который должен иметь удостоверение на право приемки товаров и может быть счетный работник.
Товар принимают по количеству и качеству, осуществляется приемочный контроль в соответствии с Приказом МЗРФ № 214 по критериям: описание, упаковка, маркировка.
При обнаружении разбитых ампул необходимо пригласить представителей от поставщика или предъявить претензию к транспортной организации (если товар доставляется транспортной организацией, а не транспортом склада). По результатам приемки товара составляется «Акт об установленном расхождении в количестве и качестве при приёмке товара» в 3х экземплярах: один остается у материально ответственного лица, 2ой – передается в бухгалтерию и 3ий – поставщику.
Оформляется претензия, при оформлении претензии акт о выявленном расхождении необходимо оформлять по унифицированной форме – ТОРГ (т.к. акт по форме АП юридической силы не имеет). Оформлением претензией занимается юрист или руководитель аптеки.
Претензия предъявляется только в письменном виде или вручается адресату под расписку. В ней указывается:
Наим. организации (кому? от кого?)
Обстоятельства, являющиеся основанием для предъявления претензии и доказательства, подтверждающие изложенное
Сумма претензии и ее расчет
Почтовые и платежные реквизиты заявителя претензии
В приложении нужно приложить копию договора
Сроки предъявления претензий.
Претензии о возмещении стоимости недостающих товаров или товаров ненадлежащего качества предъявляются в течение 1 месяца, по остальным в теч. 2 месяцев.
Ответы на претензии.
Только в письменном виде. В них должно быть указано (кому? От кого?), при полном или частичном удовлетворении претензии указывается признанная сумма, дата, № платежного документа на эту сумму и срок и способ удовлетворения претензии.
При полном или частичном отказе в удовлетворении претензии указываются мотивы отказа со ссылкой на соответствующие документы. Указан перечень, прилагающихся к ответу документов. Сроки рассмотрения ответов на претензии 1-2 месяца.
Учета движения товаров в аптеке.
Вместе с товаром аптеку поступают сопроводительные документы:
Товарно – транспортная накладна оформляется если товар доставляется транспортом поставщика или аптеки. ТТН составляется в 2-х экземплярах на складе: один возвращается на склад в отделе хранения и служит основанием для списания отпущенного товара; второй вместе с товаром поступает в аптеку и служит основанием для оприходывания товара. ТН содержит сведения о поставщике и покупателе, наименовании товара, его цена и сумма. ТН заверяется подписями лиц, отпустивших товар и печатью поставщика.
Упаковочный лист (вкладыш) вкладывается в каждую единицу тары (ящики, коробки). В нем перечисляется наименование товара и его количество
Счет-фактура является документом, служащим основанием для взимания НДС. Выписывается в 2-х экземплярах.
Протокол согласования цен оформляется поставщиком с целью правильного формирования отпускных и розничных цен на товар
Документ, подтверждающий качество товара
Принятый товар регистрируется в след. документах:
В журнале регистрации поступившего товара по группам
В отчете о финансово-хозяйственной деятельности аптеки за месяц (раздел №3 «Товарный отчет» в часть Приход)
ЛС, подлежащие ПКУ заносят в журнал ПКУ в часть «Приход»
ЛП, с ограниченным сроком годности (до2лет) регистрируют в журнале учета товаров с ограниченным сроком годности.
