ГОСы Все предметы / Биотехнология / 2.6 витамины
.doc2. 6. Проанализируйте преимущества биотехнологического производства витаминов на конкретных примерах и определите его основные недостатки.
Витамины представляют низкомолекулярные органические соединения, необходимые для жизнедеятельности организма, синтез которых в организме либо ограничен, либо отсутствует. Почти все водорастворимые витамины, а также жирорастворимый витамин К являются коферментами или кофакторами биохимических реакций. Витамины А, Q, Е регулируют генетический аппарат клетки.
В производстве витаминов ведущее место занимают химические методы, но в ряде производств в качестве их полноправного конкурента выступают биотехнологические методы, использование которых более предпочтительно в связи с ужесточением экологических требований к фармацевтическому производству. Производство витаминов В12, В2, В3 и D (эргостерина) осуществляется в одну стадию. Также микроорганизмы нашли свое применение и в синтезе витамина С,
Преимущества биотехнологического производства витаминов
1) возможность реакций, не осуществимых при химическом синтезе. Получение витаминов сложной структуры (B2, В12, предшественники витамина D)
2) относительно простое оборудование и отсутствие агрессивных реагентов (отличие от химического синтеза)
3) относительно дешевые исходные соединения
4) генетическая трансформация продуцентов позволяет получить высокие выходы витаминов
5) возможность сочетания биотехнологических методов с химическими синтезами, в результате чего сокращается число стадий химического синтеза витаминов (D, C убихиноны, каротиноиды.)
6) экономичность производства
7) отсутствие вредных выбросов
Недостатки биотехнологического производства витаминов
1) Для витаминов относительно простой структуры экономически более целесообразно использовать химические синтезы (А, В3)
В качестве примера рассмотрим биотехнологическое производство витамина В2 и витамина С.

рис.1. Химическая структура витамина В2.
Биосинтез флавинов осуществляется как растительными, так и многими бактериальными клетками, а также плесневыми грибами и дрожжами. Благодаря именно микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не
нуждаются в этом витамине. У человека синтезирующихся флавинов недостаточно для предупреждения гиповитаминоза.
Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной средах, а также под действием УФ-облучения. Для этого витамина характерно функционирование в коэнзимных формах: флавиномононуклеотид (ФМН) и флавиноадениндинуклеотид (ФАД). Именно на примере выделения рибофлавина в культуральную жидкость было открыто явление сверхсинтеза. При промышленном получении рибофлавина используют культуры дрожжеподобных грибов Eremothecium ashbyii и Ashbya gossipii синтезирующих до 3,8 и 6,4 г/л рибофлавина соответственно. Однако серьезным недостатком этих культур является их нестабильность при хранении на твердых средах во всем диапазоне температур - от комнатной до температуры лиофилизации, в результате чего они теряют способность к сверхсинтезу рибофлавина. Поэтому для сохранения активности штамма приходится систематически проводить рассев на твердые среды, отбирая колонии с высокой активностью, а ферментацию проводить в присутствии антибиотика во избежание заражения посторонней микрофлорой.
Сейчас вместе с вышеуказанными культурами при промышленном получении рибофлавина в помощью методов используется мутантный штамм продуцент Васillus subtilis с нарушенной регуляцией синтеза витамина В2. Этот штамм устойчив к наиболее сильному антиметаболиту рибофлавина — его аминоаналогу розеофлавину и обладает способностью к сверхсинтезу витамина В2.
При культивировании его на среде с мелассой и дрожжевым экстрактом в культуральной жидкости накапливается 3,5 — 4,5 г/л рибофлавина. При этом время ферментации сократилось в 3 раза.
Рибофлавин получают и химическим методом, используя в качестве биокатализатора сухие клетки бревибактерий. Причем, если биосинтез с нативными клетками занимает несколько суток, то при биосинтезе с суспензией сухих клеток время синтеза ФАД составляет всего 15—17 ч.
Получение аскорбиновой кислоты
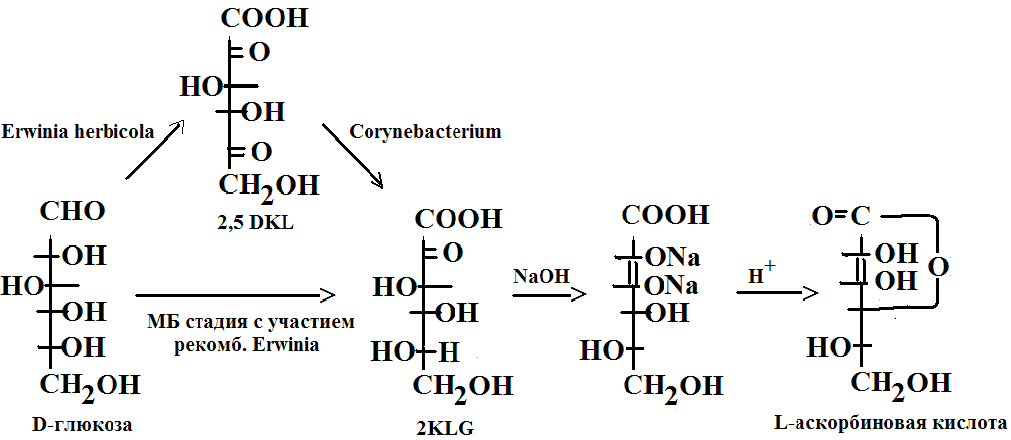
В настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют преимущественно трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических. Исходным субстратом для него является D-глюкоза.
На последнем (химическом) этапе этого процесса 2-кето-L-гулоновая кислота (2-KLG) превращается в кислых условиях в L-аскорбиновую кислоту. Биохимические исследования метеболизма различных микроорганизмов показали, что 2-KLG можно получить, включая культивирование микроорганизмов Erwinia herbicola и Corynebacterium. Сначала с участием Erwinia herbicola D-глюкоза преобразуется в 2,5-дикето-L-глюконовую кислоту (2,5DKG), а затем с участием Corynebacterium 2,5DKG превращается в 2-KLG.
Однако, совместное культивирование этих микроорганизмов оказалось невозможным из-за разных питательных сред, а последовательное – невыгодным.
Методами генетической инженерии удалось создать рекомбинантный штамм микроорганизма Erwinia herbicola со встроенным геном 2,5DKG-редуктазы из Corynebacterium.
Таким образом трансформированный штамм Erwiniа используется как фабрика, заменяющая 2-х стадийный процесс производства L- аскорбиновой кислоты с участием 2-х микроорганизмов на одностадийный.