
ДЛЯ ГОСОВ / Ответы для комиссии на экз билеты / Билет11 Фенолы РезорцинТ
.doc
ГОУВПО ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Медицинский институт
Специальность «Фармация»
Итоговый междисциплинарный экзамен
Экзаменационный билет №11
Задача 18
1. На фармацевтические предприятия и в аптеки поступает лекарственное растительное сырье, заготавливаемое от растения Arctostaphyllosuva-ursi (L.) Spreng., сем. Ericaceae.
При аналитическом контроле критериев качества сырья установлено, что в сырье содержание действующих веществ составило 8%; влажность 10,5%; золы общей 3,3%; золы, нерастворимой в 10% растворе хлористоводородной кислоты 1%; побуревших и потемневших листьев 2%; других частей растения (веточки, плоды) 4%, органической примеси 0,2%; минеральной примеси 0,1 %.
Проанализируйте полученные результаты и сделайте заключение о качестве сырья и возможности его дальнейшего использования. Поясните свое решение.
-
Дайте краткую характеристику растению и видам сырья. Какую жизненную форму имеет растение, где оно произрастает (ареал, места обитания), каковы особенности сбора сырья?
-
Укажите химический состав сырья и формулу основного действующего вещества. К какому классу веществ оно относится? Объясните, какие физико-химические свойства действующих веществ используют в фармакопейных методиках качественного и количественного определения.
-
К какой фармакологической группе относится сырье? Какие препараты получают из сырья?
2. При оценке качества вещества «3» было отмечено, что в образцах одной серии его внешний вид не отвечал требованиям НД по разделу «Описание» - образцы были отсыревшими и грязно-розового цвета.
Дайте обоснование причинам изменения его качества по данному показателю в соответствии со свойствами и приведите другие испытания, характеризующие качество данного лекарственного вещества:
• Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и ил использование для оценки качества.
• В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
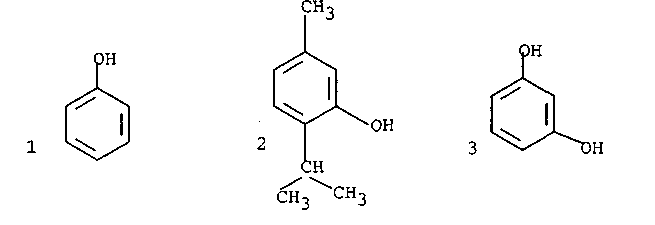
Фенолы
Кислотные свойства
Фенолы проявляют значительно большую кислотность, чем спирты и вода, однако они слабее угольной и карбоновых кислот, не окрашивают лакмус.
Значения рКа следующие фенол — 9,89, уксусная кислота - 4,76, угольная кислота — 6,12.
Чем стабильнее анион, тем сильнее кислота.

Восстановительные свойства
Фенолы легко окисляются даже кислородом воздуха, поэтому при их хранении возможно появление оттенков (розового, желтого, бурого).
о-Бензохинон
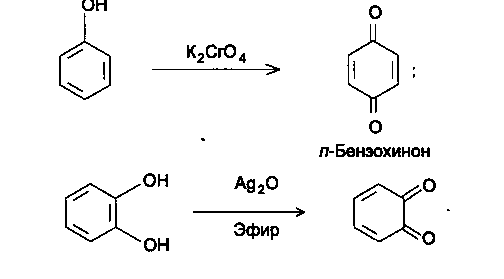
Фенолы хорошо растворяются в водных растворах щелочей с образованием фенолятов, однако данную реакцию нельзя использовать для количественного определения из-за гидролиза образующейся соли.
Фенолы не взаимодействуют с гидрокарбонатами щелочных металлов, потому что слабее угольной кислоты и не могут вытеснять ее. По реакции взаимодействия с гидрокарбонатами щелочных металлов различаются фенолы и карбоновые кислоты.
Характерной качественной реакцией на фенолы является образование окрашенных комплексов [Fe(OR)6]3~ с солями трехвалентного железа. Окраска зависит от количества гидроксильных групп, их расположения, наличия других функциональных групп.
Окраска комплексов производных фенола и железа (III) хлорида
|
Лекарственное вещество |
Окраска |
|
Фенол Резорцин Тимол (спиртовой раствор)
|
Фиолетовая Сине-фиолетовая Красно-фиолетовая
|
Галогенирование
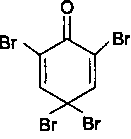
Наиболее легко идет галогенирование фенолов в щелочной среде, но в сильнощелочной среде происходит окисление фенола. Резорцин бромируется в кислой среде, образуя трибромрезорцин, который в воде растворим. Если одно из положений занято (как у тимола), образуется дибромпроизводное:

Реакции
галогенирования используются также
для количественного
определения фенолов
 .
Нитрозирование
(нитрозореакция Либермана)
.
Нитрозирование
(нитрозореакция Либермана)
На способности препаратов окисляться основана такая реакция подлинности, как индофеноловая проба. В качестве окислителя используют хлорную известь, хлорамин, бромную воду:
Реакции вдут легко, если о- и n-положения не заняты.
![]()
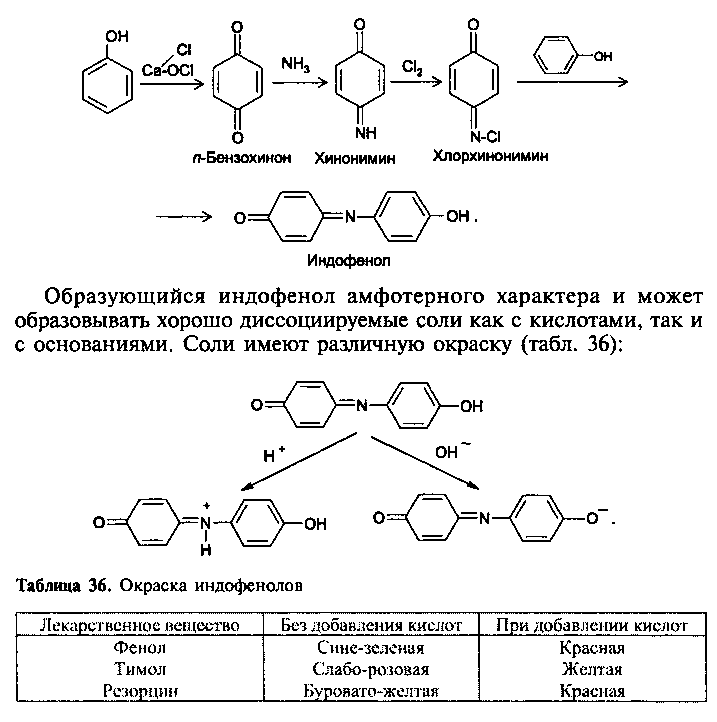
Гидроксильная группа, связанная с ароматическим ядром, в щелочном растворе — сильнейший орто- и пара-ориентант. В связи с этим для фенолов легко проходят реакции галогенирования, нитрозирования, нитрования и др.
Нитрозогруппа усиливает подвижность водорода у фенольного гидроксила, происходит изомеризация. Образующийся хиноноксим конденсируется с фенолом:

Данные об окраске образующихся при нитрозореакции Либермана индофенолов представлены в табл.
Таблица 37. Окраска индофенолов (полученных при нитрозировании)

Нитрование
Фенолы нитруются кислотой азотной, разбавленной при комнатной температуре, с образованием о- и п-нитрофенола:

Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциируемой соли:

Реакция сочетания фенолов с солью диазония в щелочной среде
Фенолы легко вступают в реакцию замещения с солями диазония в щелочной среде с образованием азокрасителей, имеющих в указанной среде окраску от оранжевой до вишнево-красной:

Это общая реакция на фенолы, не имеющие заместителей в орто-и пара-положении. Легче сочетание происходит в пара-положении из-за образования длинной цепи сопряженных связей.
Соль диазония из-за нестойкости готовят непосредственно перед проведением реакции, используя соединения с первичной ароматической аминогруппой:

При образовании азокрасителя рН среды не должна быть выше 9,0—10,0, так как в сильнощелочной среде соль диазония образует не способный к азосочетанию диазогидрат:

^ Диазогидрат Реакции окисления и конденсации
Образование арилметановых красителей происходит при конденсации фенолов с альдегид

Арилметановый краситель (красного цвета
Для тимола предлагается реакция конденсации с хлороформом в щелочной среде. Продукт реакции окрашен в красно-фиолетовый цвет:

Для фенолов со свободным п-положением характерна реакция конденсации с 2,6-дихлорхинонхлоримидом, при этом образуется индофенол:

Образование производного индофенола возможно при нитровании тимола в среде уксусного ангидрида и концентрированной серной кислоты:

Часто используются реакции конденсации фенолов с лактонами (фталевый ангидрид). С фенолом продукт конденсации называется фенолфталеином и используется как индикатор, имеющий в щелочной среде малиновую окраску:

С тимолом образуется тимолфталеин — индикатор, окрашенный в щелочной среде в синий цвет:

Резорцин сплавляют в фарфоровом тигле с избытком фталевого ангидрида в присутствии нескольких капель концентрированной H2S04. Полученный плав желто-красного цвета после охлаждения выливают в разбавленный раствор щелочи. Появляется интенсивно-зеленая флюоресценция образующегося в результате реакции флюоресцеина:

но
Анализ чистоты
В резорцине определяют примесь пирокатехина по реакции с аммония молибдатом. При наличии примеси появляется окраска, интенсивность которой сравнивают с эталонной.
Другая примесь в препарате резорцина — фенол. Примесь фенола определяют по запаху, для этого препарат с небольшим количеством воды нагревают на водяной бане при температуре 40—50 °С.
В тимоле определяют примесь фенола по реакции с железа (III) хлоридом. По условию методики ГФ концентрация тимола вследствие малой его растворимости составляет 0,085 %. Окраска комплекса тимола с железа хлоридом при такой концентрации не воспринимается, а при наличии примеси фенола появляется фиолетовая окраска. Примесь фенола в препарате недопустима.
Количественное определение
Для количественного определения фенолов используется броматометрия: как прямой (тимол), так и обратный (фенол, резор-
цин, синэстрол) способ. В склянку с притертой пробкой помещают препарат, избыток титрованного раствора калия бромата и калия бромида. Подкисляют серной кислотой:


Реакция протекает в течение 10-15 мин; на это время склянку оставляют в темном месте. Затем к смеси прибавляют раствор калия йодида и оставляют еще на 5 мин:

Прямое титрование принято ГФ для количественного определения тимола. В прямом титровании избыточная капля йода изменяет окраску индикаторов (метилового оранжевого, метилового красного). В обратном титровании выделившийся йод оттитровывают раствором тиосульфата натрия. Индикатор — крахмал.
Следует помнить, что на процесс бромирования влияют условия определения: длительность реакции, концентрация кислоты.
Молярная масса эквивалентов, обозначаемая как M(l/z) следующая:
фенол —1/6,
резорцин —1/6,
тимол —1/4,
В обратном способе обязательно проводят контрольный опыт.
