
ДЛЯ ГОСОВ / Ответы для комиссии на экз билеты / Билет 15 Ампициллин
.docГОУВПО ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Медицинский институт
Специальность «Фармация»
Итоговый междисциплинарный экзамен
Экзаменационный билет №15
Задача 32
4. В ОТК фармацевтического предприятия для оценки качества поступило от различных заводов-изготовителей несколько серий лекарственного вещества, структурная формула которого приведена ниже.

При оценке качества данного лекарственного вещества в образцах одной серии значение рН раствора не отвечало требованиям НД - было более 10,0. Дайте обоснование причинам изменения его качества по данному показателю в соответствии со свойствами. Предложите другие испытания, характеризующие его качество.
-
Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
-
В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
5. Используя задачи скрининга, сравните вышеприведенную структуру ЛС с пенициллином:
-
По спектру биологической активности.
-
По механизму его взаимодействия с клеткой.
1. β-ЛАКТАМИДЫ
К β-лактамным антибиотикам относятся пенициллины и це-фалоспорины. Они имеют сходную химическую структуру: и являются N-ацильными производными соответствующих аминокислот — 6-аминопенициллановой (пенициллины)
Пенициллины
.
Химические строение, физические и физико-химические свойства
В основе строения пенициллинов лежит 6-АПК, которая представляет собой гетероциклическую систему, состоящую из 2 конденсированных колец: четырехчленного — β-лактамного (В) и пятичленного — тиазолидинового (А).
6-АПК является дипептидом, состоящим из L-цистеина и L-валина.
L-цистеин (β-меркаптоаланин):
HS----CH2 — CH(NH2) —СООH
L-валин (L-α-аминоизовалериановая кислота)

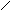


 SH
СН3
SH
СН3



 NH2-
CH----- - CH СН
-- СН3
NH2-
CH----- - CH СН
-- СН3


 O=
C--OH H2- N ------ СН
--------СООН
O=
C--OH H2- N ------ СН
--------СООН
L-валин

6-АПК
Общая формула пенициллинов:

Пенициллины отличаются друг от друга строением ацильного остатка в аминогруппе 6-АПК
Ампициллины
Ампициллины состояи из 6-АПК и -аминофенилацетамида

Антибиотики отличаются от других ЛС гетерогенностью, т.е. многокомпонентностью состава. Например, в солях бензилпенициллина сумма пенициллинов должна быть не менее 96,0%, а содержание бензилпенициллина — не менее 90,0%.
Для каждого антибиотика существует фермент, который его инактивирует. Например, пенициллиназа
Оценка качества антибиотиков проводится по дополнительным показателям — токсичности. Эти показатели определяются биологическими методами на животных.
Антибиотики занимают первое место среди препаратов, вызывающих побочные реакции: это прямая токсичность, дисбактериозы,), аллергические реакции (пенициллин).
Поскольку антибиотики смеси веществ, их активность определяется в единицах действия (ЕД).
Наряду с природными пенициллинами (бензилпенициллин в виде солей и феноксиметилпенициллин) в медицине применяются полусинтетические пенициллины (оксациллин, ампициллин, амоксициллин, карбенициллин и др.).
Выявлена зависимость между химическим строением и биологическим действием пенициллинов спектр действия пенициллина; так расщепление β-лактамной связи приводит к исчезновению свойств антибиотика и появлению аллергического действия;
Поскольку в молекулах пенициллинов содержатся асимметрические атомы углерода (С3, С5 и С6), растворы пенициллинов вращают плоскость поляризации вправо, что используется для характеристики их качества (определения удельного вращения).
ИК- спектры используется по НД главным образом для идентификации полусинтетических пенициллинов и цефалоспоринов; их сравнивают с ИК-спектром стандартного образца.
Пенициллины поглощают свет в УФ-области спектра за счет ароматического ацильного радикала в аминогруппе 6-АПК.
Бензилпенициллин и его соли имеют 2 максимума — при 257 и 263 нм, которые обусловлены наличием бензильного радикала.
Феноксиметилпенициллин имеет также 2 полосы поглощения с при 268 и 274 нм, обусловленными феноксигруппой
Метод УФ-спектрофотометрии используется также для количественного определения феноксиметилпенициллина в при длине волны 268 нм.и пригоден и для ампициллина
Светопоглощающие примеси в ампициллине натриевой соли определяют методом УФ-спектрофотометрии (оптическая плотность раствора препарата в воде при 325 нм должна быть не более 0,3).
Спектрофотометрический метод используется также для количественного определения некоторых полусинтетических пени-циллинов.
Химические свойства и реакции подлинности
Щелочи и пенициллиназа гидролизуют (3-лактамное кольцо с образованием неактивной пенициллоиновой кислоты:

Динатриевая соль пенициллоиновой кислоты
Гидроксамовая реакция
Общегрупповой реакцией на β-лактамиды является гидроксамовая реакция. При взаимодействии ампициллина со щелочным раствором гидроксиламина гидрохлорида происходит образование гидроксамовой кислоты, которая после подкисления образует окрашенные комплексные соли с солями железа (III) фиолетового цвета и зеленого цвета осадок гидроксамата меди, пригодные для

спектрофотометрического в видимой области спектра или для ФЭК-определения (гидроксамат меди — после растворения в подходящем растворителе) ампициллина.
Гидроксамат железа (III) (красно-фиолетовый раствор) Гидроксамат меди (II) (зеленый осадок)
Пеницилленовая кислота
На образовании пенниловой кислоты основана одна из реакций подлинности на растворимые соли ампициллинов.

R Пенилловая кислота (белый осадок)
Реакции на катионы солей
Реакция на калий: около 0,1 г препарата сжигают в тигле. Остаток дает характерную реакцию
А------------- на калий — с виннокаменной кислотой.
Реакция
с хромотроповой кислотой
Международная
фармакопея и некоторые зарубежные
фармакопеи для отличия пенициллинов
друг от друга рекомендуют применять
реакцию с хромотроповой кислотой. Для
этого пробирку с 2 мг препарата, 2 мг
натриевой соли хромотроповой кислоты
и 2 мл концентрированной
серной кислоты помещают в баню с
температурой
150 °С (масляную или глицериновую) и
отмечают секундомером время
погружения. Пробирку встряхивают
каждые 30 с и отмечают окраску
Ампициллин
за счет остатка аминокислоты в ацильной
части молекулы дают реакцию с нингидрином
и солями меди
(II)
(с реактивом Фелинга или раствором
меди сульфата
УФ-спектрофотометрия используется для определения посторонних примесей. В ФС регламентируется значение рН растворов (или суспензий) препаратов.
В препаратах пенициллина регламентируется содержание воды.. Допустимое содержание воды в некоторых пенициллинах представлено в табл.
|
Оксациллина натриевая соль |
Не менее 3,5% и не более 5,0% (по К. Фишеру) |
|
Ампициллин |
Не более 1,5% (по К. Фишеру) |
|
Ампициллина тригидрат |
Не менее 12,0% и не более 15,0% (по К. Фишеру) |
|
Ампициллина натриевая соль |
Не более 2,5% (по К. Фишеру) |
|
Карбенициллина динатриевая соль |
Не более 5,5% (по К. Фишеру) |
Определение йодсорбирующих примесей
Определение йодсорбирующих примесей основано на том, что сами пенициллины йодом не окисляются. Окисление йодом пени-циллинов проводится только после щелочного гидролиза и добавления ацетатного буфера при рН 4,5. Если же окисление йодом проводить в тех же условиях, но без предварительного щелочного гидролиза, то окисляться будут только возможные продукты расщепления (йодсорбирующие примеси).
Методика определения йодсорбирующих примесей в ампициллине. Около 0,25 г испытуемого препарата (точная навеска) растворяют в 50 мл 1/15 М фосфатного буфера (рН 7,0) в мерной колбе вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают (раствор А).
10 мл раствора А вносят в коническую колбу с притертой пробкой вместимостью 250 мл, прибавляют 20 мл 0,8 М раствора ацетатного буфера (рН 4,7 + 0,05), 25 мл 0,01н. раствора йода с калия йодидом, перемешивают и оставляют на 20 мин в темном месте.
Избыток йода оттитровывают 0,01 н. раствором натрия тиосульфата до слабо-желтого окрашивания, затем прибавляют 0,2 мл раствора крахмала и титруют до обесцвечивания.
Параллельно проводят контрольный опыт. Содержание йодсорбирующих примесей в процентах (X), в пересчете на сухое вещество, вычисляют по формуле:
![]()
где V — разность в объемах 0,01 н. раствора натрия тиосульфата между контрольным и основным титрованием, мл;
К — поправочный коэффициент к титру 0,01 н. раствора натрия тиосульфата;
а — навеска препарата в пересчете на сухое вещество, г;
Э — количество C16H19N3S (ампициллина), эквивалентное 1 мл 0,01 н. раствора йода, г (Э - 0,0004359).
Содержание йодсорбирующих примесей в препарате, в пересчете на сухое вещество, должно быть не более 3,5%.
В НД регламентируется количество посторонних пенициллинов в каждом из препаратов. Так, содержание бензилпенициллина в калиевой и натриевой солях должно быть не менее 90,0%, а сумма пенициллинов — не менее 96,0%. Таким образом, в препаратах допускается содержание 6,0% других пенициллинов.
Методы количественного определения
. Сумму ампицциллинов в препарате определяют йодометрическим методом.
Натриевую соли ампициллина растворяют в воде, а Затем добавляют раствор гидроксида натрия и оставляют на 20 мин. После щелочного гидролиза к смеси прибавляют соляную кислоту, раствор ацетатного буфера (рН 4,5 + 0,05) и избыток 0,01 н. раствора йода. Оставляют на 20 мин в темном месте и титруют избыток 0,01 н. раствора йода 0,01 н. раствором натрия тиосульфата. Параллельно проводят контрольный опыт с таким же количеством препарата, но без щелочного гидролиза.
При щелочном гидролизе происходит раскрытие р-лактамного кольца с образованием пенициллоиновой кислоты в открытой ти-ольной форме.
Пенициллоиновая кислота при рН 4,5 гидролизуется в присутствии окислителя (йод) до пенальдиновой кислоты и пеницилламина, которые окисляются
раствором йода соответственно до дегидропенальдиновой и пеницилламиновой (диметилцистеиновой) кислоты.

Избыток йода оттитровывают раствором натрия тиосульфата. На окисление расходуется 8 эквивалентов йода.
I2 + 2 Na2S2O3 = 2Nal + Na2S4O6
Разность в объемах между титрованиями соответствует содержанию суммы пенициллинов в препарате.
Содержание суммы пенициллинов в процентах (X) вычисляю' по формуле:

где V — разность в объемах 0,01 н. раствора йода между опытным и контрольным титрованием (или разность в объемах 0,01 н. раствора натрия тиосульфата между контрольным и опытным титрованием), мл;
К — поправка 0,01 н. раствора натрия тиосульфата;
Э — величина эквивалента 1 мл 0,01 н. раствора йода в граммах стандартного образца натриевой соли бензилпенициллина или в граммах стандартного образца феноксиметилпенициллина (с пересчетом на химически чистое вещество);
С — коэффициент пересчета стандартного образца натриевой соли бензилпенициллина на исследуемый пенициллин, указанный в соответствующей статье;
а — навеска препарата, г.
Методом УФ-спектрофотометрии
по аналогтт с феноксиметилпенициллином
Феноксиметилпенициллин
определяют методом УФ-спектро-фотометрии
в 5% растворе гидрокарбоната натрия
при длине волны 268 нм.
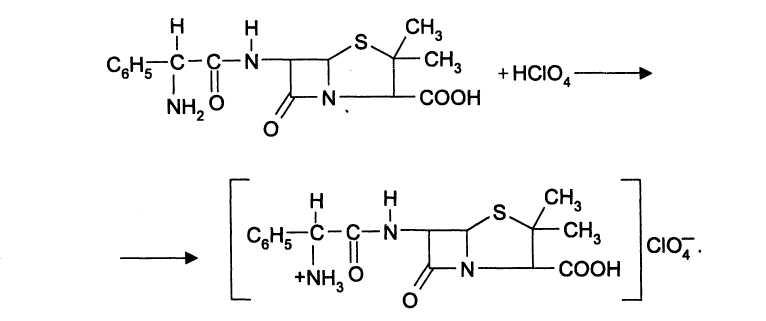
Ампициллин определяют методом кислотно-основного титрования в неводной среде по основному центру — алифатической аминогруппе. Препарат растворяют в ледяной уксусной кислоте и титруют хлорной кислотой:
По Европейской фармакопее пенициллины определяют методом жидкостной хроматографии.
