
ДЛЯ ГОСОВ / Ответы для комиссии на экз билеты / Билет 21 Аскорбиновая к-та
.doc
ГОУВПО ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Медицинский институт
Специальность «Фармация»
Итоговый междисциплинарный экзамен
Экзаменационный билет №21
Задача 64
1. Комплекс испытаний, применяемых для оценки качества кислоты аскорбиновой в виде 5% раствора для инъекций, а также лекарственных форм внутриаптечного изготовления предусматривает применение в качестве реагентов соединений йода (растворы йода и калия йодата). В соответствии с химической структурой лекарственного средства дайте обоснование выбору и использованию данных реагентов в аналитическом контроле кислоты аскорбиновой:
-
Исходя их химического строения и свойств кислоты аскорбиновой, объясните способность ее реагировать с раствором йода и калия йодата.
-
Предложите другие реакции для идентификации лекарственного препарата и укажите степень их специфичности.
-
Рассмотрите применение 0,1М раствора йода в количественном определении кислоты аскорбиновой на примере лекарственной прописи состава:
Кислоты аскорбиновой 0,1
Глюкоза 0,3
-
Предложите способ количественного определения кислоты никотиновой с учетом присутствия в смеси второго компонента.
-
Укажите значение молярной массы эквивалента для обоих веществ и формулы для расчета их содержания.
-
Объясните сущность йодатометрического титрования кислоты аскорбиновой в растворе для инъекций и необходимость применения при этом раствора формальдегида. Как отразится на результате анализа его отсутствие? Укажите значение молярной массы эквивалента.
2. Охарактеризуйте стабильность кислоты аскорбиновой в водном растворе.
-
Назовите вещества, входящие в состав инъекционного раствора и обоснуйте их роль.
2. КИСЛОТА АСКОРБИНОВАЯ
Кислота аскорбиновая, имеет генетическое родство с моносахаридами, что проявляется в сходстве структурных фрагментов молекул.. Суточная потребность человека в кислоте аскорбиновой выше, чем в других витаминах, и составляет примерно 30 мг.
Физические свойства

Кислота аскорбиновая - Acidum ascorbinicum
Y-Лактон-2,3-дегидро-L-гулоновой кислоты.
Белый кристаллический порошок без запаха, кислого вкуса. Легко растворим в воде.Лекарственные формы: порошок, таблетки, драже, раствор для инъекций. Витаминное средство
ГФ требует определить угол вращения (а) 2% раствора и рассчитать удельное вращение по формуле:
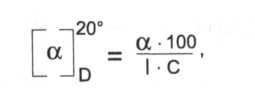
где С — концентрация раствора;
1 — длина трубки поляриметра = 1 дм.
Из-за нестойкости препарата при нагревании для определения Т^ его предварительно сушат при температуре 60 °С в течение 2 ч. Скорость подъёма температуры — 5° в 1 мин (по той же причине).
Препарат поглощает свет в УФ-области спектра, что также используется при анализе подлинности.
Химические свойства и анализ подлинности
Кислотные свойства. Аскорбиновая кислота является Y-лактоном, содержащим 2 спиртовых гидроксила в 5-м и 6-м положениях и 2 енольных гидроксила во 2-м и 3-м положении. Енольные гидроксилы обладают кислотными свойствами, дают кислую реакцию на лакмус, взаимодействуют и с NaOH и NaHCO3. Кислотные свойства более выражены у гидроксила в 3-м положении:

На наличии кислотных свойств основана реакция образования аскорбината железа. Реактив - железа (II) сульфат, не обладающий свойствами окислителя:

Следует иметь в виду, что аскорбиновая кислота является лакто-ном и при действии сильных щелочей лактонное кольцо гидроли-зуется, а затем образуется фурфурол:

FeCl3, реактив Фелинга и др.) окисляют кислоту аскорбиновую до кислоты дикетоаскорбиновой.
Для определения подлинности препарата обычно используют в качестве окислителей растворы 2,6-дихлорфенолиндофенолята натрия и серебра нитрата. При взаимодействии кислоты аскорбиновой с амиачным раствором серебра нитрата выпадает темный осадок металлического серебра:

Синее окрашивание 2,6-дихлорфенолиндофенолята натрия исчезает от действия на реактив кислотой аскорбиновой:
ONa
ONa

Методы количественного определения Алкалиметрия
ONaОН
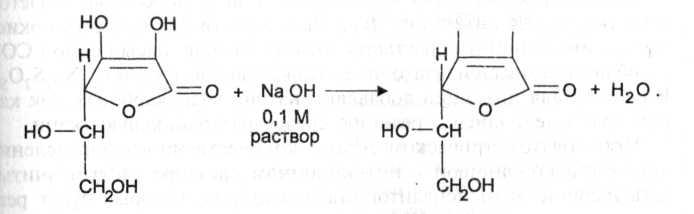
Выраженные восстановительные свойства кислоты аскорбиновой лежат в основе нескольких методик количественного определения данного лекарственного вещества (йодатометрия, йодомет-рия, йодхлорметрия).
Йодатометрия

Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования: кю3 + 5 KI + 6 HCl = з I2 + 6KCl + з н2о.
Йодометрия
Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой. кю3 + 5 KI + 6 HCl = з I2 + 6KCl + з н2о.
Йодометрия
Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой
Возможны и другие методики, например титрование натрия 2,6-хлорфенолиндофенолятом.ислота аскорбиновая используется в виде порошков, таблеток и растворов для инъекций. Поскольку в растворах она легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (Na2SO3, Na2S2O5). В раствор для инъекций добавляют натрия гидрокарбонат, так как препарат имеет кислую реакцию среды, раздражающую ткани.
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом - КЮ3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты:

Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.
Лекарственная форма
Кислоты аскорбиновой 0,1 Глюкозы 0,3
2.1. Установить подлинность лекарственных препаратов, содер жащихся в лекарственной форме. 2.1.А. Кислота аскорбиновая.
Обнаруживают, как указано в 1.1.А и 1.1.Б.
2.1.Б. Глюкоза. Для обнаружения глюкозы предварительно окисляют аскорбиновую кислоту (как более сильный по сравнению с глюкозой восстановитель). С этой целью 0,05—0,1 г лекарственной формы растворяют в 1—2 мл воды, прибавляют 2—3 капли пергидроля, 2—3 капли аммиака и кипятят в течение 3 мин. После охлаждения добавляют реактив Фелинга и снова нагревают. Образуется кирпично-красный осадок.
2.2. Выполнить количественное определение. 2.2.А. Кислота аскорбиновая. Растворяют 0,1 г лекарственной формы в 5 мл воды в колбе с притертой пробкой и титруют 0,1 н. раствором иода до слабо-желтого окрашивания.
1 мл 0,1 н. раствора иода соответствует 0,0088 г кислоты аскорбиновой.
2.2.Б. Глюкоза. К оттитрованной (см. 2.2.А) жидкости прибавляют 20 мл 0,1 н. раствора иода, 10—15 мл 1%-ного раствора гидроксида натрия и оставляют на 10—15 мин. Затем к раствору добавляют 10 мл разведенной серной кислоты и титруют 0,1 н. раствором тиосульфата натрия в присутствии крахмала.
1 мл 0,1 н. раствора иода соответствует 0,0099 г глюкозы.
Содержание глюкозы (х) в ЛФ рассчитывают по формуле

где 20 мл — объем 0,1 н. раствора иода, взятый на титрование глюкозы; Vi — объем 0,1 н. раствора тиосульфата натрия, пошедший на титрование избытка 0,1 н. раствора иода; V—объем 0,1 н, раствора иода, затраченный на дальнейшее окисление дегидроаскорбиновой кислоты (такой же, как и в первом титровании);
, %.0,0099 — титр по глюкозе; 0,4 г — общая масса лекарственной формы; т — навеска, взятая на титрование, г.
2.3. Выполнить титриметрическое и рефрактометрическое определение кислоты аскорбиновой и глюкозы в лекарственной форме. 2.З.А. Кислота аскорбиновая. Для титриметрического определения кислоты аскорбиновой массу одного порошка растворяют в 5 мл воды; 2 мл полученного раствора титруют 0,1 н. раствором гидроксида натрия или иода (титр 0,1 н. раствора гидроксида натрия по аскорбиновой кислоте — 0,0176 г, а титр 0,1 н. раствора иода — 0,0088 г). Содержание кислоты аскорбиновой {х\) в 5 мл рассчи тывают по формуле
![]()
![]()
где пх — показатель преломления раствора лекарственной формы; п0 — показатель преломления растворителя; т — масса лекарственной формы, г; 0,00142 — фактор показателя преломления безводной глюкозы; Х\ — содержание аскорбиновой кислоты, г; F — фактор показателя преломления кислоты аскорбиновой, соответствующий найденной концентрации; В — содержание влаги в глюкозе
Bp: Acidi ascorbinici 0,1 Glucosi 0,3
M.f.p. D.td. M30 S. По I nop. З раза в день
Качественный анализ.
Кислота аскорбиновая. 0,01 лекарственной формы растворить в 2 мл воды, прибавить 2 капли раствора серебра нитрата. Отметить эффект реакции.
Глюкоза (в присутствии кислоты аскорбиновой).
0,05 лекарственной формы растворить в 2 мл воды, прибавить по 2 капли пергидроля и раствора аммиака и прокипятить. После охлаждения добавить реактив Фелинга и снова нагреть. Отметить эффект реакции.
Количественный анализ {первый вариант).
Кислота аскорбиновая,
0,25
лекарственной формы растворить в мерном
цилиндре в 5 мл воды очищенной, перемешать.
К 2 мл раствора прибавить 2 капли
фенолфталеина и титровать раствором
щелочи
с Сэ
0,1 моль/л
Количественный анализ (второй вариант).
Кислота аскорбиновая, О O5 лекарственной формы растворить в 5 мп воды в слянке с притертой пробкой и титровать раствором йода с Сэ 0,1 моль/л до слабо-желтого окрашивания. Пошло
1,41,1,40,1,45=4.26/3
Сумма = 1.42
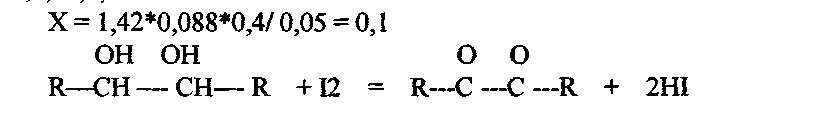

Глюкоза (в присутствии кислоты аскорбиновой).
К оттитрованной жидкости прибавить 10 мл раствора йода с Сэ 0,1 моль/л, 5 мл 1% раствора щелочи и оставить на 15 минут. Далее к раствору прибавить 5 мл разведенной серной кислоты и выделившийся йод оттитровать раствором тиосульфата натрия с Сэ О,1 моль/л. Индикатор - крахмал.На титрование пошло (4,80,4,75,4,84 =14,39 /3 = 4,79) Содержание глюкозы рассчитать по формуле:

где v 1 - ооъем тиосульфата натрия пошедшего на титрование изоыточного количества йода; V - объем йода пошедшего на титрование навески кислоты аскорбиновой; а -навеска порошка, взятая для количественного анализа.
М.м глюкозы = 198,17 г/моль
