
ДЛЯ ГОСОВ / ГОС-фарм-химия-11 / Беляева / сит. задача 22
.docСитуационная задача №22
A cidum
ascorbinicum
cidum
ascorbinicum
Vitaminum C
Кислота аскорбиновая
Витамин С
Ascorbic Acid
Функциональные группы: лактонная группировка, спиртовые гидроксильные группы, енольные гидроксильные группы, два оптически активных атома углерода (хиральные центры).
Подлинность: 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС).
2. УФ-спектр ( max зависит от рН среды: при рН 7 λ=265 nm, при рН 2 – λ=243 nm)
3. Тпл.=190°C-193°C ( с разложением). Из-за нестойкости препарата при нагревании для определения Тпл. его предварительно сушат при температуре 60°C в течение 2 часов. Скорость подъема температуры - 5°C в 1 минуту (по той же причине).
4. Удельное вращение (от +22° до +24°) - 2% водный раствор.
ГФ Х регламентирует в качестве испытания на подлинность следующие реакции:
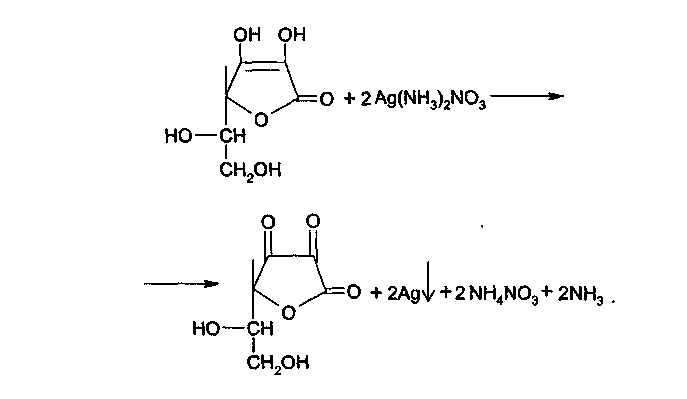 5.
Реакция «Серебряного зеркала»: к раствору
препарата приливают раствор серебра
нитрата, происходит окисление кислоты
аскорбиновой до кислоты дегидроаскорбиновой).
Образуется темный осадок металлического
серебра.
5.
Реакция «Серебряного зеркала»: к раствору
препарата приливают раствор серебра
нитрата, происходит окисление кислоты
аскорбиновой до кислоты дегидроаскорбиновой).
Образуется темный осадок металлического
серебра.
6. Реакция с 2,6-дихлорфенолиндофенолятом. К препарату добавляют указанный реактив, происходит восстановление реагента и синее окрашивание реагента исчезает.

Нефармакопейные реакции:
Аскорбиновая кислота обладает восстановительными свойствами (засчет наличия в структуре молекулы двух енольных гидроксилов). Поэтому препарат вступает в ОВР с окислителями, в том числе с реактивом Фелинга, раствором йода и калием йодатом, которые окисляют кислоту до дикетоаскорбиновой.
7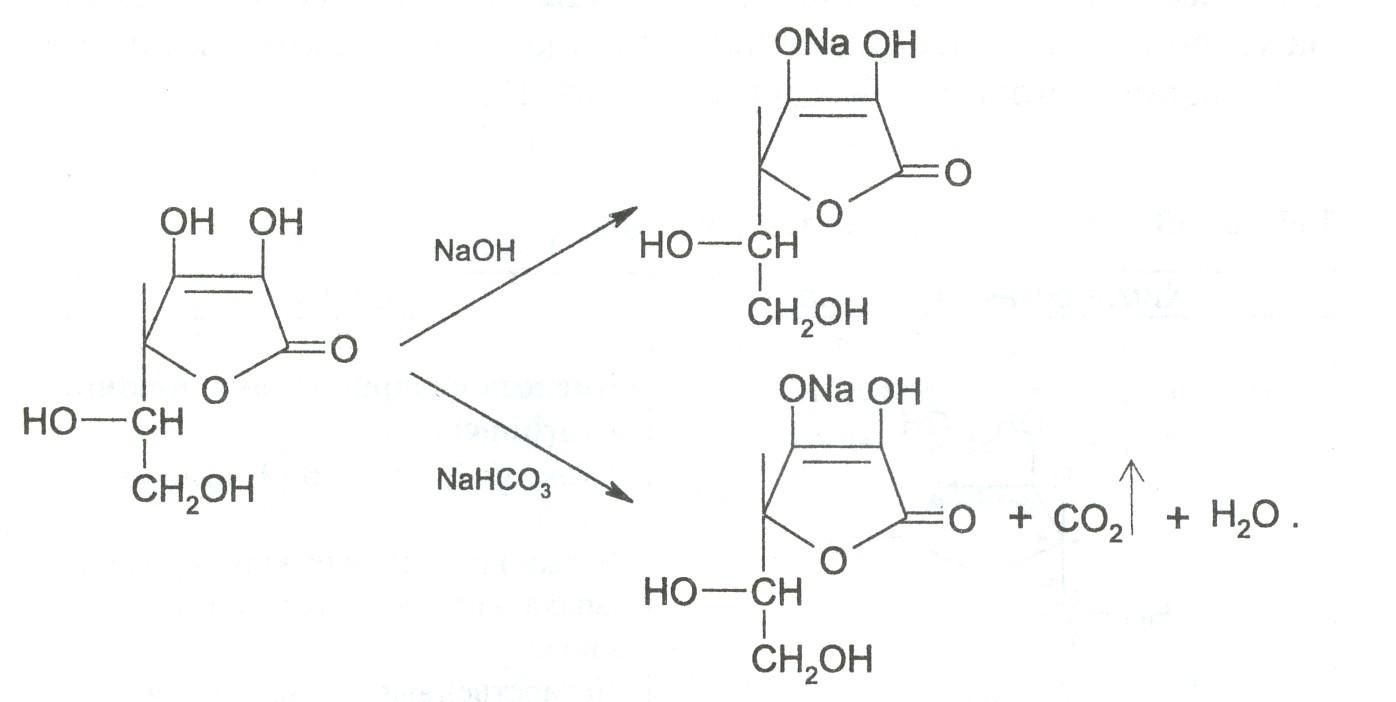 .
Засчет наличия енольных гидроксилов в
молекуле аскорбиновой кислоты препарат
дает кислую реакцию среды на лакмус.
При действии разбавленными растворами
щелочей она ведет себя как одноосновная
кислота. Разрыва лактонного цикла в
этих условиях не происходит, а образуются
нейтральные монощелочные соли.
.
Засчет наличия енольных гидроксилов в
молекуле аскорбиновой кислоты препарат
дает кислую реакцию среды на лакмус.
При действии разбавленными растворами
щелочей она ведет себя как одноосновная
кислота. Разрыва лактонного цикла в
этих условиях не происходит, а образуются
нейтральные монощелочные соли.
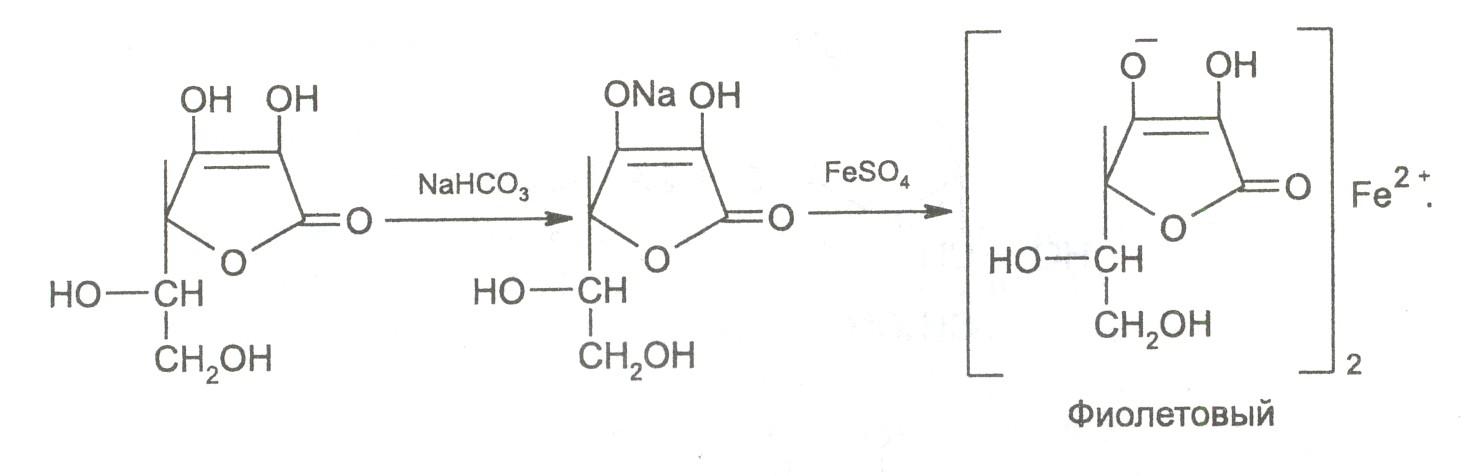
8. Кислотные свойства обуславливают реакцию образования аскорбината железа. Реактив – железа (II) сульфат, не обладающий свойствами окислителя. Происходит реакция солеобразования, наблюдается фиолетовое окрашивание.
9. Взаимодействие с сильными щелочами. Происходит реакция гидролиза лактонного кольца и образование фурфурола.

По ГФХ препарат должен выдерживать испытание на органические примеси, сульфатную золу и тяжелые металлы.
Количественное определение: Йодатометрия (ГФ Х. Вариант прямого титрования)
Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и крахмала 0,1 н. стандартным раствором калия йодата до синего окрашивания:
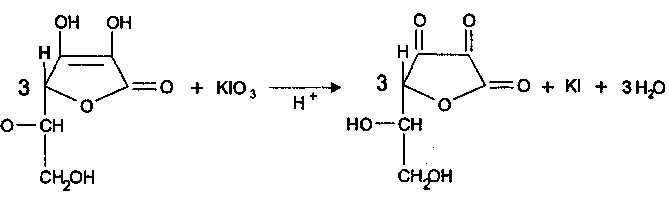
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
![]()
Возможные методы количественного определения аскорбиновой кислоты:
ОВР: йодометрия, индофенольный метод, йодхлорметрия, цериметрия.
Кислотно-основные: алкалиметрия
Физико-химические: спектрофотометрия
Анализ смеси
Rp: Acidi ascorbinici 0,1
Acidi nicotinici 0,05
Sacchari 0,25
Реакция подлинности на кислоту никотиновую (ГФХ)
1. ИК-спектр (в сравнении со стандартом или со спектром в ФС).
2. УФ-спектр
3. Тпл.=234-238°C
4. Реакция разложения кислоты никотиновой путем нагревания с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху:
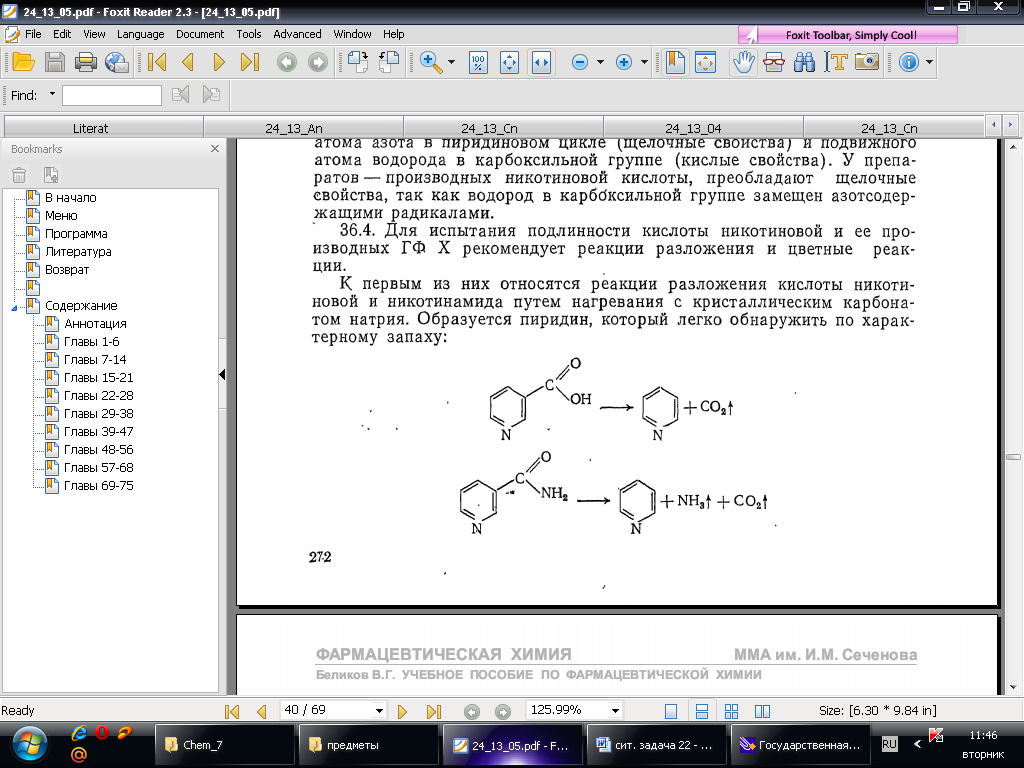
5. Кислота никотиновая ввиду кислых свойств ее растворов обладает способностью образовывать нерастворимые соли (с ионами меди образуется осадок синего цвета – никотинат меди)

Если эту реакцию проводить в присутствии роданида аммония, то образуется тройное комплексное соединение, окрашенное в зеленый цвет.
Если два ингредиента смеси обладают кислотными свойствами, а один из них является восстановителем, возможно их количественное определение в одной навеске.
Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида. При этом значение величины z при расчете молряной массы эквиваленты М (1\z) для каждого вещества равно 1. Таким образом, Мэкв. (к-ты аскорбиновой)=176,13 г/моль, Мэкв.(к-ты никотиновой)=123,11 г/моль.
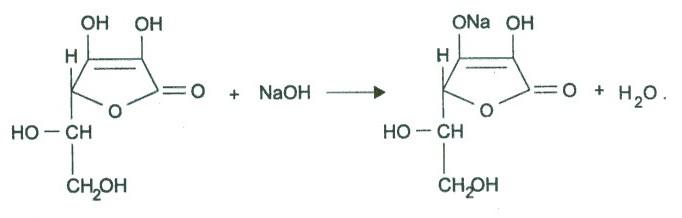
 + NaOH
+ NaOH
 +
H2O
+
H2O
Метод – прямая алкалиметрия, вариант нейтрализации, основан на кислотных свойствах препаратов.
Титрант – 0,1 Н NaOH
Индикатор – фенолфталеин
Затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую.
Метод – прямая йодометрия, основана на окислительно-восстановительных свойствах препарата.
Титрант – 0,1 н раствор йода
Индикатор – крахмал
В точке эквивалентности наблюдается окрашивание раствора за счет взаимодействия избыточной капли йода с крахмалом и образования комплекса синего цвета.
 2С+1
– 2е =2С+2 (f=1/2)
2С+1
– 2е =2С+2 (f=1/2)
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 Н раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 Н раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой.
При титровании кислоты аскорбиновой 0,1 Н раствором йода f=1/2. Мэкв.=88,06 г/моль
Это означает, что на одну и ту же аликвотную долю смеси будет расходоваться 0,1 н раствора йода в два раза больше, чем 0,1 н раствора натрия гидроксида. Поэтому при расчете количества раствора, пошедшего на титрование кислоты никотиновой, из общего объема 0,1 н раствора гидроксида натрия следует вычесть ½ объема 0,1 н раствора йода, ихрасходованного на титрование кислоты аскорбиновой.
![]()

где Х – масса определяемого вещества, г; V - объем титрованного раствора, мл; k – коэффициент поправки на титрованный раствор; P – общая масса порошка по прописи, г;
а – объем, мг, или масса, г, лекарственной формы, отобранный для анализа, k - поправочный коэффициент.
1 мл 0,1 н раствора йода соответствует 0,008806 г кислоты аскорбиновой.

1 мл 0,1 н раствора едкого натра соответствует 0,01231 г к-ты никотиновой.
В растворах аскорбиновая кислота легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (натрия сульфит, натрия метабисульфит). В раствор аскорбиновой кислоты для инъекций добавляют натрия гидрокарбонат для нейтрализации кислой реакции среды, раздражающей ткани.
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты.
Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.

