
ДЛЯ ГОСОВ / ГОС-фарм-химия-11 / Задача № 8 раствор Рингера
.docЗадача № 8
В аптеках городских клинических больниц готовят раствор Рингера следующего состава:
Натрия хлорида 0,9
Калия хлорида 0,02
Кальция хлорида 0,02
Натрия гидрокарбоната 0,02
Воды для инъекций до 100 мл
При проведении реакций идентификации на ион калия была использована фармакопейная реакция с раствором кислоты виннокаменной и натрия ацетата в соответствующих условиях; выпадения белого кристаллического осадка не наблюдалось.
-
Дайте объяснение полученному результату и укажите, какую реакцию идентификации можно предложить для достоверного доказательства иона калия в данном растворе.
-
Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость) и их использование для оценки качества.
-
В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
ОТВЕТ
При обнаружении иона калия в присутствии катиона кальция и магния нельзя использовать реакцию образования осадка с кислотой виннокаменной, т.к. соли кальция (магния) также образуют осадок с реактивом.
Нецелесообразным является открытие катионов кальция и калия при совместном присутствии на пламени горелки из-за наложения цветов, образуемых каждым катионом. Поэтому на калий-ион следует провести реакцию образования двойной соли гексанитрокобальтата (III) калия-натрия с раствором натрия гексанитрокобальтатом (Ш).
Натрия и калия хлориды
Виннокаменная кислота
Винная кислота (Acidum tartaricum)

Винная кислота растворима в 1 части воды (в 0,5 части кипящей воды), 4 частях спирта и малорастворимы в эфире.
1) Раствор кислоты виннокаменной 1 : 3 при прибавлении к нему раствора ацетата калия выделяет белый кристаллический осадок:
НОСНСООН НОСНСООК
| +КООССН3 -> | +-СН3СООН.
НОСНСООН НОСНСООН
Осадок калиевой соли кислоты виннокаменной растворяется в соляной кислоте и растворах едких щелочей:
НОСНСООК НОСНСООН
| +НСl -> | +КС1;
НОСНСООН НОСНСООН
НОСНСООК НОСНСООК
| +NaOH -> | +НОН.
НОСНСООН НOCHCOONa
|
Приведенные реакции позволяют считать, что при добавлении кислоты виннокаменной к указанной ЛФ, должен выпадать осадок кальциевой соли виннокаменной, которую можно только разложить конц. серной кислотой. Образование же осадка калиевой соли виннокаменной, видимо блокируется образованием растворимой в воде смешанной натрий-калиевой средней соли |
Средняя соль винной кислоты растворима в воде.
Натрия и калия хлориды относятся к сильным электролитам. Катионы натрия и калия окрашивают пламя соответственно в желтый и фиолетовый цвет.
Соли натрия с цинка уранилацетатом образуют желтый кристаллический осадок (нерастворимый в кислоте уксусной):

Гексагидроксостибатион в строго нейтральной среде образует с ионами натрия белый кристаллический осадок натрия гексагид-роксостибата:
![]()
Соли калия с раствором гексанитрокобальтата (III) натрия образуют желтый кристаллический осадок гексанитрокобальтата (III) натрия и калия:
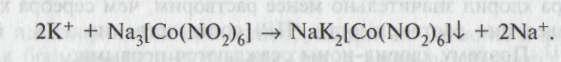
Осадок не растворяется в кислоте уксусной, но растворяется в минеральных кислотах.
В щелочной среде образуется бурый осадок гидроксида кобальта (III).
Проведению реакции мешают ионы аммония, также дающие с реактивом осадок, поэтому для удаления ионов аммония соль калия предварительно прокаливают.
С раствором кислоты винно-каменной соли калия образуют осадок калия гидротартрата, который не растворяется в кислоте уксусной, но растворяется в минеральных кислотах и щелочах:
![]()
Хлориды в данных лекарственных веществах
определяют по взаимодействию с раствором
серебра нитрата;
![]()
Реакцию проводят в присутствии кислоты азотной в качестве вспомогательного реактива, в котором не растворяются галогениды серебра.
Особенность серебра хлорида (в отличие от бромида и йодида) заключается в способности легко растворяться в растворах аммиака, натрия карбоната и натрия тиосульфата:
AgCl + 2NH3 -> [Ag(NH3)2]Cl;
AgCl + (NH4)2C03 4 [Ag(NH3)2]Cl + C02 + H20;
AgCl + 2Na2S203 -4 Na3[Ag(S203)2] + NaCl.
Количественное определение
Натрия и калия хлориды раздельно определить в данной прописи методиками, принятыми в экспресс-анализе, невозможно (кальция хлорид определяют комплексиметрически). Сумму хлоридов натрия и калия рассчитывают по формуле:

Значение СОТ 0,1 н. раствора серебра нитрата для суммы натрия и калия хлоридов рассчитывают следующим образом:

Специфическими примесями для калия и натрия бромида быть ионы йодидов, бария, кальция, броматов. Йодиды удаляют с помощью слабого окислителя, каким является железо хлорид, не окисляющий бромиды:
2Fe3+ + 2I- = 2Fe2+ + I2.
Выделяющийся йод обнаруживают в присутствии крахмала по синему окрашиванию.
Ионы бария, кальция и бромат-ион идентифицируют одним реактивом — концентрированной H2S04. При добавлении реагента к испытуемому раствору не должно, согласно требованиям ГФ появляться помутнения или окрашивания (соли бария и кальция дают нерастворимые сульфаты, а броматы в присутствии 6poма в кислой среде выделяют бром, придающий раствору желтый оттенок
ВrO3- + 5Вг + 6Н+ = Br2 + 3Н2O.
Общий способ количественного определения йодидов по ГФ — прямая аргентометрия с применением адсорбционного индикатора (метод Фаянса).
Сущность метода заключается в том, что адсорбционный индикатор (по ГФ — натрия эозинат) не меняет своего окрашивания (желтовато-красного) до наступления точки эквивалентности.

В точке эквивалентности индикатор адсорбируется на осадке серебра йодида, и цвет осадка становится красно-фиолетовым. Это объясняется тем, что до точки эквивалентности на осадке серебра йодида адсорбируется неоттитрованный йодид-ион (как ион, входящий в состав осадка). Возникающий на поверхности осадка отрицательный заряд препятствует адсорбции на нем индикатора в виде аниона. После того как йодид будет оттитрован полностью, на поверхности осадка будут адсорбироваться ионы серебра (также входящие в состав осадка). При этом на поверхности осадка возникает вызванный ионами серебра положительный заряд, и тогда происходит адсорбция анионов индикатора, вызывающая переход окрашивания осадка. В итоге соединение, находящееся в осадке, примет следующий вид:
Agl • Ag+ • Ind
