
умк_Назин_405-6
.pdfЧтобы избежать ошибок, связанных с отличием n от n∞ (для неполярных веществ n2 ≈ ε, для полярных веществ ε > n2. Например, для воды n2 ≈ 1,75 и ε = 81), все коэффициенты преломления замеряют при одной стандартной длине волны (соответствующей желтой линии натрия в спек-
ο
тре, обозначаемой символом Д, т. е. λД = 5893 A ).
Тогда: |
Rm |
= |
n2 −1 |
|
M |
= |
4 |
πN AαЭ |
, |
(1.5) |
||
n |
2 |
+ 2 |
d |
3 |
||||||||
|
|
|
|
|
|
|
|
|
||||
где n – показатель преломления.
Наряду с молярной рефракцией, иногда используют удельную рефракцию r (см3/г):
r = |
n2 −1 |
|
1 |
. |
(1.6) |
n2 + 2 |
|
||||
|
|
d |
|
||
Удельная рефракция обладает свойством аддитивности, т. е. рефракция смеси равна сумме удельных рефракций составляющих смесь веществ, взятых в процентных (массовых) соотношениях:
rAB · 100 = rA · X + rB (100 – X).
Rm имеет, как видно из уравнения (1.5), размерность объёма и определяет объём всех молекул в моле вещества; практически не зависит от температуры и является величиной аддитивной, т. е. может рассматриваться как сумма рефракций составных частей молекулы (связей или ионов):
|
Rm = ∑Ra + ∑Ri , |
(1.7) |
где ∑Ra |
– сумма рефракций атомов; |
|
∑Ri |
– сумма рефракций инкрементов (поправок). |
|
Аддитивность рефракций широко используется для установления предполагаемого строения молекул (особенно органических) – сначала рассчитывают Rm теоретически по правилу аддитивности для предпола-
гаемой структуры, а затем сравнивают его с найденным экспериментально. Например, если предположить, что диэтилсульфид (C2H5)2S имеет
следующую структуру:
H |
H |
H |
H |
│ |
│ |
│ |
│ |
H ― C ― C ― S ―C ― C ― H. |
|||
│ |
│ |
│ |
│ |
H |
H |
H |
H |
21

По величине рефракций атомов:
RМ = 4RС + 10RH + RS = 9,672 + 11,000 + 7,690 = 28,26.
Экспериментально найденная величина равна 28,54 – структура предложена правильно.
Вобщем случае следует отличать полярность молекулы в целом от полярности содержащихся в ней связей.
Для двухатомных молекул эти понятия совпадают. Двух атомные молекулы, состоящие из одинаковых атомов, будут неполярные и имеют µ = 0,
асостоящие из разных атомов будут в той или иной степени полярны.
Вмногоатомных молекулах полярность молекулы будет зависеть и от относительного расположения отдельных ее связей.
Если нет ни одной полярной связи – молекула неполярна. Одна полярная связь определяет полярность молекулы. Если имеется несколько полярных связей, то полярность молекулы будет определяться их относительным расположением.
Дипольный момент является величиной векторной и будет определяться суммированием дипольных моментов отдельных связей по правилам сложения векторов.
Например, |
µ = (m2X + mY2 + m2Z )1/ 2 , |
где mX , mY , mZ |
– проекции векторов дипольных моментов связей на |
координатные оси.
Правила определения дипольных моментов приведены на рис. 1.1.
– |
+ + |
– |
– – |
– |
О |
С |
О |
О |
|
– |
+ + |
– |
+ |
+ |
S |
C |
S |
H 105° |
H |
|
|
|
|
+ |
µ = 0 |
|
|
|
µ >> 0 |
Рис. 1.1. Дипольный момент линейных и угловых молекул
Молекулы и связи, обладающие несимметричным распределением электрических зарядов, называются полярными и обладают дипольным моментом, отличным от нуля.
Симметричные молекулы (молекулы предельных углеводородов) неполярны и их µ = 0.
Особое место среди полярных веществ занимает вода, как жидкость, обладающая очень высокой полярностью. Например, это является, причиной
22

диссоциации веществ в водных растворах вследствие взаимодействия полярных молекул воды с сильно полярными молекулами электролитов.
Структура молекулы воды может быть представлена в виде тетраэдра, в центре которого находится ядро атома кислорода, а четыре электронных пары образуют электронные облака, вытянутые к вершинам тетраэдра (ещё одна электронная пара образует шаровое электронное облако, расположенное вблизи ядра кислорода, а ядра атомов водорода расположены в двух вершинах тетраэдра).
В результате, у этих вершин обра-
зуется небольшой положительный заряд, |
|
H + |
|
|
|
а у противоположных – отрицательный |
|
|
(рис. 1.2). |
|
|
Следует отметить, что значитель- |
|
|
+ |
|
|
ная полярность молекул воды приводит к |
H |
– |
их объединению (ассоциации) и факти- |
|
|
|
|
|
чески структура воды будет гораздо бо- |
|
|
лее сложной. |
|
|
В большей степени происходит |
|
− |
взаимодействие полярных молекул воды |
|
|
|
Рис. 1.2. Структура |
|
или другого полярного растворителя с ио- |
|
|
|
молекулы воды |
|
нами. В результате, у иона образуется гид- |
|
|
|
|
ратная (сольватная) оболочка. Этот процесс приводит к образованию кристаллогидратов.
Величина дипольного момента, как это уже было видно из вышесказанного, может многое сказать о структуре молекулы. Для веществ, имеющих постоянный диполь, величина поляризации P в уравнении Дебая является
линейной функцией температуры: |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
P = a |
+ |
b |
, |
(1.8) |
||||
|
|
|
|
|
|
T |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
a = |
4 |
πN Aα, |
b = |
4 |
πN A |
µ2 |
. |
|
|
|
|
|
|
3 |
9 |
K |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
Поэтому µ легко определяется из графика зависимости |
P = f |
|
|
||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
(рис. 1.3), по tg β – угла наклона; а по отрезку ОA = a, легко определить α .
23

Соответственно:
µ =1,34988 10−30 b , м · сек · а (Кл · м).
Определить µ можно зная одновре-
βменно величины поляризации и рефракции
A |
|
1 |
|
для одного и того же вещества при одной и |
||||||||||||
|
|
|
|
T |
|
той же температуре. |
|
|
|
|
|
|||||
О |
|
|
|
|
|
|
|
Так как, P = Pэ + Pа + Pор |
и имея в |
|||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
Рис.1.3. График зависимости |
виду, |
что |
Pэ = Rм и Pа |
значительно |
|||||||||||
|
поляризации от величины |
меньше Pор, можно записать: |
|
|
|
|
|
|||||||||
|
обратной температуры |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
P = Rм |
+ Pор или P = Rм |
+ |
4 |
πN |
µ2 |
; |
|||
|
|
|
|
|
|
|
9 |
KT |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
откуда: |
µ = 3 (P − RМ )T |
K |
|
= |
3 K1/ 2π−1/ 2 N −A1/ 2 (P − RM )T . |
|||||||||||
|
|
|||||||||||||||
|
|
2 |
|
|
|
|
|
πNA |
2 |
|
|
|
|
|
||
Подставляя значения всех постоянных величин, получим:
µ =1,34988 10−30 (P − RM )T , м · сек·· а (Кл · м).
1.2.Магнитные свойства атомов и молекул
Взависимости от отношения к внешнему магнитному полю различают парамагнитные и диамагнитные вещества. Парамагнитные вещества, помещенные в магнитное поле, хорошо проводят магнитные силовые линии (лучше, чем вакуум) и поэтому втягиваются полем. Диамагнитные вещества проводят магнитные силовые линии хуже, чем вакуум, и поэтому выталкиваются полем. Такое различие свойств объясняется наличием внутренних магнитных полей, обусловленных магнитными полями электронов.
Если магнитные поля электронов в веществе взаимно замкнуты и компенсируют друг друга, то такое вещество называется диамагнитным. Его атомы или молекулы не имеют собственного магнитного момента.
Если магнитные поля электронов не скомпенсированы, и вещество имеет собственный магнитный момент (т. е. неспаренные электроны), то такое вещество называется парамагнитным.
24
Атом водорода, имеющий один электрон – парамагнитен, а молекула водорода, вкоторойпроизошлакомпенсацияспиновэлектронов– диамагнитна.
Кпарамагнитным веществам относятся: газы – NO, NO2, O2; растворы многих соединений d-элементов, f-элементов и др.; 39K19, 27Al13, 119Sn50, 195Pt78.
Кдиамагнитным – газообразные: H2, N2, Ar, Hl, CO2; жидкие: вода,
бензол, спирты; твёрдые: KCl, NaCl, алмаз, графит, сера, фосфор, висмут. Способность парамагнитных веществ избирательно поглощать энергию электромагнитных колебаний, частоты которых лежат за пределами инфракрасной области, давая спектр электронного парамагнитного резонанса (ЭПР) используется в методе определения структуры и свойств веществ, носящем то же название. Такими частотами обладают радиоволны
длиной от 1 до 500 см.
Рассмотрим этот метод подробнее.
Электрон при вращении вокруг ядра создаёт магнитное поле с магнитным моментом P , равным сумме спинового Pms и орбитального Pm :
|
|
|
|
P = Pms + Pm , |
|
|
|
|
|
причем: |
P |
= |
eh |
m |
(m +1) ; |
P |
= |
eh |
l(l +1) , |
|
|
||||||||
|
ms |
|
4πmЭc |
S |
S |
m |
|
4πmЭc |
|
|
|
|
|
|
|
|
|
||
где с – скорость света;
mS и l – спиновое и орбитальное квантовое число.
Общий магнитный момент, создаваемый всеми электронами в атоме определяется, как векторная сумма магнитных спиновых и орбитальных моментов электронов:
P = |
eh |
g J (J +1) , |
(1.9) |
|
4πm с |
||||
|
|
|
||
|
Э |
|
|
где J – векторнаясуммаполныхспиновогоиорбитальногоквантовыхчисел; g – фактор спектроскопического расщепления (выражает отношение магнитного момента к механическому: когда µ является только орбиталь-
ным – равен 1; когда µ является только спиновым – равен 2). Постоянный сомножитель в уравнении (1.9):
eh |
= µ0 =9,2741 10−24 А · м2, |
|
4πmЭc |
||
|
называется магнетоном Бора и является единицей измерения атомного магнетизма.
25

При J ≠ 0, µ ≠ 0 вещество является парамагнитным. Следует отметить, что магнитный момент парамагнитных частиц имеет определенное направление в пространстве. В обычных условиях направления беспорядочны и в магнитном поле ориентированы относительно силовых линий. Число возможных ориентаций ограничено квантовыми условиями и равно
2J + 1 (рис. 1.4., 1.5).
N |
S |
Рис. 1.4. Расположение атомов парамагнетика в поле постоянного магнита
Рис.
1.5.Направление магнитного момента
иквантованные уровни энергии
Таким же образом квантуется и запас энергии парамагнитной части-
цы для каждого состояния ориентации. |
|
||||
В простейшем случае |
|
± |
1 |
|
, т. е. направление магнитного мо- |
J =1 |
2 |
|
|||
|
|
|
|
|
|
мента парамагнитной частицы может или совпадать с вектором напряжен-
ности магнитного поля (положение 1 на рис. 1.5) – J =1− 12 или не совпа-
дать (положение 2 на рис. 1.5) – J =1+ 12 .
В состоянии 1 энергия частиц наименьшая, поэтому оно наиболее энергетически выгодно, и в этом состоянии находится наибольшее число частиц. Для перехода от 1-го магнитного состояния ко 2-му (т. е. для переориентации частиц) нужно приложить энергию, равную:
E2 − E1 = |
3 |
µ0gH − |
1 |
µ0gH =µ0gH , |
(1.10) |
|
2 |
|
2 |
|
|
для подобных переходов разность значений J может быть только ∆ J = ± 1. Поглощение энергии излучения, затрачиваемое на возбуждение переходов между магнитными уровнями энергии, впервые было обнаружено
Е.К. Завойским в 1944 г.
26

Схема прибора для регистрации этого явления приведена на рис. 1.6.
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Генератор |
|
Резонатор |
|
|
|
|
|
Регистратор |
||
Волновод |
|
|
Детектор |
|
|
||||||
|
радиоволн |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S
Рис. 1.6. Схема прибора для регистрации ЭПР
В этом приборе генерируются радиоволны постоянной частоты, а напряженность магнитного поля постепенно повышается.
При некоторой определённой напряженности магнитного поля H,
соответствующей условию ν = µ0hgH , наблюдается резкое (резонансное)
поглощение радиоволн. Это явление и называется ЭПР.
Кривые для этого процесса записываются в координатах I – H и выглядят так, как изображены на рис. 1.7., 1.8 (I – интенсивность поглощения энергии радиоизлучения, Н – напряженность магнитного поля).
I I
|
H |
|
H |
|
|
|
|
Рис. 1.7. Кривая ЭПР |
Рис. 1.8. Кривая ЭПР |
||
для хромовоцезиевых квасцов |
для ионов Cr3+ |
||
CrCs(SO4)2 · 12H2O |
в кристалле рубина |
||
Исследование спектров ЭПР позволяет определить распределение спиновой и общей плотности заряда по атомному остову молекулы, степень ковалентности связей, дипольные моменты, энергии молекулярных орбиталей и другие важные характеристики молекул.
27
Например, если предположить, что в молекуле K3[Fe(CN)6] сохраняется структура свободного иона Fe+3,
4p
4s
3d
то в спектре ЭПР этого соединения должны обнаруживаться пять линий. В действительности обнаруживается одна.
Тогда электронная структура валентных оболочек иона железа здесь должна быть следующей:
4р
4s
3d
т. е. шесть групп CN образуют с атомами железа донорно-акцепторную связь. Высокая чувствительность ЭПР к примесям парамагнитных веществ (до 10-12 моль/л) используется и в исследовании фотохимических, биологи-
ческих и других процессах.
Ядерный магнитный резонанс (ЯМР).
Открыт в 1946 г. Блохом и Парселлом и заключается в избирательном поглощении радиоволн магнитными ядрами, помещёнными в магнитное поле.
Теория этого явления и устройства для его регистрации весьма сходны с методом ЭПР. Разница заключается в природе магнетизма.
Ядра атомов состоят из нуклонов (нейтронов и протонов). Нуклоны
(как и электроны) характеризуются спиновым квантовым числом i = + 12
или i = −12 .
Общее спиновое квантовое число ядра равно сумме спиновых чисел нуклонов. При нечётном числе нуклонов (C13, F19, H1, P31) суммарный спин
ядра равен 12 , т. е. он некомпенсирован.
Такие ядра ведут себя как вращающиеся заряжённые тела с соответствующим магнитным моментом µ ≠ 0 .
Ядра с чётным числом нуклонов (C12, O16, S32 и др.) ведут себя как неподвижные тела со сферически симметричным расположением заряда. Их ядерный спин и соответствующий магнитный момент равны нулю.
Немагнитные ядра не поглощают радиочастотного излучения.
28
При помещении веществ, содержащих магнитные ядра, в магнитное поле, энергетические уровни расщепляются. Разница в энергиях соседних уровней зависит от свойств ядра, (что учитывается гиромагнитным коэф-
фициентом γ = µP , где µ – магнитный момент ядра, а P – механический
момент количества движения ядра, g – аналогично для электронов) и от напряженности магнитного поля.
Условию резонансного поглощения соответствует соотношение:
ν = |
µNγH |
, |
(1.11) |
|
h |
||||
|
|
|
где µN = 0,50509 · 10-26 А · м2 – ядерный магнетон, единица измерения
ядерного магнитного момента.
Величина ядерного магнетона ~ в 2000 раз меньше магнетона Бора, поэтому поглощаемая частота имеет порядок 40 – 100 мг Гц, т. е. соответствует метровому диапазону волн (в ЭПР используются сантиметровые волны).
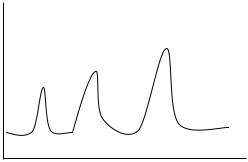
Характер спектров ЯМР определяется особенностями строения молекул. Положение каждой линии в спектре соответствует атомам с различными магнитными моментами ядер, а I
интенсивность линий (ширина и высота) зависит от количества этих атомов в молекуле (рис. 1.9).
Для изучения структуры соединений большое значение имеет исследование изменений спектров, вызванных влиянием внутренних полей и
проявляющихся в смещении и расщеп- |
H |
|
Рис. 1.9. Спектр ЯМР |
||
лении линий. |
||
этанола |
||
Резонансные линии ядер могут |
||
|
заметно смещаться в зависимости от расположения данного ядра в молекуле («химический сдвиг»). Это вызывается различным экранированием ядра валентными электронами соседних атомов, в результате чего вокруг ядра возникает местное магнитное поле с напряжением HО, отличающейся от напряжения H внешнего магнитного поля.
Соответственно, резонансное поглощение энергии происходит при другой частоте колебаний:
ν' ' = µN γH0 . h
29

Например, вследствие химического сдвига изомеры бутилового спирта имеют разные пики для атомов водорода в группах CH3, CH2, и OH. Особенно резко это заметно на смещении линий OH-группы, а группа CH2 в спектре третичного спирта совсем пропа-
Рис. 1.10. Спектры ЯМР алифатических спиртов дает (рис. 1.10).
Помимо этого явления может наблюдаться так называемое спинспиновое расщепление линий спектра ЯМР, которое вызывается магнитным взаимодействием ядер. Например, структура I в результате взаимодействия двух одиночных протонов 1 и 2 дает два дублета, а структура II в результате взаимодействия двух соседних и одного одиночного протонов 1, 2 и 3 вызывает триплетное расщеп-
Рис. 1.11. Спин-спиновое расщепление |
ление линий (рис. 1.11). |
спектра ЯМР (схема) |
Метод ЯМР дает возмож- |
|
ность обнаруживать и еще более тонкие детали в строении молекул (например, разницу в пространственном расположении атомов в молекуле).
1.3.Молекулярные спектры. Инфракрасные ИК-спектры, спектры комбинационного рассеяния КРС и электронные спектры
Особенности движения в изолированных атомах и в молекулах выражаются в структуре их спектров. Для атомов характерны линейчатые спектры с небольшим числом отдельных, чётко отграниченных друг от друга линий с определённым положением (частотой) и яркостью. Атомные спектры испускания возникают вследствие перехода электронов с возбуждённых уровней энергии на основной, причём частота излучаемого кванта света будет:
|
E |
− E |
|
1 |
|
1 |
|
|
|
ν = |
возб |
осн |
= R |
|
− |
|
|
, |
(1.12) |
|
h |
|
b2 |
||||||
|
|
a2 |
|
|
|
|
|||
где a и b – целые числа,
30
