
умк_Галушков_Неорган химия_для ХТ
.pdf
Всостав групп в ПСМ входят s- и d-элементы или p- и d-элементы. Причем s- и p-элементы образуют главные подгруппы (группы А), а d-элементы – побочные подгруппы (группы В). Так как в атомах d-элементов происходит заполнение (n – 1)d- орбиталей, их свойства существенно отли- чаются от свойств элементов главных подгрупп. В главных подгруппах (группах А) атомный радиус сверху вниз существенно увеличивается, что приводит к уменьшению энергии ионизации. В побочных подгруппах сверху вниз атомный радиус заметно увеличивается при переходе от эле- ментов 4-го к элементам 5-го периода, а при переходе от элементов 5-го периода к элементам 6-го периода он практически не изменяется (за ис- ключением d-элементов IIIB группы).
Это является следствием проявления эффектов d- и f-сжатия. Первая энергия ионизации в побочных подгруппах сверху вниз увеличивается, не- смотря на увеличение атомного радиуса. Это связано с проявлением эф- фекта проникновения ns-электронов под экран 3d10 у элементов 4-го пе- риода и двойной экран 5d10 и 4f14 у элементов 6-го периода.
Вгруппах сверху вниз энергетическое различие ns- и np-орбиталей в общем возрастает (см. табл. 1), но при этом энергетическое различие (n – 1)d и ns-орбиталей уменьшается. Вот почему в главных подгруппах сверху вниз характерная положительная степень окисления уменьшается, а в побоч-
ных, наоборот, возрастает. Например, если сравнить Es − p для углерода и
свинца (рис. 4), то становится понятно, почему для углерода характерна степень окисления +4, а для свинца +2. У свинца 6s2-электроны связаны с ядром значительно сильнее, чем 6p2-электроны из-за значительного энер- гетического различия 6s- и 6p-орбиталей, поэтому удаление двух электро- нов с 6p-орбиталей энергетически более выгодно, чем удаление четырех.
E |
E 6p |
2p |
E '' |
|
|
E ' |
s-p |
s-p |
|
2s |
6s |
а) Еs/− p = 5,3 эВ |
б) Еs//− p = 9 эВ |
Рис. 4. Энергетическое различие |
Es − p внешних s- и p-орбиталей |
атомов углерода (а) и свинца (б)
11
Вот почему соединения Pb(IV) достаточно сильные окислители, а соединения C(IV) такими свойствами не обладают. В побочных подгруп- пах валентные электроны находятся на (n – 1)d- и ns-орбиталях. Вследст- вие уменьшения энергетического различия (n – 1)d- и ns-орбиталей сверху вниз характерная положительная степень окисления в побочных подгруп- пах повышается. Таким образом, сверху вниз в главных подгруппах харак- терная положительная степень окисления понижается, а в побочных под- группах, наоборот, повышается.
В пределах главных подгрупп проявляется вторичная периодич- ность. Это явление можно продемонстрировать на примере изменения суммарной энергии ионизации в группе IVA (рис. 5).
эВ160 |
С |
|
|
|
||
, |
|
|
|
|
||
140 |
|
|
|
|
||
ионизации |
|
|
|
|
|
|
120 |
|
Ge |
|
|
||
энергия |
|
|
|
|
||
|
|
|
|
Pb |
||
100 |
|
|
|
|||
Si |
|
|
|
|||
Суммарная |
|
|
|
|
||
|
|
|
Sn |
|
||
80 |
|
|
|
|
||
0 |
20 |
40 |
60 |
80 |
||
|
||||||
|
|
|
|
порядковый номер элемента, Z |
||
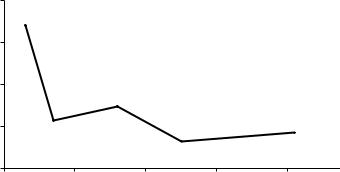
Рис. 5. Зависимость суммарной энергии ионизации (EИ1 + ЕИ2 + ЕИ3 + ЕИ4) от порядкового номера (Z) элементов главной подгруппы IV группы
Немонотонность в |
изменении энергии ионизации в ряду |
C − Si − Ge − Sn − Pb можно |
объяснить, используя понятие об эффекте |
проникновения внешних электронов под экран 3d10 у Ge и двойной экран 4f14 и 5d10 – у свинца. Это приводит к повышению ∑(EИ )i у Ge и Pb .
При рассмотрении характера изменения свойств химических элемен- тов и их соединений в группах и подгруппах очень полезным является ис- пользование понятий о групповых, типовых и электронных аналогах.
В группы ПСМ объединяются элементы с одинаковым общим числом электронов на достраивающихся оболочках независимо от их типа. Подобное объединение позволяет выделить наиболее общий вид аналогии, который на- зывается групповой аналогией и проявляется только в высшей степени окис- ления, отвечающей номеру группы. Именно по этому признаку главные и побочные подгруппы (группы А и В) объединяются в одну группу.
Групповая аналогия не отражает всех особенностей химических эле- ментов, входящих в данную группу, так как при этом учитывается только
12
один признак – общее число валентных электронов и не учитывается тип валентных орбиталей. Эта аналогия пропадает для элементов в низших степенях окисления, тем более в свободном состоянии. Однако в пределах каждой группы можно выделить элементы, обладающие более глубоким сходством между собой, которое проявляется и в высшей, и во всех про- межуточных степенях окисления. Это сходство обусловлено не только одинаковым числом валентных электронов, но и одинаковым типом орби- талей, на которых эти электроны находятся. По этому признаку группы де- лят на подгруппы – главную и побочную в обычной ПСМ или вводят два типа групп (А и В) в полудлинной 18-клеточной ПСМ и длиннопериодной 32-клеточной ПСМ. По составу элементов главные подгруппы совпадают с группами серии А, а побочные – с группами серии В.
Таким образом, элементы, принадлежащие одной подгруппе, явля- ются типовыми аналогами. Например, элементы C − Si − Ge − Sn − Pb об- разуют главную подгруппу IV группы (или IVA группу) и являются типо- выми аналогами, т.к. имеют одинаковый тип валентных орбиталей – ns 2np2. Элементы Ti, Zr, Hf образуют побочную подгруппу IV группы (или IVВ
группу) и также являются типовыми аналогами, т.к. имеют одинаковый тип валентных орбиталей – (n – 1)d 2ns2.
Типовая аналогия характеризует более глубокое сходство между эле- ментами по сравнению с групповой, что проявляется в закономерностях из- менения свойств как самих элементов, так и их соединений. Однако и этот тип аналогии не полностью охватывает все особенности физико-химической природы отдельных элементов и их взаимосвязь с соседями по группе.
Если внимательно рассмотреть электронное строение атомов эле- ментов главных подгрупп, то обнаруживаются следующие особенности:
1) у s-элементов 2-го – 7- го периодов под валентной электронной оболочкой находится атомный остов предыдущего благородного газа; 2) у p-элементов 2-го и 3-го периодов, как и у s-элементов, под валентной оболочкой находится атомный остов благородного газа; 3) у p-элементов 4-го – 7- го периодов валентным nsnp-оболочкам предшествуют заполнен- ные (n – 1)d- орбитали сверх оболочки предыдущего благородного газа; 4) у d-элементов 4-го и 5-го периодов валентным (n – 1)d- и ns-орбиталям предшествует атомный остов благородного газа, а у d-элементов 6-го периода – заполненные полностью (n – 2)f- орбитали сверх атомного остова благородного газа. Но поскольку 4f14-орбитали рас- полагаются глубоко, они не оказывают заметного влияния на свойства этих элементов.
13
Выявленные особенности электронного строения атомов позволяют ввести понятие о полной и неполной электронной аналогии.
Полными электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и объясняется близкое подобие их химических свойств.
Неполными электронными аналогами называются элементы, кото- рые не имеют полной аналогии в свойствах в высшей степени окисления, но в промежуточных положительных, а также в отрицательных степенях окисления у них наблюдается полная электронная аналогия.
Элементы побочных подгрупп являются полными электронными аналогами, а в высшей степени окисления у них появляется электронная аналогия с элементами 2-го и 3-го периодов этой же группы, т.к. в высшей степени окисления у атомов этих элементов «обнажается» электронная
+6
оболочка предыдущего благородного газа. Например, у [S ] − [Ne], а у
+6
[Cr] − [ Ar] .
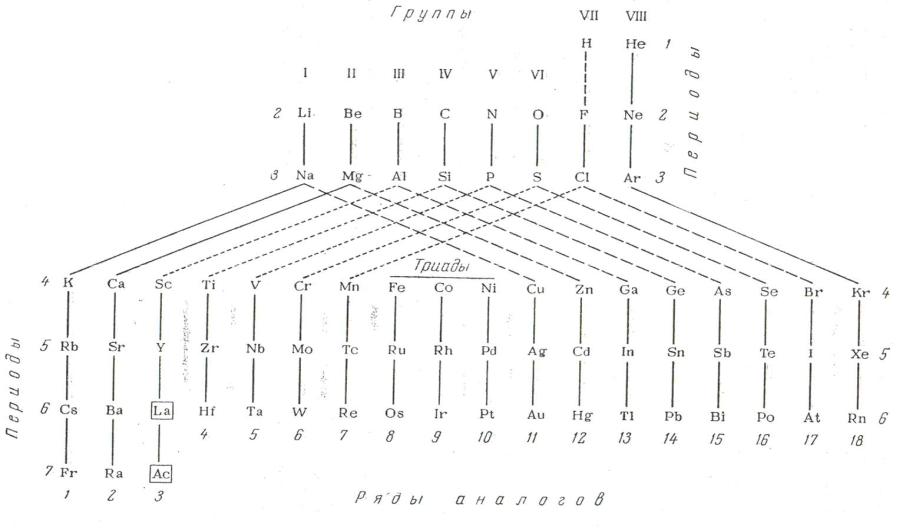
Используя понятие об электронной аналогии, Б.В. Некрасов перио- дическую систему Д.И. Менделеева изобразил в виде схемы (рис. 6). На схеме сплошной линией показана полная электронная аналогия, крупной штриховой линией – неполная аналогия, а мелкой штриховой линией – аналогия только в высшей степени окисления.
Элементы малых периодов (2-го и 3-го) проявляют электронную аналогию как с элементами главных подгрупп, так и с представителями побочных подгрупп и, следовательно, определяют облик группы в целом. Поэтому элементы малых периодов называют типическими.
Однако типические элементы данной группы также имеют заметное различие в свойствах. Своеобразие типических элементов первого ряда (2-й период) заключается в том, что у них p-орбитали появляются впервые. Функция радиального распределения электронной плотности для этих орби- талей имеет один максимум. Орбитали, которые появляются впервые в ато- ме, называются кайносимметричными. К таким орбиталям относятся 1s, 2p, 3d, 4f и т.д. Для всех таких орбиталей характерно наличие единственного максимума на кривой радиального распределения электронной плотности. Электроны, находящиеся на кайносимметричных орбиталях, сильнее связаны с ядром за счет существенного ослабления эффекта экранирования. Это при- водит к уменьшению радиуса и увеличению энергии ионизации, а, следова- тельно, к ослаблению металлических свойств у таких элементов.
14
15
Рис. 6. Схема периодической системы Д.И. Менделеева
15
Таким образом, учитывая особенности электронного строения ато- мов химических элементов, рассмотрение их свойств в процессе изучения неорганической химии будет производиться в следующей последователь- ности: элементы главных подгрупп, элементы побочных подгрупп, ланта- ноиды, актиноиды. В свою очередь при изучении свойств элементов глав- ных подгрупп также будет выстроена определенная последовательность: первый типический элемент, второй типический элемент, остальные эле- менты подгруппы.
При изучении неорганической химии необходимо строго различать понятия химического элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Справедливость такого разделения понятий подтверждается, например, фактом существования одного и того же химического элемента в виде не- скольких простых веществ – аллотропных модификаций.
При образовании простых веществ из элементов возникают объекты, характеризующиеся качественно иным набором свойств, чем изолирован- ные атомы. Даже в тех случаях, когда в результате взаимодействия атомов образуются газообразные молекулы, их свойства существенно иные. На- пример, все газы в атомарном состоянии существенно более активны хи- мически, чем их молекулы. Это обусловлено необходимостью разрыва свя- зей между атомами в молекуле. Чем прочнее молекула, тем ниже химиче- ская активность простого вещества. Еще резче качественное отличие про- стого вещества от соответствующего химического элемента при образова- нии конденсированной фазы с немолекулярной структурой. Конденсиро- ванное состояние характеризуется свойствами, которые принципиально неприменимы к атомам, например, твердость, температура плавления (для кристаллов), вязкость, температура кипения (для жидкостей), электриче- ская проводимость и т.д.
Изучение свойств простых веществ имеет очень важное значение в неорганической химии, так как позволяет составить общее представление о химическом облике элемента, предвидеть природу химической связи, со- став и свойства его соединений, их кислотно-основные и окислительно- восстановительные характеристики и т.д. При рассмотрении свойств про- стых веществ необходимо учитывать явление аллотропии и их степень чистоты, т.к. даже ничтожное содержание примесей коренным образом меняет физические и химические свойства вещества.
16

Все простые вещества можно разделить на две категории: металлы и неметаллы. Эта классификация основана на существенно различном харак- тере физических и химических свойств веществ, принадлежащих к разным классам. В металлах между атомами реализуется металлическая связь, а у неметаллов – ковалентная. Но так как резкой границы между металлами и неметаллами в ПСМ не существует, то необходимо исходить из преоблада- ния определенного типа связи. Преобладание вклада металлической связи приводит к металлическим свойствам простого вещества, а неметаллические свойства обусловлены преимущественно ковалентным взаимодействием.
Учитывая, что d- и f-элементы образуют простые вещества металли- ческого типа, С.А. Щукарев предложил следующую схему областей для s- и p-элементов, образующих металлические и неметаллические простые вещества:
IA |
IIA |
|
IIA |
|
IVA |
VA |
|
VIA |
|
|
VIIA |
|
VIIIA |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(H) |
|
|
He |
Li |
Be |
|
B |
|
C |
N |
|
O |
|
|
F |
|
Ne |
|
Na |
Mg |
|
Al |
|
Si |
P |
|
S |
|
|
Cl |
|
Ar |
|
K |
Ca |
|
Ga |
|
Ge |
As |
|
Se |
|
|
Br |
|
Kr |
|
Rb |
Sr |
|
In |
|
Sn |
Sb |
|
Te |
|
|
I |
|
|
Xe |
Cs |
Ba |
|
Tl |
|
Pb |
Bi |
|
Po |
|
|
At |
|
|
Rn |
Fr |
Ra |
|
? |
|
? |
? |
|
? |
|
|
? |
|
|
? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рамка из двойных линий ║ окружает элементы, образующие метал- лические простые вещества, а граница из пунктирных линий окружает элементы, образующие летучие простые вещества.
Деление на металлы и неметаллы относительно, потому что сущест- вуют так называемые амфотерные элементы, которые группируются вбли- зи диагональной границы (от B к At). Подразделяя элементы на металлы и неметаллы, всегда следует уточнять, по каким свойствам это деление осу- ществляется: химическим или физическим. Отметим наиболее характер- ные физические и химические свойства для металлов и неметаллов:
|
|
Физические свойства |
Химические свойства |
|||
|
металлы |
|
неметаллы |
металлы |
неметаллы |
|
1) |
высокая |
тепло- |
1) |
хрупкость; |
1) основные свой- |
1) кислотные |
проводность; |
2) |
низкая теплопро- |
ства оксидов и |
свойства оксидов |
||
2) |
высокая |
электро- |
водность; |
гидроксидов; |
и гидроксидов; |
|
проводность; |
3) |
диэлектрические |
2) восстанови- |
2) окислительная |
||
3) |
металлический |
свойства; |
тельные свойства |
способность |
||
блеск; |
|
4) |
летучесть |
|
|
|
4) |
ковкость; |
|
|
|
|
|
5) |
пластичность |
|
|
|
|
|
и др. |
|
|
|
|
|
|
17
Необходимо отметить, что физические свойства простых веществ присущи макроскопическим количествам вещества, а химические опреде- ляются главным образом свойствами атомов или молекул, т.к. химическое взаимодействие всегда протекает на атомном или молекулярном уровне. Однако реально наблюдаемая химическая активность твердых простых веществ в заметной мере зависит, например, от величины поверхности со- прикосновения, ее состояния, структуры кристалла и т.д., то есть опять- таки от макроскопических характеристик.
Таким образом, приступая к изучению неорганической химии, мы должны помнить слова Д.И. Менделеева: «Истина, конечно, одна и вечна, но … познается и доступна только по частям, мало-помалу, а не разом в об- щем своем целом и ... пути для отыскания частей истины многообразны».
Химическая форма движения материи очень сложна и многообразна, и это создает определенные трудности при изучении химических объектов. Однако систематизация полученных знаний, поиск причинно-следст- венных связей, знание основных законов химии позволяют преодолевать эти трудности.
Изучение неорганической химии основывается на знаниях теорети- ческих основ химии и играет важную роль в системе химических дисцип- лин, обеспечивая необходимые межпредметные связи. Полученные знания будут востребованы при изучении аналитической, физической и органиче- ской химии, специальных дисциплин, а также при изучении дисциплины «Поверхностные явления и дисперсные системы».
Периодическая система Д.И. Менделеева помещена в конце книги на с. 362.
18
ТЕМА 1
s-Элементы I и II групп периодической системы Д.И. Менделеева
Краткое содержание:
1)общая характеристика s-элементов I и II групп ПСМ;
2)общая характеристика s-элементов I группы ПСМ;
3)нахождение в природе, получение, свойства s-элементов I группы;
4)оксиды, пероксиды, надпероксиды, озониды, гидриды, галогени- ды и другие соли s-элементов I группы; получение, свойства;
5)применение щелочных металлов и их соединений;
6)общая характеристика s-элементов II группы ПСМ;
7)нахождение в природе, получение, свойства s-элементов II группы;
8)соединения s-элементов II группы, получение, свойства;
9)применение s-элементов и их соединений.
К s-элементам относятся элементы главных подгрупп I и II групп (IA и IIA групп) периодической системы. Элементы IA группы – Li, Na, К, Rb, Cs, Fr – называют щелочными, а четыре элемента IIA группы – Ca, Sr, Ba, Ra – называют щелочно-земельными.
Атомы щелочных элементов для образования химических связей имеют всего один электрон, находящийся на ns-орбитали, в то время как у элементов IIA группы на внешней ns-орбитали имеется уже два электрона, один из которых при возбуждении может переходить на np- орбиталь: ns2np0 → ns1np1. Степень окисления элементов IA группы равна (+1), а у элементов IIA группы (+2). Имеются сведения о воз- можности проявления отрицательной степени окисления (–1) у щелоч- ных элементов, что связано со значительным сродством их атомов к электрону, например, энергия сродства к электрону у лития равна –59,8 кДж/моль. Энергия сродства к электрону у атомов элементов IIA группы равна нулю, и поэтому они не могут иметь отрицательную сте- пень окисления.
Некоторые сведения об элементах IA и IIA групп периодической системы Д.И. Менделеева, позволяющие провести сравнительный анализ свойств этих элементов, приведены в табл. 1.1.
19

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.1 |
|
|
|
|
|
|
|
|
Некоторые сведения об элементах IA и IIA групп ПСМ |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
№ |
|
|
|
Свойство |
Группа |
|
Химические элементы |
|
|||||||||
|
|
|
IA |
Li |
Na |
K |
Rb |
Cs |
Fr |
||||||||
пп |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
IIA |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1 |
Металлический |
IA |
0,155 |
0,189 |
0,236 |
0,248 |
0,268 |
0,280 |
|||||||||
|
радиус, нм |
IIA |
0,113 |
0,160 |
0,197 |
0,216 |
0,221 |
0,235 |
|||||||||
2 |
Радиус иона |
IA |
0,068 |
0,098 |
0,133 |
0,149 |
0,165 |
0,175 |
|||||||||
Э+/Э2+, нм |
|
|
|
|
|
|
|
||||||||||
IIA |
0,034 |
0,074 |
0,104 |
0,120 |
0,138 |
0,144 |
|||||||||||
3 |
Энергия ионизации, |
IA |
5,39 |
5,14 |
4,34 |
4,18 |
3,89 |
3,98 |
|||||||||
|
эВ |
|
|
|
|
|
|
|
|
IIA |
9,32 |
7,65 |
6,11 |
5,69 |
5,21 |
5,28 |
|
4 |
ρ, кг/дм3 |
|
|
|
|
|
|
IA |
0,539 |
0,97 |
0,86 |
1,5 |
1,9 |
|
|||
|
|
|
|
|
|
IIA |
1,85 |
1,74 |
1,54 |
2,63 |
3,76 |
~6 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
5 |
Тпл, К |
|
|
|
|
|
|
IA |
435,5 |
370,8 |
366,6 |
312,5 |
301,4 |
|
|||
|
|
|
|
|
|
IIA |
1560 |
923 |
1115 |
1041 |
1000 |
1264 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
6 |
Ткип, К |
|
|
|
|
|
|
IA |
1609,6 |
1155,9 |
1033 |
1023 |
958 |
|
|||
|
|
|
|
|
|
IIA |
2780 |
1368 |
1768 |
1663 |
1913 |
1773 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
Э+ |
+ |
|
|
= Э |
IA |
– 3,05 |
– 2,71 |
– 2,92 |
– 2,93 |
– 2,92 |
|
|||
|
ϕ |
0 |
е |
|
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
,В |
|
|
|
|
|
|
|
|
7 |
|
298 |
Э2+ |
+ 2 |
е |
= Э |
IIA |
– 1,85 |
– 2,36 |
– 2,87 |
– 2,89 |
– 2,90 |
|
||||
|
(в растворе) |
|
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||
8 |
|
S H298 , кДж/моль |
IA |
159,3 |
92,0 |
90,4 |
82,1 |
78,5 |
|
||||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IIA |
327,4 |
150,2 |
191,0 |
151,8 |
195,0 |
162 |
9 |
|
Hгuдр. , кДж/моль |
IA |
– 500 |
– 390 |
– 305 |
– 280 |
– 246 |
|
||||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IIA |
– 2512 |
– 1952 |
– 1613 |
– 1476 |
– 1338 |
|
|
Относительная |
IA |
11 |
21 |
14 |
8 |
5 |
|
|||||||||
10 |
электрическая про- |
|
|
|
|
|
|
|
|||||||||
|
водимость (относи- |
IIA |
5 |
21 |
21 |
4 |
|
|
|||||||||
|
тельно Hg) |
|
|
|
|
|
|
|
|||||||||
Обозначения: ρ - плотность; Тпл – температура плавления; Ткип – температура кипения;
ϕ2980 – стандартный электродный потенциал; S H 2980 - энтальпия сублимации; Hгидр0 |
. – эн- |
тальпия гидратации ионов. |
|
Как видно из этой таблицы, в группах IA и IIA сверху вниз металли- ческие радиусы и радиусы ионов увеличиваются, энергии ионизации уменьшаются. Если сравнивать элементы IA и IIA групп по периодам (Li и Be, Na и Mg, K и Ca, Rb и Sr, Cs и Ba, Fr и Ra), то увеличение заряда ядра и количества электронов приводит к уменьшению радиуса атома и иона, увеличению энергии ионизации. Плотность, температуры плавления и ки- пения, энергии сублимации, теплоты гидратации у элементов IIA группы заметно выше, чем у элементов IA группы. Это является следствием, пре- жде всего, уменьшения радиуса атома элементов IIA группы и увеличени- ем их массы по сравнению с элементами IA группы. Уменьшение радиуса атома приводит к более прочной связи в кристаллах, а значит к более вы-
20
