
3.5. Выводы.
-
При титровании угольной кислотой наблюдается две точки эквивалентности.
Титрование до второй точки эквивалентности невозможно (Ka,1/Ka,2 < 104).
-
Точка эквивалентности не совпадает с точкой нейтральности, лежит в щелочной области (pHТЭ = 8,35).
-
Скачёк на кривой титрования зависит от силы протолитов. Чем слабее титруемая кислота, тем меньше скачёк титрования.
-
Скачёк на кривой титрования зависит от концентрации титруемых растворов. Чем больше концентрация, тем больше скачёк на кривой титрования.
-
Скачёк на кривой титрования зависит от температуры. С повышением температуры скачёк уменьшается.
-
Вблизи точки эквивалентности необходимо учитывать автопротолиз H2O и протолиз, образовавшейся соли.
-
Скачёк pH при титровании 0,1М Na2CO3 0,1М раствором HCl равен 1,7 единицы.
4. Комплексонометрия.
Комплексометрия основана на реакциях образования комплексов. Титриметрические методы, основанные на реакциях комплексообразования, используются, приблизительно, уже целое столетие. Но наибольшее применение комплексометрии в аналитической химии было достигнуто сравнительно недавно, в результате введения в практику титриметрии полидентантных лигандов. Полидентантные лиганды реагируют с ионами металла в простом стехиометрическом соотношении (чаще всего 1:1). Для таких систем наблюдается максимальное изменение рМ вблизи ТЭ на кривой титрования. Титрование с использованием полидентантных лигандов называют комплексонометрией.
К комплексонам относится группа полиамино-полиуксусных кислот. Наиболее часто применяют этилендиаминтетрауксусную кислоту (комплексон-II). На практике используют её двунатриевую соль
Na2H2Y•2H2O (комплексон- III), обозначаемую ЭДТА. Наиболее ценным
свойством ЭДТА, как титранта, является его способность реагировать с ионами металлов в отношении 1:1 независимо от заряда катиона.
Этилендиаминтетрауксусная кислота (H4Y) имеет структуру:
HOOC--- CH2 CH2--- COOH



 N---CH2---CH2---N
N---CH2---CH2---N
HOOC--- CH2 CH2--- COOH
Это сложная четырехосновная кислота: рК1=2; рК2=2.67; рК3=6.16; рК4=10.26. Для написания её формулы и формул её ионов часто используются сокращения: H4Y, H3Y-, H2Y2-, HY3-, Y4-.
4.1.
Титрование Zn![]() 0,1 М раствором ЭДТА. Вывод формул для
расчета кривой комплексометрического
титрования.
0,1 М раствором ЭДТА. Вывод формул для
расчета кривой комплексометрического
титрования.
Уравнение титрования :
Zn![]() + Y
+ Y![]()
![]() ZnY
ZnY![]()
По уравнению реакции видно, что титрант и определяемое вещество реагирует в мономерном отношении 1:1. т.е эквивалентами данных соединений являются сами молекулы .
-
Расчет кривой до ТЭ :
До
ТЭ n![]() <n
<n![]() .
т.е f<1.
В растворе имеются недотитрованные
ионы Zn
.
т.е f<1.
В растворе имеются недотитрованные
ионы Zn![]() .
Поэтому показатель концентраций их
определяется формулой :
.
Поэтому показатель концентраций их
определяется формулой :
PZn
= -lg[Zn![]() ]
(1)
]
(1)
![]()
Следовательно,
без учета изменений объема V![]() =V
=V![]() .Поэтому
показатель
.Поэтому
показатель
концентрации:
![]()
![]() ,
где n
,
где n![]() (Zn
(Zn![]() )-
количество вещества Zn
)-
количество вещества Zn![]() ,
оставшегося после прибавления титранта.
,
оставшегося после прибавления титранта.
Количество
недотитрованного Zn![]() можно записать:
можно записать:
![]()
Тогда уравнение (1) примет вид:
![]() ,где
,где
![]() - начальная концентрация Zn
- начальная концентрация Zn![]()
Таким
образом, получаем конечную формулу
расчета кривой титрования Zn![]() до ТЭ:
до ТЭ:
pZn
= -lg(1-f)*C![]()
pZn
= -lg(1-f
)- lgC![]()
б) Расчет кривой в ТЭ:
ТЭ
достигается только в том случае если
прибавлено эквивалентное количество
титранта (ЭДТА), т.е n![]() =n
=n![]() ,
f=1.
Рассмотрим качественный состав раствора.
В ТЭ имеется водный раствор ЭДТА с
катионами Zn
,
f=1.
Рассмотрим качественный состав раствора.
В ТЭ имеется водный раствор ЭДТА с
катионами Zn![]() .
Поэтому единственным источником Zn
.
Поэтому единственным источником Zn![]() является диссоциация комплекса. А
показатель концентрации определяется
константой устойчивости ZnY
является диссоциация комплекса. А
показатель концентрации определяется
константой устойчивости ZnY![]()
β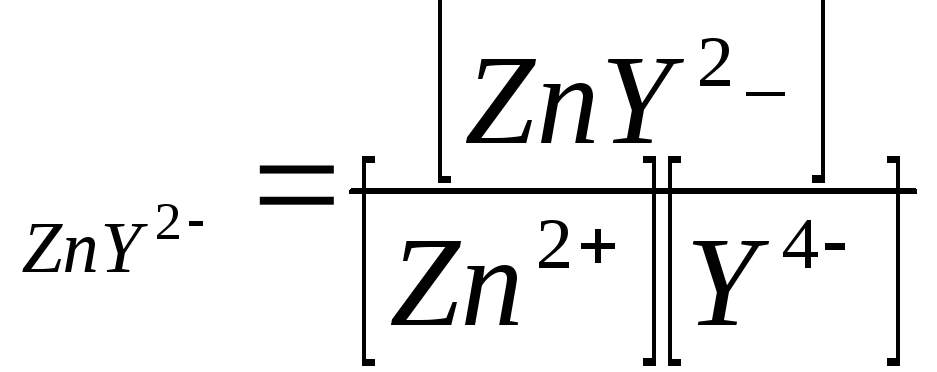
Равновесные
концентрации
![]() ,
поэтому:
,
поэтому:
β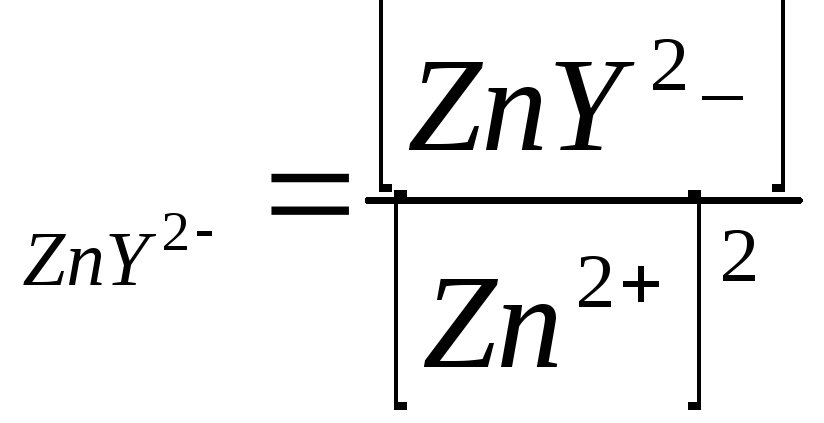 ,
,

pZn
= -lg

pZn
= -1/2 lg
![]()
Вследствие
того, что комплекс ZnY![]() диссоциирует незначительно, можно
принять
диссоциирует незначительно, можно
принять
![]()
pZn
=

pZn
=
![]()
в) Расчет кривой титрования после ТЭ:
После
ТЭ n![]() >n
>n![]() ,
f>1.
в растворе избыток ЭДТА, а также комплекс
его с катионами Zn
,
f>1.
в растворе избыток ЭДТА, а также комплекс
его с катионами Zn![]() .
Единственным источником Zn
.
Единственным источником Zn![]() является диссоциация комплекса. А
показатель концентрации определяется
не только константой устойчивости
комплекса, но избыточным количеством
титранта. В данном случае:
является диссоциация комплекса. А
показатель концентрации определяется
не только константой устойчивости
комплекса, но избыточным количеством
титранта. В данном случае:
![]() ,
но
,
но
![]() поэтому
поэтому
 ,
,
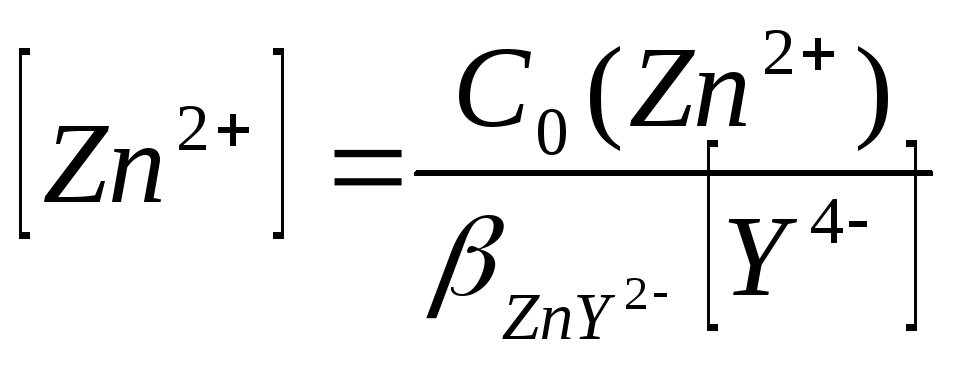 где
где
![]()
n![]() -
количество вещества титранта, прибавленного
после ТЭ,
-
количество вещества титранта, прибавленного
после ТЭ,
![]()
Следовательно, без учета изменений объема:
![]() ,
,
 ,
,
![]()
Получаем:
![]()
![]() ,
,
![]() =
=
![]()
![]()
Расчет
кривой титрования иона Zn![]() комплексоном
(
комплексоном
(![]() )
)
4.2. Таблица значений рZn.
|
f |
Состав |
Формула расчета |
рZn |
|
0 0,1 0,5 0,9 0,99 0,999 |
|
|
1 1.05 1,3 2,00 3,00 4 |
|
1 |
|
|
8,63 |
|
1,001 1,01 1,1 1,5 |
|
|
13,25 14,25 15,25 15,95 |
