
Вывод формул для расчета окислительно-восстановительного потенциала
Ионное уравнение
реакции:
5Fe2+
+ MnO4-
+ 8H+
![]() 5Fe3+
+ Mn2+
+ 4H2O
5Fe3+
+ Mn2+
+ 4H2O
В любой из моментов титрования раствор всегда содержит две окислительно – восстановительные пары: Fe3+/Fe2+ и MnO4-/Mn2+.
Уравнение Нернста:
![]()
где Е0 – стандартный потенциал данной пары; R – газовая постоянная [равная 8,313 дж/(моль*град)]; Т – абсолютная температура, К°; F – число Фарадея (96500 кулон/г-экв); n – число электронов (теряемых или получаемых).
Если подставить числовые значения констант и от натуральных логарифмов перейти к десятичным, то для комнатной температуры (20°С) получим:
![]()
В начальный момент титрования.
В начале титрования до прибавления перманганата, в растворе присутствуют Fe2+-ионы и в ничтожно малой концентрации – Fe3+-ионы.
![]()
![]()
![]() в
в
2. Титрование до ТЭ
Вычислим потенциал раствора для момента, когда к 100 мл раствора FeSO4 прибавлено 50 мл раствора KMnO4 0,1 н. Только 50% Fe2+-ионов, находившихся в 100 мл взятого раствора, перешло в Fe3+.
![]() в
в
Начало скачка. В этот момент прилито 99,9 мл KMnO4, т.е на 0,1 мл меньше, чем требуется по уравнению реакции, в растворе осталось неоттитрованным Fe2+ в объеме 0,1 мл и оттитровано 99,9 мл (превращено в Fe3+).
![]() в
в
3. Титрование в ТЭ
![]()
![]() (1)
(1)
![]() (2)
(2)
![]() +
+![]()
![]() (3)
(3)
Так как в ТЭ
MnO4—ионы
вводятся в раствор в количестве,
соответствующем уравнению реакции
5Fe2+
+ MnO4-
+ 8H+
![]() 5Fe3+
+ Mn2+
+ 4H2O,
то и при равновесии на каждый оставшийся
в растворе MnO4-
-ион должно приходиться 5Fe2+-ионов:
5Fe3+
+ Mn2+
+ 4H2O,
то и при равновесии на каждый оставшийся
в растворе MnO4-
-ион должно приходиться 5Fe2+-ионов:
[Fe2+] = 5[MnO4-] [Fe3+] = 5[Mn2+]
Поделив второе из этих равенств на первое, получим:
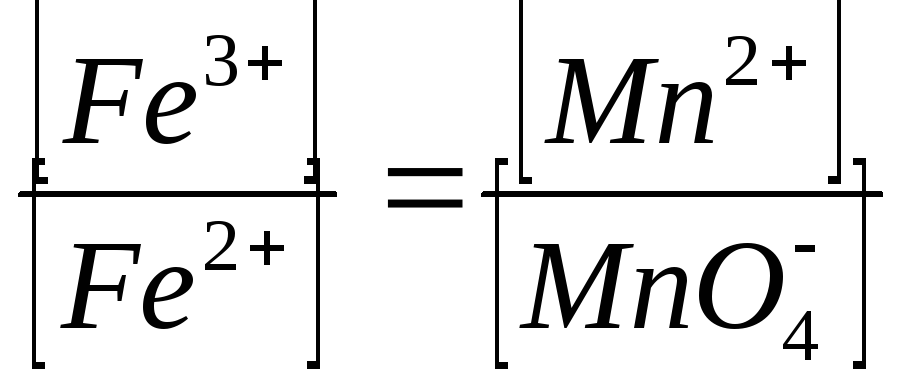 и
и

А так как lg 1 =0, из уравнения (3) следует:
6E=0.77 + 5*1.51
![]()
![]()
4. Титрование после ТЭ
Найдем теперь величину Е в конце скачка, т.е. при введении 100,1 мл раствора перманганата; из этого количества 100 мл затрачено на реакцию с Fe2+, т.е. MnO4-восстановлен до Mn2+:
![]()
[H+]=1 г-ион/л
![]() в
в
Таблица 1. Расчет кривой титрования FeSO4 раствором KMnO4(сТ =со = 0,1М, VТ=100 мл)
|
№ |
Прибавлено KMnO4, мл |
Состав |
Формула расчета |
E, в |
|
I |
0 |
FeSO4, H2O, H2SO4 |
|
0.596 |
|
II |
50 |
FeSO4, H2O, H2SO4, KMnO4, K2SO4, MnO, Fe2(SO4)3 |
|
0.77 |
|
91 |
|
0.828 | ||
|
99 |
|
0.886 | ||
|
99.9 |
|
0.944 | ||
|
III |
100 |
K2SO4, MnO, Fe2(SO4)3 H2O |
|
1.387 |
|
IV |
100.1 |
K2SO4, MnO, Fe2(SO4)3 H2O, KMnO4
|
|
1.475 |
|
101.0 |
|
1.487 | ||
|
110.0 |
|
1.498 | ||
|
200.0 |
|
1.510 |

Рис. 1 Кривая титрования 0,1 н раствора FeSO4 0.1 н раствором KMnO4
