
Сущность титриметрии
Метод анализа, основанный на точном измерении объема раствора реагента точной известной концентрации, затрачиваемого на реакцию, называется титриметрическим методом анализа.
В зависимости от типа реакций методы титриметрии делят на четыре группы; каждая из групп, в свою очередь, обычно включает несколько различных методов:
Кислотно-основное титрование (протолитическое)
Окислительно-восстановительное титрование (редоксометрия)
Осадительное титрование
Комплексометрическое титрование
Реакции, применяемые в титриметрии, должны удовлетворять следующим основным требованиям:
реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика;
реакция должна протекать с большой скоростью;
реакция не должна осложняться протеканием побочных реакций;
должен существовать способ фиксирования точки эквивалентности.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе.
При титровании необходимо установить количество титранта, эквивалентное количеству определяемого вещества. Для этой цели к исследуемому раствору приливают постепенно титрант до тех пор, пока не будет достигнуто эквивалентное отношение. Этот момент титрования называют точкой эквивалентности (ТЭ). ТЭ характеризуется особым отношением концентраций реагирующих веществ в растворе. В ТЭ концентрации главных реагирующих компонентов в растворе эквивалентны или равны.
Для экспериментального установления ТЭ пользуются различными указателями – индикаторами. Чаще всего применяют различные цветные индикаторы. Момент титрования, когда индикатор изменяет окраску, называют конечной точкой титрования(КТТ). Очевидно, необходимо выбирать индикатор и условия титрования так, чтобы КТТ совпадала с ТЭ или была как можно ближе к ней
Различают три метода титрования: прямое, обратное (по остатку) и титрование заместителя (метод замещения).
При прямом титровании определяемое вещество титруют раствором титранта. Обратное титрование применяют тогда, когда определяемое вещество не реагирует с титрантом или реагирует медленно. В этом случае к отмеренном объему определяемого вещества добавляют точно измеренный, но заведомо избыточный объем титранта и не вошедший в реакцию избыток титранта оттитровывают. Титрование заместителя применяют в тех случаях, когда определяемый ион непосредственно не реагирует со стандартным раствором или реагирует с ним в нестехиометрическом отношении. Определяемое вещество замещают на эквивалентное количество другого вещества, которое затем определяют прямым титрованием.
2. Кислотно-основное титрование
В методах кислотно–основного титрования основной является реакция передачи протона от титранта титруемому веществу или от титруемого вещества титранту. Реакции кислотно–основного взаимодействия характеризуются высокой скоростью, протекает строго стехиометрически.
В основе метода лежит протолитическая реакция:
SH2+
+ S–
![]()
![]() 2SH
2SH
в частности, в водных растворах
H3O+
+ OH–
![]() 2H2O
2H2O
Вывод формул для расчета pH
В начальный момент титрования.
f=0 В начале титрования в растворе находится только слабое основание NH4OH ( с Кд = 1,76∙10−5):
NH4OH
![]() NH4+
+ OH−
NH4+
+ OH−
Константа равновесия
которого равна:

Рассчитаем α - коэффициент при концентрации 0,1 моль/л:
Кb=
![]()
α<<1
, Кb=![]()
![]() , α<5%
, α<5%
Основание диссоциировано мало, поэтому можно считать, что основание является единственным источником гидроксид-ионов и тогда [NH4+] = [OH−] и [NH4OH] = c(NH4OH).
Кb(NH4OH)
=
![]()
[OH−]2 = Kb(NH4OH)∙c(NH4OH) (1)
т.к. [OH−]
=
![]() , и подставляя его в выражение (1), получим
, и подставляя его в выражение (1), получим
[H+]
=
![]() (2)
(2)
Логарифмируя выражение (2), получаем формулу для расчета pH:
pH
= −lg[H+]
= −lg![]() =
=
= 14 – ½ pKb (NH4OH) + ½ lg c(NH4OH)
Выразим концентрацию титруемого вещества и титранта через степень оттитрованности:
![]() (3)
(3)
![]()
Следовательно, мы можем узнать, сколько моль вещества недотитровалось:
![]()
где
![]() − это количество определяемого вещества,
оставшегося после прибавления титранта.
− это количество определяемого вещества,
оставшегося после прибавления титранта.
Из формулы (3) следует, что коэффициент (1 – f) показывает, какая часть титруемого вещества от исходного количества осталась в растворе.
Без учета изменения
объема в процессе титрования (V
р-ра
=Vo),
ионной силы и конкурирующих реакций,
используя выражение для молярной
концентрации [А] =
![]() ,
можно записать, что
,
можно записать, что

Следовательно, с(NH4OH) = (1 – f)co(NH4OH) и окончательная формула для расчета рН в начальный момент титрования будет:
pH = 14 – ½ pKb(NH4OH) + ½ lg(1 – f)co(NH4OH)
2. Титрование до ТЭ
f < 1 Раствор представляет собой буферную смесь NH4OH и NH4Cl, т.е. получается заряженная кислота:
NH4OH
![]() NH4+
+ OH
−
NH4+
+ OH
−
NH4+
+ H2O
![]() NH4OH
+ H+
NH4OH
+ H+
Kв
( NH4OH)
=
![]()
Т.к. концентрации NH4OH и NH4+ достаточно велики, происходит подавление диссоциации основания. Тогда [NH4OH] = c(NH4OH) и [NH4+] = c(NH4+). Автопротолиз воды подавлен и его можно не учитывать. Подставив эти выражения для Кв, получим:
Kb
(NH4OH)
=

![]()
![]() (4)
(4)
Логарифмируем выражение (4) и получаем:
![]()
Выразим концентрацию NH4OH через степень оттитрованности c(NH4OH) = (1 – f)co(NH4OH) и c(NH4+) = f∙co(NH4+). Получим формулу для вычисления pH раствора до ТЭ:
![]()
3. Титрование в ТЭ
f = 1 В ТЭ все основание оттитровано и рН раствора определяется наличием сопряженной кислоты:
NH4+
+ H2O
![]() NH3
+ H3O+
NH3
+ H3O+
Ка
(NH4+)
=

где Ка (NH4+) − константа кислотности основания. Она равна:
Ка
(NH4+)=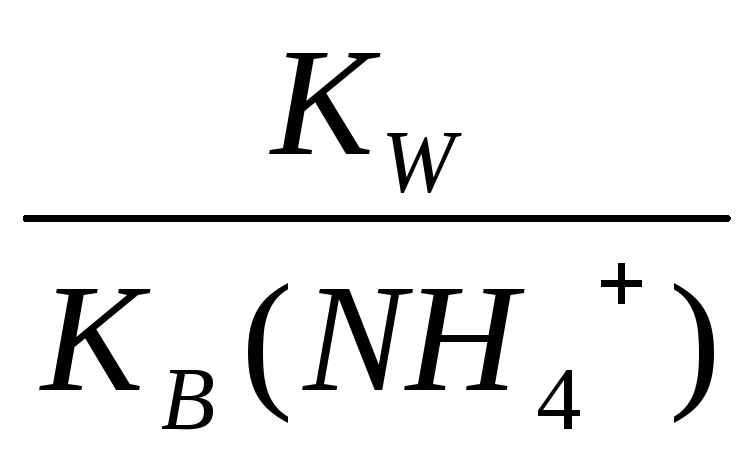
Т.к. степень диссоциации NH4+ мало, следовательно, протолитическое равновесие смещено влево, и можно считать, что [NH4+] =c(NH4+), когда количество ионов водорода, получившихся при диссоциации кислоты, достаточно для подавления атопротолиза воды, то можно считать, что [H+] = [NH4OH]. С учетом этих допущений получим:
Ка
(NH4+)
=

![]()
![]() (4)
(4)
Логарифмируем выражение (4) и получим :
![]()
Учитывая, что
c(NH4OH)
=![]() ∙co(NH4OH)
получим окончательную формулу для
расчета рН в ТЭ:
∙co(NH4OH)
получим окончательную формулу для
расчета рН в ТЭ:
![]()
4. Титрование после ТЭ
f > 1 В растворе будет избыток соляной кислоты, которая и будет определять рН раствора. HCl сильная кислота, поэтому в растворе устанавливается равновесие:
HCl
![]() H+
+ Cl
−
H+
+ Cl
−
Т.к. автопротолиз воды подавлен, то [H+] = с(HCl). Логарифмируя последнее выражение, получим формулу для вычисления рН раствора после ТЭ:
![]()
Выразим [H+] через степень оттитрованности:

Следовательно, окончательная формула для вычисления рН раствора после ТЭ будет иметь следующий вид:
![]()
Таблица 1. Расчет кривой титрования NH4OH HCl (сТ =со = 0,1М, VТ=100 мл)
|
N |
f |
Состав |
Формула расчета |
pH |
|
I |
0 |
NH4OH, H2O |
pH = 14 – ½ pKb(NH4OH) + ½ lg(1 –f)co(NH4OH)
|
11,12 |
|
II |
0,1 |
NH4OH, NH4Cl, H2O |
|
10,20 |
|
0,5 |
9,25 | |||
|
0,9 |
8,30 | |||
|
0,99 |
7,25 | |||
|
0,999 |
6,25 | |||
|
III |
1 |
NH4Cl, H2O |
|
5,12 |
|
IV |
1,001 |
HCl, NH4Cl, H2O |
|
4,00 |
|
1,01 |
3,00 | |||
|
1,1 |
2,00 | |||
|
1,5 |
1,30 | |||
|
2,0 |
1 |
Р ис.
1 Кривая титрования 0,1 н раствораNH4OH
0,1 н раствором HCl.
ис.
1 Кривая титрования 0,1 н раствораNH4OH
0,1 н раствором HCl.
