
- •Расчетно-графическая работа
- •1.Титриметрический метод.
- •Отсюда можно найти неизвестную концентрацию одного из веществ, если известны объём его раствора и объём и концентрация прореагировавшего с ним вещества.
- •Титрование слабой кислоты сильным основанием.
- •Значение рН кривой титрования
- •0,5М раствора hcooh 0,5m раствором NaOh.
- •2.3.Факторы, влияющие на скачок титрования.
- •2.4.Способы обнаружения точки эквивалентности
- •2.5.Погрешности титрования.
- •2.6.Вычисление индикаторной погрешности титрования:
- •2.7.Вывод по кривой титрования.
- •3.Окислительно-восстановительное титрование.
- •3.1.Сущность окислительно-восстановительного титрования.
- •3.2.Титрование 100мл 0,05м (nh4)2Fe(so4)26h2o раствором 0,05м Ce(so4)2 .
- •3.4.Выбор индикатора в окислительно-восстановительном титровании.
3.4.Выбор индикатора в окислительно-восстановительном титровании.
Для обнаружения конечной точки титрования (КТТ) используют:
1.Безиндикаторное титрование.
2.Специфические индикаторы.
3.Окислительно-восстановительные индикаторы.
К безиндикаторному титрованию относится перманганатометрия. После ТЭ появляется одна лишняя капля титранта, и раствор окрашивается в розовый цвет. При титровании разбавленными растворами (с концентрацией менее 0,02М) применяют редокс-индикаторы, такие как дифениламин сульфокислота или ферроин.
Специфические индикаторы – вещества, которые образуют либо с титрантом, либо с титруемым раствором окрашенные соединения (например, в иодометрии используют специфический индикатор – крахмал).
Окислительно-восстановительные (редокс-индикаторы) – органические соединения, у которых окисленная и восстановленная формы имеют различную окраску.
В цериметрии используют ферроин –
индикатор-комплексE0Ind=1,06B
E=1,060,059.
Интервал перехода окраски 1,001 – 1,119.
Комплекс Fe
(II)
с 1,10-фенантролином, переходит при
окислении в комплекс Fe
(III).
цериметрии используют ферроин –
индикатор-комплексE0Ind=1,06B
E=1,060,059.
Интервал перехода окраски 1,001 – 1,119.
Комплекс Fe
(II)
с 1,10-фенантролином, переходит при
окислении в комплекс Fe
(III).
Fe (Phen)3+2 Fe(Phen)3+3 + e-
Красный голубой
Оба комплекса очень устойчивы (lg3 = 21,3 и 14,1 соответственно). Они не разрушаются в сильнокислых средах и в присутствии фосфорной кислоты. Используются также другие производные фенантролина, например, комплекс Fe (II) с 5-нитро-1,10-фенантролином (Fe0’= 1,25B, 1M H2SO4) применяется при титровании восстановителей стандартным раствором церия (IV) в азотнокислой и хлорно-кислой средах.
3 .5.Погрешность
титрования.
В методе окислительно-восстановительного
титрования индикаторная погрешность
возникает за счёт того, что потенциал
в ТЭ не совпадает со стандартным
потенциалом индикатора. Если E0Ind
< EТЭ
то погрешность
отрицательна,
.5.Погрешность
титрования.
В методе окислительно-восстановительного
титрования индикаторная погрешность
возникает за счёт того, что потенциал
в ТЭ не совпадает со стандартным
потенциалом индикатора. Если E0Ind
< EТЭ
то погрешность
отрицательна,
Е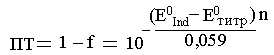 слиE0Ind
> EТЭ
то погрешность положительна
слиE0Ind
> EТЭ
то погрешность положительна
В![]() данном случаеE0Ind
< EТЭ
(1,06
1,25), поэтому
данном случаеE0Ind
< EТЭ
(1,06
1,25), поэтому
Построенные кривые титрования, представляют собой ступенчатые линии. Окислительно-восстановительная кривая титрования в отличие от кислотно-основной кривой, до и после точки эквивалентности практически параллельна оси. Вблизи точки эквивалентности отсутствуют впадины, образующиеся на кислотно-основной кривой из-за протолиза и скачёк титрования гораздо значительнее.
Список использованной литературы
1.Основы аналитической химии / под ред. Ю.А.Золотова. М.: Высш. шк., 1992. – 462 с.
2. Пилипенко А.П. Аналитическая химия М.: Высш. шк., 1989.
3. Алексеев В.Н. Количественный анализ. М.: Химия, 1972. – 504 с.
4. Васильев В.П. Аналитическая химия. М.: Высш. шк., 1989. – 493 с.
5. Кудашева Ф.Х., Кручкова Е.С., Сидельников А.В. Расчёты кривых титрования по степени оттитрованности / Метод. Указания. Уфа, 2002. – 36 с.
