
- •Расчетно-графическая работа
- •1.Титриметрический метод.
- •Отсюда можно найти неизвестную концентрацию одного из веществ, если известны объём его раствора и объём и концентрация прореагировавшего с ним вещества.
- •Титрование слабой кислоты сильным основанием.
- •Значение рН кривой титрования
- •0,5М раствора hcooh 0,5m раствором NaOh.
- •2.3.Факторы, влияющие на скачок титрования.
- •2.4.Способы обнаружения точки эквивалентности
- •2.5.Погрешности титрования.
- •2.6.Вычисление индикаторной погрешности титрования:
- •2.7.Вывод по кривой титрования.
- •3.Окислительно-восстановительное титрование.
- •3.1.Сущность окислительно-восстановительного титрования.
- •3.2.Титрование 100мл 0,05м (nh4)2Fe(so4)26h2o раствором 0,05м Ce(so4)2 .
- •3.4.Выбор индикатора в окислительно-восстановительном титровании.
3.Окислительно-восстановительное титрование.
В основе метода лежит изменение потенциала окислительно-восстановительной системы при изменении соотношения концентраций окислительной и восстановительной форм в процессе титрования.
3.1.Сущность окислительно-восстановительного титрования.
Кривые титрования целесообразно строить в координатах EOx/Red – степень оттитрованности. В окислительно-восстановительной реакции
n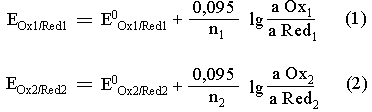 2Ox2
+ n1Red1
n1Ox1
+ n2Red2
участвуют две редокс-системы – титруемого
вещества (1) и титранта (2), каждая из
которых описывается уравнением Нернста.
2Ox2
+ n1Red1
n1Ox1
+ n2Red2
участвуют две редокс-системы – титруемого
вещества (1) и титранта (2), каждая из
которых описывается уравнением Нернста.
Титрант (или титруемое вещество) может быть как окислителем, так и восстановителем. После добавления каждой порции титранта в растворе устанавливается равновесие и Е1=Е2. Поэтому нет разницы по какой системе рассчитывать потенциал в данной точке. Однако удобнее рассчитывать потенциал до ТЭ по полуреакции с участием титруемого вещества, а после ТЭ – по полуреакции с участием титранта.
Е сли
титруемое вещество восстановитель, то
до ТЭ
сли
титруемое вещество восстановитель, то
до ТЭ
п![]() осле
ТЭ
осле
ТЭ
Е![]() сли
титруемое вещество окислитель, то до
ТЭ
сли
титруемое вещество окислитель, то до
ТЭ
П![]() осле
ТЭ
осле
ТЭ
В точке эквивалентности концентрация сопряжённых форм полуреакции титруемого вещества и полуреакции титранта ничтожно малы, поэтому для расчёта EТЭ складывают уравнения обеих полуреакций, предварительно уменьшив их на n1 и n2 для уравнивания числа электронов:
![]()
 Т
Т
 ак
как в ТЭ реагирующие вещества находятся
в стехиометрических отношениях
ак
как в ТЭ реагирующие вещества находятся
в стехиометрических отношениях

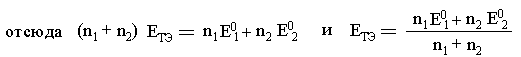

Если n1=n2 или в реакции участвуют полиядерные частицы, то кривые несимметричны и точка эквивалентности не совпадает с точкой перегиба.
Кривые окислительно-восстановительного титрования являются билогарифмическими, поскольку изменение потенциала определяется отношением концентраций сопряжённых форм. Поэтому величина скачка не зависит от разбавления, за исключением титрования систем с участием полиядерных частиц (титрование Fe(II) перманганатом).
3.2.Титрование 100мл 0,05м (nh4)2Fe(so4)26h2o раствором 0,05м Ce(so4)2 .
Рассчитаем кривую титрования.
Fe+2 + Ce+4 Fe+3 +Ce+3
lgkp = (E0OX – E0Red) nF/2,303RT = (1,74 – 0,77)1/ 0,059 = 17
Чем больше разность потенциалов исходных окислителя и восстановителя, тем больше константа равновесия, тем полнее будет протекать реакция слева направо при прочих равных условиях. Константа равновесия даёт возможность рассчитывать концентрации веществ при наступлении равновесия, но не позволяет предвидеть, как скоро оно наступит.
|
Титрант |
Первичный стандарт |
Реакции |
Эквивалент |
Индикатор |
|
Ce(SO4)2 |
Na2C2O4 As2O3 |
Ce+4 + e- = Ce+3 C2O42- - 2e- = 2CO2 H3AsO3+H2O-2e=H2AsO4-+3H+ |
1/2 Na2C2O4 1/4 As2O3 |
Ферроин, нитроферроин |
E0Fe(III)/Fe(II)=0,771B; E0Ce(IV)/Ce(III)=1,74B.
Таблица значений Е при различных значениях f.
|
f |
Формула расчёта |
Значение Е, В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ТЭ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вывод:
1) Скачёк зависит от разности стандартного или формального потенциалов
реагирующих систем. Чем больше разность потенциалов реагирующих пар, тем больше будет скачёк.
2) Скачёк зависит от присутствующих посторонних веществ, вызывающих конкурирующие реакции комплексообразования и протонирования. В зависимости от того, окислительная или восстановительная форма участвует в конкурирующей реакции, потенциал системы может увеличиваться или уменьшаться. Если хотя бы один из компонентов пары связать в прочный комплекс, перевести в малорастворимое соединение, то образуется новая пара, стандартный потенциал которой связан с потенциалом исходной пары и логарифмом соответствующей химической реакции. Конкурирующая реакция комплексообразования приводит к уменьшению потенциала системы восстановителя.
3) Скачёк на кривой титрования не зависит от разбавления раствора.
4) Скачёк титрования не зависит от кислотности раствора, так как кислород не входит в состав окислителя.

 1,00
1,00