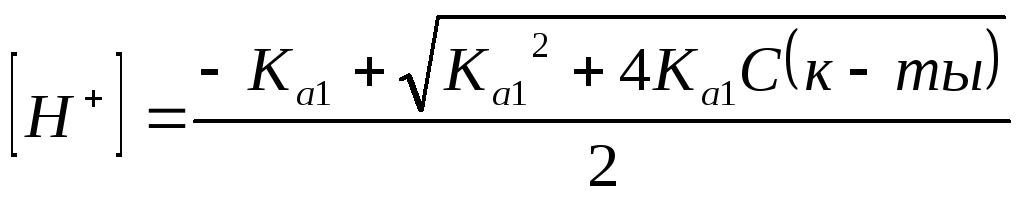- •Расчетно-графическое задание
- •§2. Титриметрические методы
- •§3. Стандартные растворы
- •§4. Логарифмические кривые титрования
- •§5. Способы фиксирования точки эквивалентности
- •Глава 2. Кислотно-основное титрование 0,1 м раствора сh2(соон)2 0,1 m раствором NaOh.
- •§1. Общая характеристика кривой титрования
- •§2. Вывод формул расчета pH
- •§3. Выбор индикатора для титрования
- •§4. Погрешности титрования
- •§5. Расчет значений pH кривой титрования
- •§6. Выводы по кривой титрования
- •§1. Общая характеристика кривой титрования
- •§2. Вывод формул расчета потенциала
- •§3. Таблица значений потенциала системы и расчет погрешности титрования
- •§4. Выводы по кривой титрования
§3. Выбор индикатора для титрования
Как показано в таблице значений pH, в первой точке эквивалентностиpH=4,26. Среда в растворе – кислая. Поэтому необходимо использовать индикатор, интервал перехода которого лежит в пределах от 3 до 5,5 единицpH, и показатель титрования максимально близок к значениюpHв точке эквивалентности. Наиболее удобно использование индикатора метилового оранжевого с интервалом перехода от 3,1 до 4,4 (цвет меняется от красного до желтого );pK=3,36;pT=4,0; формула показана на рис.1
Во второй точке эквивалентности pH=9,48, то есть щелочная среда. Подходящим для титрования до средней соли индикатором является тимоловый синий (тимолсульфофталеин) с интервалом перехода от 8,0 до 9,6 (цвет меняется от желтого до синего);pK=9,2;pT=8,8; формула показана на рис.3.

Рис.1.
 Структурная формула метилового оранжевого
Структурная формула метилового оранжевого

Рис.2. Структурная формула тимолового синего.
§4. Погрешности титрования
При проведении титрования возможны случайные и систематические погрешности. Случайные погрешности возникают в связи с неточным определением массы навески или объема титранта, и обрабатываются при помощи методов статистики. Систематические погрешности связаны с несовпадением КТТ и ТЭ.
Для первой точки эквивалентности данной
кривой титрования характерна погрешность,
определяемая по формуле
![]() =
=![]()
Для второй точки эквивалентности для
тимолового синего

§5. Расчет значений pH кривой титрования
|
№ |
Vт, мл |
Состав раствора |
Формула расчета pH |
Значение pH |
|
1 |
0 |
|
|
1,95 |
|
2 |
10 |
|
|
1,9 |
|
3 |
50 |
2,86 | ||
|
4 |
90 |
3,81 | ||
|
5 |
99 |
3,85 | ||
|
6 |
99,9 |
4,85 | ||
|
7 |
100 |
|
|
4,26 |
|
8 |
100,1 |
|
|
2,66 |
|
9 |
101 |
3,66 | ||
|
10 |
110 |
4,7 | ||
|
11 |
150 |
5,66 | ||
|
12 |
190 |
6,61 | ||
|
13 |
199 |
7,66 | ||
|
14 |
199,9 |
8,66 | ||
|
15 |
200 |
|
|
9,48 |
|
16 |
200,1 |
|
|
9,52 |
|
17 |
201 |
10,52 | ||
|
18 |
210 |
11,51 | ||
|
19 |
250 |
12,15 | ||
|
20 |
300 |
12,4 |
§6. Выводы по кривой титрования
На кривой титрования наблюдаются две
точки эквивалентности, что соответствует
основности малоновой кислоты. pHв точке эквивалентности, соответствующей
образованию кислой соли рассчитывается
по формуле![]() ,
т.е. зависит от двух ступенчатых констант
диссоциации.
,
т.е. зависит от двух ступенчатых констант
диссоциации.
Точно рассчитать величину скачка титрования для данной кривой невозможно, так как вблизи точек эквивалентности образующаяся буферная смесь теряет свои особые свойства.
Глава 3.Окислительно-восстановительное титрование 0,2 М раствора Fe2+ 0,2 М раствором KMnO4
§1. Общая характеристика кривой титрования
Объект титрования – анион-восстановитель. Метод титрования – перманганатометрия. В дальнейшем будет рассматриваться титрование раствора Fe2+(FeSO4) с молярной концентрацией эквивалента 0,2 М эквимолярным растворомKMnO4.
При титровании в растворе проходит реакция (с соответствующими полуреакциями).

Расчеты потенциала для кривой титрования
проведены по степени оттитрованности.
Так как реакция проводится в кислой
среде, для поддержания pHна постоянном уровне в раствор вводится
1МH2SO4.
Для фиксирования точки эквивалентности
нет необходимости применять индикатор
(как в методе бихроматометрии), так как
перманганат-ион имеет собственное
интенсивное фиолетовое окрашивание,
начиная с момента, когда раствор
перетитрован на одну каплю. Поэтому
использование так называемой «защитной
смеси» (смесь 1 МH2SO4и 1 МH3PO4)
необязательно. Для данных условий
![]() ;
;![]() (используются формальные потенциалы,
рассчитанные исходя изpH).
(используются формальные потенциалы,
рассчитанные исходя изpH).
Принцип действия защитной смеси заключается в образовании с ионом Fe3+прочного бесцветного комплексного иона [FeH2PO4]2+. Благодаря этому мешающая желтая окраска ионов железа исчезает; значения потенциала в левой части кривой титрования понижаются.
![]()
В связи с образованием комплекса равновесие смещается в сторону образования ионов Fe3+. Рассмотрим молярную долю ионов железа (III)
![]()
![]()
Уравнения соответствующих формальных потенциалов выводятся из уравнения Нернста. Так, для окислительно-восстановительной пары MnO4-/Mn2+


Формальный потенциал пары будет определять следующее уравнение (коэффициент активности γ=1), зависящее от pHсреды:
![]()
Благодаря приблизительно постоянному
значению pHформальный
потенциал при титровании допустимо
считать постоянным. Однако при значительном
увеличенииpHпроисходит
смещение правой ветви кривой вниз. Так
дляpH=2![]() ,
а приpH=4 начинается
образование гидроксида железа (III).
,
а приpH=4 начинается
образование гидроксида железа (III).
Нельзя для создания нужного pHиспользовать соляную кислоту, так как
потенциал![]() и в растворе будет проходить конкурирующая
реакция окисления хлорид-ионов до хлора,
что приведет к увеличению погрешности.
и в растворе будет проходить конкурирующая
реакция окисления хлорид-ионов до хлора,
что приведет к увеличению погрешности.
При вычислении используется молярная концентрация эквивалента C=0,2Mкак для титранта, так и для титруемого вещества.
.