
- •Расчетно-графическое задание
- •§2. Титриметрические методы
- •§3. Стандартные растворы
- •§4. Логарифмические кривые титрования
- •§5. Способы фиксирования точки эквивалентности
- •Глава 2. Кислотно-основное титрование 0,1 м раствора сh2(соон)2 0,1 m раствором NaOh.
- •§1. Общая характеристика кривой титрования
- •§2. Вывод формул расчета pH
- •§3. Выбор индикатора для титрования
- •§4. Погрешности титрования
- •§5. Расчет значений pH кривой титрования
- •§6. Выводы по кривой титрования
- •§1. Общая характеристика кривой титрования
- •§2. Вывод формул расчета потенциала
- •§3. Таблица значений потенциала системы и расчет погрешности титрования
- •§4. Выводы по кривой титрования
Глава 2. Кислотно-основное титрование 0,1 м раствора сh2(соон)2 0,1 m раствором NaOh.
§1. Общая характеристика кривой титрования
Объект титрования – слабая малоновая кислота СH2(СООН)2. В дальнейшем будет рассматриваться титрование раствора объемом 100 мл с молярной концентрацией эквивалента 0,1 М СH2(СООН)2эквимолярным растворомNaOH.
При титровании проходят следующие последовательные реакции:
![]()
![]()
Расчеты проведены с использованием
объема титранта и начального объема
раствора, с учетом изменения объема в
ходе титрования. Константы диссоциации
малоновой кислоты по первой и второй
ступеням равны K1=1,4∙10-3,
К2=2,2∙10-6. Показатели констант
(pK=-lgK) равны
2,85 и 5,66 соответственно. СкачокpHв точке эквивалентности практически
отсутствует, соответствующей образованию
кислой соли, практически отсутствует,
т.к.![]() <
<
![]() .
Так как константа диссоциации кислоты
по второй ступени превышает 10-7,
то титрование до средней соли возможно.
И скачок около второй точки эквивалентности
будет достаточно резкий. Точки
эквивалентности фиксируются при помощи
индикаторов, рассмотренных далее.
.
Так как константа диссоциации кислоты
по второй ступени превышает 10-7,
то титрование до средней соли возможно.
И скачок около второй точки эквивалентности
будет достаточно резкий. Точки
эквивалентности фиксируются при помощи
индикаторов, рассмотренных далее.
В расчетах используются следующие постоянные величины: V0=100мл (начальный объем титруемого вещества); С=0,1 М (молярная концентрация эквивалента, одинаковая и для титранта, и для титруемого вещества), а такжеVT– объем титранта, мл.
§2. Вывод формул расчета pH
Кривую кислотно-основного титрования СH2(СООН)2 растворомNaОН можно условно разделить на шесть этапов, для каждого из которых необходимо рассматривать отдельную формулу расчетаpH.К первому этапу следует отнести титрование в начальной точке. При этом в растворе содержится только исходный компонент и происходит его диссоциация.
HOOCCH2COOH ↔HOOCCH2COO- +H+
HOOCCH2COO- ↔-OOCCH2COO- +H+
Т.к. диссоциация по второй ступени мала
по сравнению с диссоциацией по первой
ступени (![]() ),
то ею можно пренебречь. Исходя из закона
разбавления Оствальда, степень диссоциации
),
то ею можно пренебречь. Исходя из закона
разбавления Оствальда, степень диссоциации![]() .
Для СH2(СООН)2она равна
.
Для СH2(СООН)2она равна![]() или
12%, т.е. более 5%. Это значит, что кислота
диссоциирует значительно и
или
12%, т.е. более 5%. Это значит, что кислота
диссоциирует значительно и![]() .
В случае равновесная концентрация
недиссоциированной части кислоты равна
общей концентрации кислоты за вычетом
концентрации ионов водорода, образовавшихся
за счет диссоциации кислоты:
.
В случае равновесная концентрация
недиссоциированной части кислоты равна
общей концентрации кислоты за вычетом
концентрации ионов водорода, образовавшихся
за счет диссоциации кислоты:![]() .
Тогда
.
Тогда
После преобразования получаем
![]() Следовательно,
Следовательно,

Ко второму этапуотносится участок кривой, когда объем добавленной щелочи не превышает 100 мл. При этом в растворе проходит кислотно-основная реакция обмена по первой ступени.
![]()
В результате образуется буферный
раствор, содержащий сопряженную
кислотно-основную пару
![]() .
Для рассмотренной пары в растворе
устанавливаются следующие равновесия:
.
Для рассмотренной пары в растворе
устанавливаются следующие равновесия:
HOOCCH2COOH+H2O↔HOOCCH2COO-+H3O+
HOOCCH2COO-+H2O↔НOOCCH2COOН +OH-
Рассмотрим константу равновесия первого уравнения, равную при этом второй константе диссоциации кислоты:
![]()
![]()
Если принять во внимание, что равновесие
реакций смещено вправо, тогда
![]() и
и![]() ,
то уравнение расчетаpHбудет представлено в следующем виде:
,
то уравнение расчетаpHбудет представлено в следующем виде:

Концентрации соответствующих компонентов раствора рассчитываются следующим образом:
![]()
![]()
Поэтому уравнение приобретет следующий вид:
![]()
Однако вблизи точек эквивалентности,
когда раствор недотитрован или
перетитрован на 10% результаты, полученные
по этой формуле, не вполне соответствуют
истинным, так как на pHпри
этом влияет автопротолиз воды и
диссоциация растворителя, не подавленная
в присутствии пары![]() в связи с их малой концентрацией на этом
участке кривой титрования.
в связи с их малой концентрацией на этом
участке кривой титрования.
Рассмотрим третий этап, представляющий собой расчетpHв первой точке эквивалентности. Так как концентрации титранта и определяемого вещества равны, то при добавлении эквивалентного количества, то есть 100 млNaOH, реакция образования кислой соли проходит полностью. В растворе остается только амфолит НOOCCH2COONa. Рассмотрим равновесия, наблюдающиеся в растворах:
HOOCCH2COO- ↔-OOCCH2COO- +H+
HOOCCH2COO- + H2O ↔НOOCCH2COOН + OH-
![]()
![]() ;
;

![]()
![]()
![]()
![]()

Т.к. для данного случая
 ,
то уравнение можно привести к виду
,
то уравнение можно привести к виду
![]()
![]()
pHна четвертом этапетитрования (объем титранта составляет от 100 до 200 мл) также будет определяться буферным раствором. Основанием при этом будет являться уже ионNaOOCCH2COONa, а кислотой –HOOCCH2COO-.
В растворе установятся следующие равновесия:
HOOCCH2COO- ↔-OOCCH2COO- +H+
-OOCCH2COO- +Н2О ↔ HOOCCH2COO- + ОН-

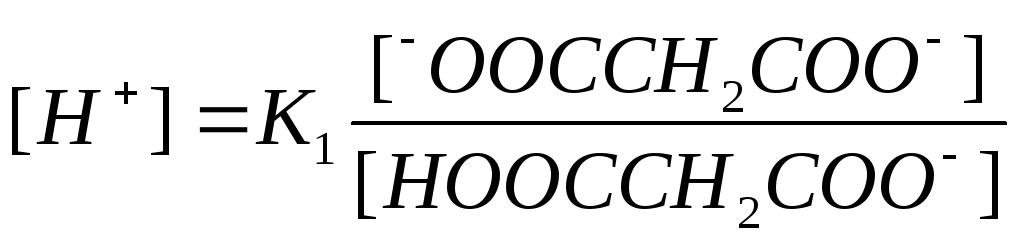
Если принять во внимание, что равновесие
реакций смещено вправо, тогда
![]() и
и![]() ,
то уравнение расчетаpHбудет представлено в следующем виде:
,
то уравнение расчетаpHбудет представлено в следующем виде:

Концентрации соответствующих компонентов раствора рассчитываются следующим образом:
![]()
![]()
Поэтому уравнение приобретет следующий вид:
![]()
По причинам, изложенным для второго этапа кривой титрования, точные результаты не получаются по данной формуле, когда раствор недотитрован на 10% и перетитрован на 10%.
К пятому этапу следует отнести вторую точку эквивалентности (VT=200 мл). В этом случае в растворе будет находиться только ионы-OOCCH2COO-, которые являются заряженными основаниями. В растворе проходит реакция гидролиза, и образуются ионы гидроксила.
-OOCCH2COO-+Н2О ↔HOOCCH2COO-+ ОН-
бразующиеся ионы CO32- являются заряженными основаниями. В растворе проходит реакция гидролиза, и образуются ионы гидроксила.
CO32-+ Н2О ↔ НCO3-+ ОН-

![]() ;
;
![]()

![]()
![]()
На шестом участкекривой
титрования объем титранта составляет
200-300 мл. Для расчетаpHследует применить формулу![]() или,
так какNaOHдиссоциирует
полностью,
или,
так какNaOHдиссоциирует
полностью,![]() .
При этом
.
При этом![]() ,
то есть
,
то есть![]() .
.
