
- •Содержание
- •Отсюда можно найти неизвестную концентрацию одного из веществ, если известны объём его раствора и объём и концентрация прореагировавшего с ним вещества.
- •2. Стандартные растворы.
- •3. Кислотно – основное титрование.
- •3.1.Выводы формул для расчета кривой титрования.
- •3.2. Таблица значений рН.
3. Кислотно – основное титрование.
Титрование 0.5 М раствора HCl 0,5 М расвором NaOH.
Проводим титрование сильной кислоты сильным основанием. Уравнение реакции титрования
NaOH + HCl→NaCl +H2O
По уравнению реакции видно, что титрант и определяемое вещество реагирует в молярном отношении 1:1,то есть эквивалентами данных соединений является сами молекулы.
3.1.Выводы формул для расчета кривой титрования.
Расчет кривой до точки эквивалентности.
До точки эквивалентности рН определяется только ионами Н+ за счет неоттитрованной соляной кислоты, так как другими источниками (автопротолиз воды и т.д.) можно пренебречь, так как с(HCl)>~10-6М.Поэтому рН раствора определяется формулой
рН= -lg[Н+]
где [Н+] = с(HCl) = с0.
Поэтому получаем
рН = - lgс0 (12).
Концентрация – это количество вещества в объеме раствора, т. е можно записать
![]() (13)
(13)
Следовательно, без учета изменения объема V0=Vр-ра. Поэтому показатель концентрации можно записать таким образом
![]() (14)
(14)
nнедот(HCl)- есть количество вещества HCl, оставшегося после прибавления титранта.
nнедот= (1- f )∙n0
Можно записать
nнедот= (1- f )∙n0(HCl) (15)
Тогда уравнение (12) на основании(14) и (15) примет следующий вид:
![]() (16)
(16)
здесь величина n0(HCl)/V0 есть начальная концентрация HCl – c0(HCL).
Таким образом, получаем конечную формулу расчета кривой титрования HCl до точки эквивалентности :
рН = -lg (1- f )∙c0(HCl)
рН = -lg (1- f ) - lgc0
Расчет кривой титрования в точке эквивалентности.
Точка эквивалентности достигается только в том случае, если прибавлено эквивалентное количество титранта, т. е nT=n0, a f=1. Рассмотрим качественный состав раствора. В точке эквивалентности имеется раствора соли титранта с анионом хлора. Следовательно, единственным источником ионов водорода является вода значение рН определяется ионами водорода, поступающими за счет автопротолиза воды:
рН = ½ pKw (18)
Формула (18) следует из того, что
К w=c[H+][OH-]= [H+]2
[H+]=Kw1/2,
pH= -lg[H+]=-lgKw1/2,
и является конечной для расчета рН в точке эквивалентности.
Расчет кривой титрования после точки эквивалентности.
После достижения точки эквивалентности nT>n0, f = 1.В растворе имеется избыток NaOH, а также его соль с анионами Cl=NaCl.Следовательно за точкой эквивалентности, значение рН определяется избытком добавленного титранта – сильного основания.
Так как с0~ст изменением объем а можно пренебречь. Тогда получаем, что
[Т] = ст ∙ (f-1) (19),
где [Т] – это концентрация титранта, т.е NaOH, если в логарифмической форме
lg[T] = lgc + lg (f-1) (20)
Запишем константу реакции титрования Кт:
KT= [H3O+][OH-]=Kw
Выразим значение рОН через [Т]:
pOH=-lg[OH-]
pOH=-lg[T]
pOH = -lgcT-lg(f-1) (22)
Подставив в формулу
pH=pKw-pOH
полученное значение рОН получим:
pH=pKw+lgcT+lg(f-1) (23)
Формула(23) конечная для расчета РН после ТЭ.
Таким образом,имеем,что с0 = ст = 0,5 М
3.2. Таблица значений рН.
|
план |
f |
Состав раствора |
Формула расчета рН |
Значение рН |
|
I |
0 |
НСl,H2O |
рН = - lgс0 |
0,3 |
|
II |
0,5 0,9 0,99 0,999 |
HCl NaCl H2O |
рН = -lg (1- f ) - lgc0
|
0,6 1,3 2,3 3,3 |
|
II |
1 |
NaCl H2O |
рН = ½ pKw |
7
|
|
IV |
1,001 1,01 1,1 1,5 2.0 |
|
pH=pKw+lgcT+lg(f-1) |
10,7 11,7 12,7 13,4 13,7 |
Титрование 0,1 М раствора NaI 0,1 М раствором AgNO3
9. Осадительное титрование.
Осадительные методы имеют ограниченное значение. Лишь очень немногие процессы осаждения отвечают всем требованиям, предъявляемым к реакциям в титриметрии. Ограничения связаны главным образом с неколичественным и нестехиометрическим протеканием реакций. Удовлетворительны с этой точки зрения реакции осаждения галогенидов и тиоцианата серебра (аргентометрия), а также ряда соединений ртути (I).
10. Вывод формул pI на различных этапах титрования.
В процессе титрования
изменяется концентрация осаждаемого
иона – иодид-иона
![]() ,
поэтому кривые титрования целесообразно
строить в координатахpI
– f
(логарифмические кривые).
,
поэтому кривые титрования целесообразно
строить в координатахpI
– f
(логарифмические кривые).
1) До начала
титрования (f=0)
определяется начальной концентрацией
NaI,
т.е.
![]()
2) До первой точки
эквивалентности (0<f<1),
![]() осаждается ионами серебраAg+.
осаждается ионами серебраAg+.
![]()
Концентрация иодид-ионов определяется количеством прибавленного титранта и произведением растворимости образующегося осадка.
![]()
Так как
![]() и
и![]() ,
то слагаемым
,
то слагаемым![]() можно пренебречь.
можно пренебречь.
![]()
![]()
3) В точке эквивалентности (f=1) концентрация иодид-ионов в титруемом растворе определяется только произведением растворимости иодида серебра.
![]()
![]()
![]()
![]()
4) После точки эквивалентности (f>1) концентрация иодид-ионов определяется произведением растворимости AgI, но уже с учетом избытка титранта.

![]()
По выведенным формулам вычислим значения pI в различные моменты титрования и построим кривую титрования.
11. Значение pI в различные моменты титрования
|
Этап |
f |
Состав раствора |
pI–определяющий компонент |
Формула расчета pI |
Значение pI |
|
I |
0 |
NaI |
|
|
1 |
|
II |
0,5 |
NaI, NaNO3, AgI |
|
|
1,3 |
|
0,9 |
2 | ||||
|
0,99 |
3 | ||||
|
0,999 |
4 | ||||
|
III |
1 |
NaNO3, AgI |
AgI↓ частично растворяется |
|
8,04 |
|
IV |
1,001 |
NaNO3, AgNO3, AgI |
Ag+ избыток, AgBr↓ |
|
12,08 |
|
1,01 |
13,08 | ||||
|
1,1 |
14,08 | ||||
|
1,5 |
14,78 | ||||
|
2 |
15,08 |
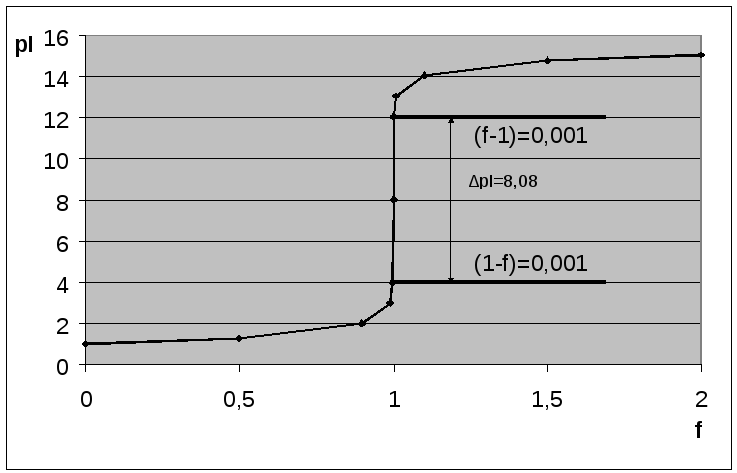
Рис. 2. Кривая осадительного титрования 0,1 М раствора иодида натрия 0,1 М раствором нитрата серебра
 12.
Способ фиксирования точки эквивалентности
12.
Способ фиксирования точки эквивалентности
Метод Гей-Люссака.
Это самый старый метод, основанный на визуальном наблюдении просветления раствора в точке эквивалентности или равного помутнения при добавлении капли титранта и титруемого вещества к капле раствора вблизи точки эквивалентности (до и после нее).
Метод Фаянса.
В процессе титрования
поверхность осадка имеет некоторый
заряд в соответствии с правилами
адсорбции. При титровании
![]() раствором нитрата серебра осадок
раствором нитрата серебра осадок![]() до точки эквивалентности заряжен
отрицательно вследствие адсорбции
иодид–ионов. После точки эквивалентности
осадок становится положительно заряженным
вследствие адсорбции ионов серебра.
Если в растворе присутствуют ионы
красителя, то они могут служить
противоионами и придавать осадку
окраску. Например, флуоресцеин – слабая
органическая кислота желто – зеленого
цвета.
до точки эквивалентности заряжен
отрицательно вследствие адсорбции
иодид–ионов. После точки эквивалентности
осадок становится положительно заряженным
вследствие адсорбции ионов серебра.
Если в растворе присутствуют ионы
красителя, то они могут служить
противоионами и придавать осадку
окраску. Например, флуоресцеин – слабая
органическая кислота желто – зеленого
цвета.
Флуоресцеин диссоциирует в растворе с образованием аниона, который адсорбируется на положительно заряженном осадке AgCl после точки эквивалентности. При адсорбции окраска красителя изменяется на розовую.
При титровании с адсорбционными индикаторами существенно значение pH, поскольку должна доминировать ионная форма индикатора. При титровании с флуоресцеином pH раствора должен быть равным 7. При титровании в более кислой среде следует использовать краситель с более сильными кислотными свойствами, например дихлорфлуоресцеин вместо флуоресцеина.
Метод Мора
Индикатором служит
хромат – ион, который образует
красно-кирпичный осадок Ag2CrO4,
более растворимый, чем AgI.
При титровании Ag2CrO4
не выпадет, пока
![]() не будет оттитрован полностью.
не будет оттитрован полностью.
![]() ,
S(AgI)
= 9,1·10-9
M.
,
S(AgI)
= 9,1·10-9
M.
На практике создают концентрацию CrO42- от 0,01 М до 0,005 М.
13. Расчёт индикаторных погрешностей
При титровании с
индикатором CrO42-
раствор перетитровывается. В конечной
точке титрования концентрация
![]() складывается изC0(
f-1)
и ионов, поступающих за счет частичного
растворения AgI.
складывается изC0(
f-1)
и ионов, поступающих за счет частичного
растворения AgI.
![]()
В то же время
![]()
Отсюда

Как видно, систематическая погрешность тем меньше, чем больше концентрация титруемого вещества и титранта и чем ближе КТТ к точке эквивалентности.
Ag2CrO4
![]() 2
Ag+
+ CrO42-
2
Ag+
+ CrO42-
KS = [Ag+]2[CrO42-]
[Ag+]
=
![]() = 6,5·10-5
= 6,5·10-5

ПТ,
![]() = 6,5 * 10-2
= 6,5 * 10-2
![]()
14. Вывод по кривой титрования 0,1 М раствора NaI 0,1 M раствором AgNO3.
1. В осадительном титровании наблюдается одна точка эквивалентности,
pI в точке эквивалентности рассчитывается по формуле
![]()
2. Кривая симметрична относительно точки эквивалентности.
3. Кривые осадительного титрования относятся к монологарифмическим кривым.
4. Скачок титрования составляет ∆pI =8,08 (от 4,0 до 12,08)
Индекс крутизны:
![]()
5. Чем меньше произведение растворимости осадка и больше исходная концентрация, тем больше скачок титрования и индекс крутизны, а, следовательно, меньше стандартное отклонение результатов титрования.
Список литературы.
А.М. Пилипенко, И.В. Пятницкий. Аналитическая химия. М.: изд. «Химия», 1990.
Ю.Ю. Лурье. Справочник по аналитической химии
Ю.А. Золотов. Основы аналитической химии. Книга 2 .М: изд. «Высшая школа», 1999.
