
- •Башкирский государственный университет
- •6.4. Факторы, влияющие на скачок комплексонометрического титрования 23
- •1.Введение
- •2.Сущность титриметрии
- •3.Стандартные растворы
- •4.Кривые титрования
- •5.Кислотно-основное титрование. Титрование раствора аммиака соляной кислотой
- •5.1.Вывод формул вычисления pH
- •5.2. Таблица значений рН:
- •5.3. Способы обнаружения точки эквивалентности. Выбор индикатора
- •5.4. Погрешности титрования:
- •5.5.Выводы по кривой титрования аммиака соляной кислотой
- •Расчет монологарифмических кривых титрования
- •6.1Выводы формул для расчета кривой комплексонометрического титрования
- •6.2. Значение pCa в различные моменты титрования:
- •6.4.Факторы, влияющие на скачок комплексонометрического титрования
- •6.5.Способы обнаружения конечной точки титрования:
- •6.7.Выводы по кривой титрования
- •Список использованной литературы:
5.Кислотно-основное титрование. Титрование раствора аммиака соляной кислотой
Рассмотрим титрование 0,5М раствора аммиака 0,5М раствором соляной кислоты. При титровании слабого основания сильной кислотой реакция раствора в точке эквивалентности вследствие гидролиза продуктов нейтрализации будет не нейтральной, а слабокислой. При титровании аммиака pH раствора будет определяться равновесием:
NH3 + HOH = NH4+ + OH –
5.1.Вывод формул вычисления pH
Сначала рассчитаем степень диссоциации раствора аммиака:
=
![]() =
=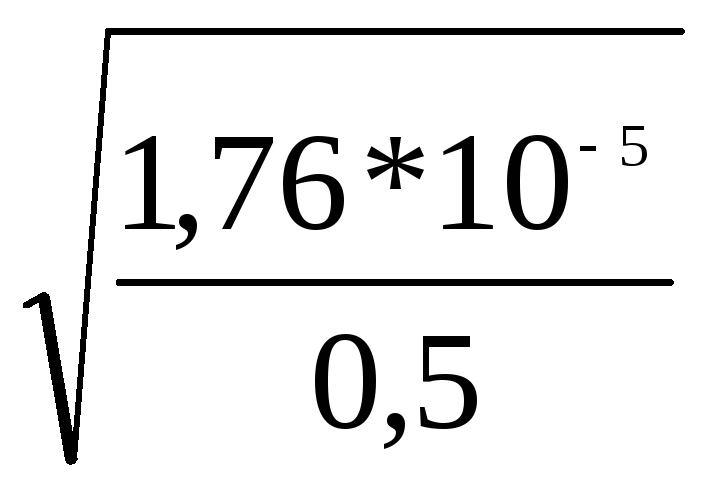 = 0,59
= 0,59
Значит основание диссоциировано мало ( 5%), и можно считать раствор аммиака единственным источником появления гидроксид-ионов, полагая, что [NH4+] = [OH-] и [NH3] = C(NH3). Тогда
![]() =
=
![]() =
=![]() ,
где
,
где![]() –
константа основности
–
константа основности
![]()
Подставляя
![]() ,
получим:
,
получим:
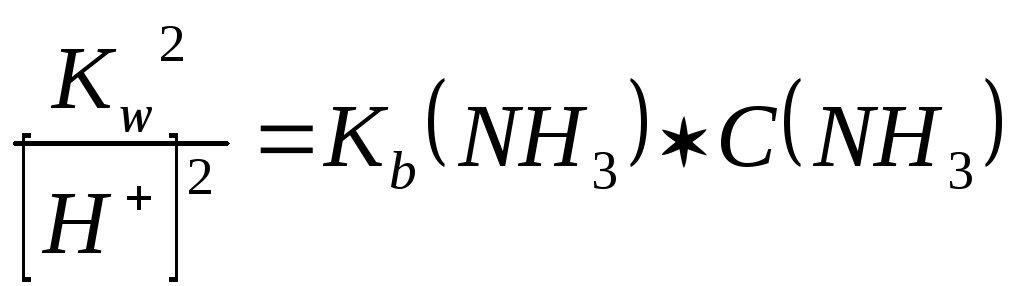 ,
откуда
,
откуда
![]()
pH![]()
![]()
![]()
Теперь рассчитаем ход кривой титрования до точки эквивалентности:
При добавлении к 100,0 мл аммиака 9,0 мл 0,1М HCl концентрация титруемого раствора снизится до 0,091 моль\л, а иона NH4+ увеличится до 0,009 моль/л. В результате образуется смесь слабого основания и его сопряжённой кислоты, то есть буферный раствор.
NH4OH + HCl = NH4Cl + H2O
В водном растворе, содержащем данную сопряжённую кислотно-основную пару, устанавливаются равновесия:
NH3 + H2O NH4+ + OH- (1)
NH4+ + H2O NH3 + H3O+ (2)
Произведём расчёт pH.
Константа равновесия (1) является константой основности аммиака:
![]()
Считаем,
что
![]() и
и![]() ,
и автопротолиз подавлен, то есть его
можно не учитывать, потому что основание
малодиссоциировано. Подставляя эти
значения в выражение для
,
и автопротолиз подавлен, то есть его
можно не учитывать, потому что основание
малодиссоциировано. Подставляя эти
значения в выражение для![]() ,
получаем:
,
получаем:
![]() ,
откуда
,
откуда
![]()
pOH![]()
![]()
В
общем случае: pOH![]()
![]()
Для
того чтобы учесть изменение концентрации
веществ при титровании за счёт увеличения
объёма раствора, следует вычисленное
значение концентрации умножить на
коэффициент
![]() ,
гдеV
– объём добавленного титранта.
,
гдеV
– объём добавленного титранта.
pH
![]()
Приступим к расчёту хода кривой титрования в точке эквивалентности:
В точке эквивалентности в титруемом растворе нет избытка ни NH4OH, ни HCl: в растворе существует только слабая кислота NH4+, которая находится в протолитическом равновесии с водой:
NH4+ + HOH = NH3 + H3O+ (2)
Константа
равновесия представляет собой константу
кислотности катиона
![]()
![]()
Так
как степень диссоциации кислоты мала
(5%),
то кислота диссоциирует незначительно,
протолитическое равновесие смещено
влево, и можно считать, что равновесная
концентрация недиссоциированной кислоты
равна общей концентрации кислоты
![]() .
Когда количество ионов водорода,
получившихся при диссоциации кислоты,
достаточно для подавления автопротолиза
воды, то исходя из уравнения
.
Когда количество ионов водорода,
получившихся при диссоциации кислоты,
достаточно для подавления автопротолиза
воды, то исходя из уравнения![]() можно считать, что
можно считать, что![]() .
С учётом этих допущений:
.
С учётом этих допущений:
 ,
где
,
где
![]() - константа кислотности.
- константа кислотности.
Отсюда
![]()
![]()

Теперь рассчитаем ход кривой титрования после точки эквивалентности:
После точки эквивалентности pH раствора определяется количеством добавленной кислоты.
Концентрация водородных ионов в растворе представляет собой сумму водородных ионов, получившихся при диссоциации сильной кислоты, и водородных ионов, образующихся за счёт автопротолиза воды. Протолитическое равновесие в водном растворе сильной кислоты полностью смещено вправо и можно считать, что концентрация ионов водорода равна общей концентрации кислоты:
![]() .
Константа автопротолиза воды
.
Константа автопротолиза воды
![]() .
.
В
воде
![]() .
Концентрация ионов водорода в растворе
сильной кислоты с учётом автопротолиза:
.
Концентрация ионов водорода в растворе
сильной кислоты с учётом автопротолиза:
![]() .
.
Так как в нашем случае раствор не сильно разбавлен
![]() ,
то автопротолиз подавлен и концентрацией
ионов водорода и соответственно
гидроксида, образующихся за счёт
автопротолиза (второй член уравнения),
можно пренебречь.
,
то автопротолиз подавлен и концентрацией
ионов водорода и соответственно
гидроксида, образующихся за счёт
автопротолиза (второй член уравнения),
можно пренебречь.
Тогда
![]()
![]()
![]()
При добавлении 0,1 мл 0,1М HCl к изменившемуся в ходе титрования объёму титрованного раствора, равному 200 мл, получим следующие результаты pH:
![]()
А при добавлении 1 мл 0,1М HCl получим:
![]()
