
- •Министерство образования рф башкирский государственный университет
- •Расчётно-графическое задание по титриметрии
- •Содержание:
- •1.1.Сущность титриметрии
- •1.2.Стандартные растворы.
- •1.2.1.Способы выражения концентрации стандартных растворов.
- •1.3.Кривые титрования.
- •2.Кислотно-основное титрование.
- •2.1.Кривые титрования
- •2.2.Титрование слабой кислоты сильной щелочью.
- •2.2.1.Титрование ch3cooh раствором NaOh.
- •2.3.Факторы, влияющие на скачок титрования.
- •2.4.Способы обнаружения точки эквивалентности
- •2.5.Погрешности титрования.
- •2.6.Вычисление индикаторной погрешности титрования:
- •2.7.Вывод по кривой титрования.
- •3.Комплексонометрия.
- •Расчет кривой титрования после точки эквивалентности.
- •3.2.Выбор индикатора.
- •3.3. Выводы по кривой титрования .
- •Список литературы
3.Комплексонометрия.
Комплексонометрия основана на реакции образования комплексов. Применяют реакцию образования галогенидов ртути (II),фторидов алюминия, циркония, тория и цианидов некоторых тяжелых металлов (никель, кобальт, цинк). На образовании этих комплексов основаны методом меркуриметрии, фторидометрия, цианидометрия.
Титрование с использованием полидентатных органических лигандов называют комплексонометрией.
Наиболее часто применяют этилендиаминотетрауксусную кислоту (комплексон II), анион ее обычно обозначают символомY. На практике используют ее двунатриевую сольNa2H2Y*2H2O(комплексонIII) обозначаемую ЭДТА. Высокая устойчивость комплексов ионов металлов с ЭДТА обусловлена наличием в молекуле ЭДТА шести групп с донорными атомами азота и кислорода. Поэтому во всех комплексах ЭДТА проявляют себя как шестидентатный лиганд и образуют октаэдрические комплексы преимущественно составаMY(n-4)+.В общем виде образование комплексонатов с ЭДТА составаMY(n-4)+можно описать реакцией.
ML(n-qL)+ + HiY(4-i)- = MY(n-4)+ + qLb- + iH+
Комплексы HLq(n-4)+должны быть менее устойчивыми чем комплексыMY(n-4)+поэтому при прибавлении ЭДТА В раствор с определенным значением рН, содержащим ионы металла и вспомогательный лигандL, происходит реакция обмена лигандами.
ЭДТА
NaOOCH2C CH2COOH
> N─CH2─CH2─N<
NaOOCH2C CH2COOH
![]() Ка1 = 10-2рКа1 = 2
Ка1 = 10-2рКа1 = 2
![]() Ка2 = 2,16·10-3 рКа2 = 2,67
Ка2 = 2,16·10-3 рКа2 = 2,67
![]() Ка3 = 6,92·10-7рКа3 = 6,16
Ка3 = 6,92·10-7рКа3 = 6,16
![]() Ка4 = 5,5·10-11рКа4 =
10,26
Ка4 = 5,5·10-11рКа4 =
10,26
3.1. Титрование ионов Mg2+ 0,1 М раствором ЭДТА.
Для построения кривой титрования введем понятие степени оттитрованности. Степень оттитрованности fчисленно равна отношению оттитрованности в данный момент количества вещества эквивалента к исходному количеству:
f=
![]()
Другими словами, степень оттитрованности показывает, какая часть исходного вещества оттитровалась.
fno-показывает сколько моль определенного вещества оттитровалась.
nотт=fno
Следовательно, мы можем узнать сколько моль вещества недотитровалось:
nнедот =no-fno
nнедот = (1-f)nonнедотэто количество оставшегося определяемого вещества.
Без учета изменения объема один процент титрования (Vр-ра=Vт), ионной силы и конкурирующих реакций используя выражение для молярной концентрации, можно записать , что [ недот ] = (1-f)Co
В следствии чего что вещества реагируют между собой в эквивалентных количествах можно записать nот =nт, тогда
f=![]()
Уравнение реакции определения цинка выглядит следующим образом:
Mg2++Y4-![]() ZnY2-
ZnY2-
nn
Константа устойчивости MgY2-равна![]()
![]() =1,8*1016
=1,8*1016
Расчет кривой титрования до точки эквивалентности.
nт <no,то естьf< 1.В растворе имеются недотитрованные катионыMgпотому
pMg=-lg[Mg2+]
концентрация это есть количество вещества одного объема раствора, то есть можно записать:
[Mg2+] =
![]() объем не изменяется, поэтому
объем не изменяется, поэтому
[Mg2+] =![]() ,nнедот (Mg2+)
есть количествоMg2+оставшегося после прибавления титранта.
,nнедот (Mg2+)
есть количествоMg2+оставшегося после прибавления титранта.
Nнедот = (1-f)nо(Mg2+)pZn=![]() . Здесь величина
. Здесь величина![]() есть начальная концентрация катионов
цинкаCo(Mg2+).
есть начальная концентрация катионов
цинкаCo(Mg2+).
Таким образом, конечная формула для расчета кривой титрования катионов Mg2+до точки эквивалентности
pMg = -lg (1-f) Co(Mg2+)
pMg = -lg (1-f) – lg (Co(Mg2+))
Расчет кривой титрования в точке эквивалентности.
То есть при nт =nо,f= 1
В точке эквивалентности имеется водный раствор соединения титранта с катионами Mg2+. Поэтому единственным источником катионаMg2+является диссоциация комплекса. А показателем концентрации определяется константой устойчивости данного комплекса.
![]() [Mg2+]
= [Y4-]
[Mg2+]
= [Y4-]
![]()
[Mg2+]
=
 pMg = - lg
pMg = - lg
![]()
MgY2-диссоциирует незначительно и поэтому можно принять [MgY2-] <Co(Mg2+)
pMg= -![]()
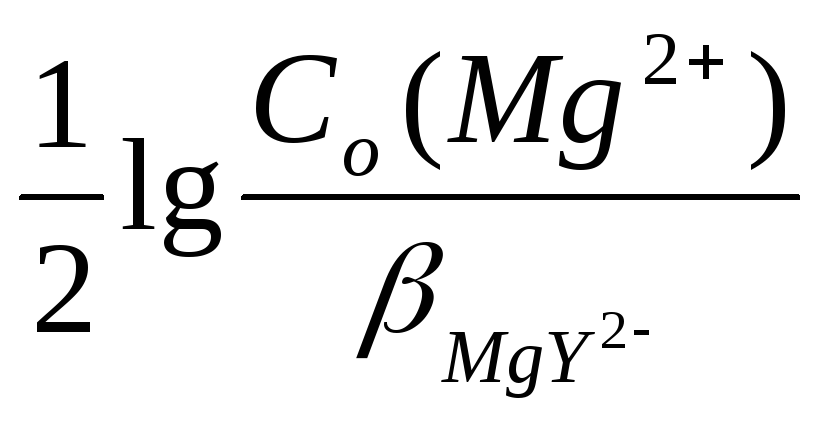
![]() pMg= -
pMg= -![]()
