
- •I. Общие положения титриметрии
- •1. Сущность титриметрии
- •2. Титриметрические методы
- •3. Стандартные растворы
- •4. Кривые титрования.
- •5. Способы фиксирования точки эквивалентности
- •II. Кислотно-основное титрование. Титрование 0,1н раствора hno2 кислоты 0,1н раствором NaOh.
- •1. Общая характеристика кривой титрования
- •2. Вывод формул для вычисления рН на различных этапах титрования.
- •3. Выбор индикатора для титрования
- •4. Погрешность титрования
- •5. Выводы по кривой титрования
- •Расчет монологарифмических кривых титрования
- •3.1 Выводы формул для расчета кривой комплексонометрического титрования
- •3.2. Значение pВa в различные моменты титрования:
- •3.4.Факторы, влияющие на скачок комплексонометрического титрования
- •3.5.Способы обнаружения конечной точки титрования:
- •3.7. Выводы по кривой титрования.
II. Кислотно-основное титрование. Титрование 0,1н раствора hno2 кислоты 0,1н раствором NaOh.
1. Общая характеристика кривой титрования
В кислотно-основном титровании вблизи точки эквивалентности наблюдается резкое изменение рН раствора (скачок титрования). Для титрования слабой кислоты сильным основанием существуют зависимости величины скачка от концентрации, температуры и константы кислотности. Чем больше концентрация и меньше температура, тем величина скачка становится больше. И если Ка10-8, то скачка не наблюдается.
2. Вывод формул для вычисления рН на различных этапах титрования.
1. До начала титрования (ƒ=0) рН определяет HNO2+H2O=NO2- +H3O+

Если положить ионную силу раствора
равной нулю (I=0) и пренебречь конкурирующими
реакциями (α=1), то
![]()
Оценим степень диссоциации HNO2кислоты.
Для слабых электролитов полагаем
![]()
![]()
Равновесную концентрацию HNO2кислоты [HNO2] нельзя положить равной общей концентрации с(HNO2)
[HNO2]= с(HNO2)-[H3O+]

[H3O+]2+[H3O+]Ka-Kaс(HNO2)=0
![]()
рН=-lg(![]() )
)
2. Если раствор недотитрован до первой точки эквивалентности (ƒ<1) то рН определяет буферная смесь ― кислота HNO2и ее натриевая сольNaNO2. В растворе устанавливается равновесие:
NO2- +H3O+=HNO2+H2O
HNO2+H2O=NO2-+H3O+


Не учитывая изменение объема раствора
![]()
Так как с0=сT, то
![]()
![]() .
.
3. В точке эквивалентности (ƒ=1) рН определяет ион NO2- .В этом случае в растворе будет находиться только ионыNO2- , которые являются заряженными основаниями. В растворе проходит реакция гидролиза:
NO2-+Н2О ↔HNO2+ ОН-

![]() →
→![]()
![]()
4.Выведем формулу для расчета рН после
ТЭ. На этом участке кривой титрования
(f>1) для расчетаpHследует применить формулу![]() или,
так какNaOHдиссоциирует
полностью,
или,
так какNaOHдиссоциирует
полностью,![]() .
При этом
.
При этом![]() ,
то есть
,
то есть![]() .
.
Сделаем таблицу титрования для того, чтобы построить график титрования 0,1н раствора HNO2кислоты 0,1н растворомNaOH.
Таблица 1
|
N0 |
добавлено NaOH,мл |
неоттитро-вано HNO2 ,мл |
состав раствора |
формула расчета |
рН |
|
1 |
0 |
100 |
HNO2 , Н2О |
рН=-lg(
|
2,09 |
|
2 |
5 10 90 99,9 |
95 90 10 0,1 |
Буферная смесь: HNO2,Na+NO2-,Н2О |
рН= |
1,88 2,21 4,11 6,16
|
|
3 |
100 |
0 |
NO2-,Н2О, Na+ |
|
8,90 |
|
|
добавлено NaOH,мл |
избыток NaOH |
|
|
|
|
4 |
100,1 110 200 |
0,1 1 10 100 |
ОН-,NO2-,Н2О, Na+ |
|
10,00 12,00 13,00 |
3. Выбор индикатора для титрования
Как показано в таблице значений pH, в первой точке эквивалентностиpH=8,90. Среда в растворе – щелочная. Поэтому желательно использовать индикатор тимоловый синий, интервал перехода которого лежит в пределах от 8,0 до 9,6 единицpH, и показатель титрования максимально близок к значениюpHв точке эквивалентности. У этого индикатора цвет меняется от желтого до синего;pK=9,2;pT=8,8; формула показана на рис.1. Также в роли индикатора подходит фенолфтолеин, интервал перехода у которого лежит в пределах от 8,2 до 9,8. У него цвет меняется от бесцветного до красного, рК=9,53, рТ=9,0. Рассчитаем индикаторную погрешность для обоих индикаторов, для того, чтобы выяснить, который индикатор больше подходит для титрования.
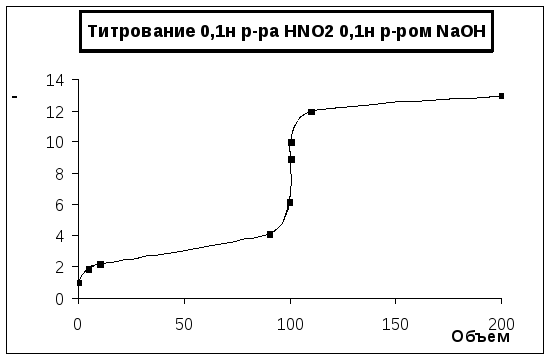
Рис. 1. Кривая титрования 0,1 н раствора HNO2 0,1 н раствором NaOH.
Рис. 1. Кривая титрования 0,1 н раствора HNO2 0,1 н раствором NaOH
