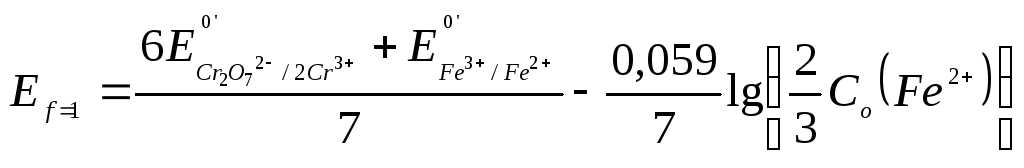- •Министерство образования рф
- •Введение Титриметрический метод. Сущность титриметрии.
- •Отсюда можно найти неизвестную концентрацию одного из веществ, если известны объём его раствора и объём и концентрация прореагировавшего с ним вещества.
- •I Кислотно-основное титрование. Титрование 100,0 мл 0,2м h2co3 0,2м раствором NaOh.
- •Вывод формул рН
- •Рис1.Кривая титрования 0,2мh2co3 0,2м раствором NaOh . Выбор индикатора.
- •Кислотно-основные индикаторы.
- •Погрешности титрования.
- •II Окислительно-восстановительное титрование (редоксометрия)
- •Вывод формул для расчета окислительно-восстановительного потенциала
- •Расчет кривой титрования после точки эквивалентности
- •Погрешности титрования
- •Литература:
- •4. Литература:
Погрешности титрования
|
№ |
f |
Состав раствора |
Формула расчета E |
Значение E, В |
|
1 |
0,1 |
(Cr2O72-) |
|
0,71 |
|
2 |
0,5 |
0,77 | ||
|
3 |
0,9 |
0,83 | ||
|
4 |
0,99 |
0,89 | ||
|
5 |
0,999 |
0,95 | ||
|
6 |
1 |
(Fe2+), |
|
1,25 |
|
7 |
1,001 |
(Fe2+),
|
|
1,31 |
|
8 |
1,01 |
1,32 | ||
|
9 |
1,1 |
1,33 | ||
|
10 |
1,5 |
1,34 |

Р

 ис
2.Кривая титрования 0,1M
FeSO4
раствором 0,1M
K2Cr2O7.
ис
2.Кривая титрования 0,1M
FeSO4
раствором 0,1M
K2Cr2O7.
Выбор индикатора в окислительно-восстановительном титровании.
Для обнаружения конечной точки титрования (КТТ) используют:
1.Безиндикаторное титрование.
2.Специфические индикаторы.
3.Окислительно-восстановительные индикаторы.
К безиндикаторному титрованию относится перманганатометрия. После ТЭ появляется одна лишняя капля титранта, и раствор окрашивается в розовый цвет. При титровании разбавленными растворами (с концентрацией менее 0,02М) применяют редокс-индикаторы, такие как дифениламин сульфокислота или ферроин.
Специфические индикаторы – вещества, которые образуют либо с титрантом, либо с титруемым раствором окрашенные соединения (например, в иодометрии используют специфический индикатор – крахмал).
Окислительно-восстановительные (редокс-индикаторы) – органические соединения, у которых окисленная и восстановленная формы имеют различную окраску.
В данном методе
для фиксирования точки эквивалентности
используем редокс-индикаторы – это
соединения,способные к окислению или
восстановлению, причем их окисленная
и восстановленная форма имеет разную
окраску. Таким образом, если редокс-индикатор
изменит окраску в пределах скачка
титрования и человек заметит это
изменение окраски, титрование можно
заканчивать и погрешноть составит в
пределах скачка титрования, то есть
![]() 0,1
.%
0,1
.%
Обозначим IndOx и IndRed- как сопряжённые окисленная и восстановленная формы индикатора.
Тогда для этой пары:
IndOx
+ ne![]() IndRed
IndRed
Уравнение Нернста (250С) без учета конкурирующех реакций и ионной силы имеет вид:
![]()
Таким образом выбор индикатора зависит от стандартного потенциала, при катором происходит окисление или восстановление одной формы в другую. При этом необходимо учитывать, что человеческий глаз может воспринимать окраску одной из форм при определённой концентрации её в растворе. Для двухцветного индикатора присутствие одной из форм заметно, если концентрация её примерно в 10 раз превышает концентрацию другой формы.
И тогда если
 , будет наблюдаться окраска восстановленной
формы, при этом потенциал равен
, будет наблюдаться окраска восстановленной
формы, при этом потенциал равен
![]()
А при
![]() будет наблюдаться окраска окисленной
формы и потенциал выражается соотношением
будет наблюдаться окраска окисленной
формы и потенциал выражается соотношением
![]()
Тогда в пределах потенциалов Е1-Е2- происходит смена окраски индикатора.
Этот интервал
называется интервалом перехода окраски
индикатора и обозначается
![]() .
.

Потенциал, при котором резко изменяется окраска индикатора называется показателем титрования индикатора и для большинства индикаторов он совпадает с серединой интервала, то есть с стандартным (формальным) потенциалом редокс-системы индикатора.
Таким образом, при достижении показателя титрования редокс-индикатора необходимо закончить титрование. Точка на кривой, когда заканчивается титрования, называется конечной точкой титрования (КТТ). Идеальным индикатором являлся бы тот, у которого показатель титрования совпадал бы с точкой эквивалентности. В общем случае при выборе индикатора учитывают следующее: интервал перехода окраски его должен лежать внутри скачка титрования (или частично накладывался на скачок титрования).
Итак, рассмотрим возможности применения редокс-индикатора дифениламина для фиксирования точки эквивалентности титрования железа бихроматом калия.
Интервал перехода окраски индикатора дифениламина Еинд =0,75±0,03В.
Отмечаем интервал перехода окраски индикатора на графике.
Видно, что интервал перехода частично накладывается на скачок второй кривой титрования, и следовательно его можно использовать при титровании железа бихроматом калия в присутствии защитной смеси. А если использовать дифениламин в качестве индикатора в отсутствии в титруемом растворе фосфорной кислоты погрешность титрования возрастет. Для количественной оценки индикаторной погрешности титрования необходимо ее рассчитывать.
Расчет индикаторной погрешности титровании.
Индикаторная погрешность вызвана несовпадением конечной точки титрования с точкой эквивалентности.
Индикаторная погрешность (ПТ ) - это систематическая погрешность и ее мы можем рассчитать.
ПТ=![]()
![]() или ПТ=+
или ПТ=+![]()
Мы можем выразить ПТ через степень оттитрованности.
ПT=-(l- f)∙100% или ПТ = +( f -1)∙100%
Знаки + и - мы ставим лишь для обозначения знака ошибки (положительная - когда раствор перетитрован, отрицательная - недотитрован).
Если мы окончили титрование при f =0,999, на сколько процентов раствор оттитрован, перетитрован или недотитрован?. На 0,1% раствор недотитрован. То есть по грешность титрования ПТ=-0,1%
Таким образом, если мы сможем вычислить, при каком значении степени оттитрованности мы заканчиваем титрование с; данным индикатором, мы можем вычислить погрешность титрования. Мы заканчиваем титрование когда резко изменилась окраска индикатора.Резко изменяется окраска индикатора когда достигнут окислительно-восстановительный потенциал сопряженной редокс-пары индикатора, то есть это значение показателя, то есть это значение показателя титрования редоксиндикатора Е°’инд-ox/ инд-red, которое дается в справочниках. Следовательно, зная потенциал системы титруемого раствора в момент КТТ по тем же формулам расчета кривой титрования мы можем рассчитать степень оттитрованносги (обратное действие расчету кривой титрования).
В качестве примера рассмотрим индикатор дифениламин и рассчитаем ПТ в присутствии защитной смеси и в отсутствии. Показатель титрования дифениламина равен 0,75 В. Потенциал КТТ 0,75 В, а потенциал в ТЭ равен 1,24 В, поэтому раствор будет недотитрован. Следовательно для расчета используем формулу для расчета кривой до точки эквивалентности.
В это уравнение подставляем потенциал системы в КТТ:

Расчет показывает, что в отсутствии защитной смеси при титроваие с индикатором дифениламином ПТ=-6%
А в присутствии-ПТ=-0,1%.
Выводы
Кривая титрования имеет s-образную форму. Наблюдаются 3 участка на кривой – пологий ход кривой титрования до скачка титрования, скачок титрования – в области точки эквивалентности, и пологий ход кривой титрования после кривой титрования.
Скачок титрования – это участок на кривой титрования, когда раствор недотитрован на 0,1% и перетитрован на 0,1%. То есть скачок титрования задается точностью, с которой мы хотим оттитровать анализируемое соединение.
По кривой титрования мы видим, что скачок титрования лежит в области потенциалов от 0,95 до 1,31 и составляет 0,36 В.
Факторы, влияющие на скачок окислительно-восстановительного титрования
Величина скачка зависит от разницы формальных и ОВ потенциалов полуреакций, и следовательно величина скачка зависит от всех тех факторов, которые влияют на эти потенциалы (ионная сила, конкурирующие реакции осадкообразование, комплексообразование, pH раствора, температура.
Влияние pH раствора на величину скачка титрования.Так как в титриметрической реакции участвует кислородсодержащая частица – бихромат-ион – pH будет влиять именно на ОВ потенциал пары Cr2O72-/ 2Cr3+. Небольшое изменение концентрации ионов водорода вызовет большое изменение ОВ потенциала. Увеличение кислотности титруемого раствора значительно повышает окислительно-восстановительный потенциал системы бихромат/хром трехвалентный (правая ветвь кривой смещается вверх) и скачок титрования возрастает. Это достигается введением в титруемый раствор серной кислоты 1 моль/литр.
Влияние конкурирующей реакции комплексообразования (Fe3+) c дигидрофосфат ионом.ОВ потенциал уменьшился на 0,1 В и вся левая ветвь смещается вниз на 0,1 В, а скачок титрования при этом увеличивается.
Введение серной кислоты в титруемый раствор повышает потенциал системы бихромат ионов, а введение фосфорной кислоты понижает потенциал системы железа, что очень сильно увеличивает скачок титрования. Смесь серной и фосфорной кислот называется – защитная смесь. В отсутствии защитной смеси оттитровать железо бихроматом калия невозможно.
3. Влияние разбавления на скачок титрования.Разбавление (увеличение объема титруемого раствора) повышает ОВ потенциал системы бихромат иона. В общем случае мы можем пренебречь изменение объема титруемого раствора