
- •Расчетно-графическое задание по титриметрии
- •Содержание:
- •1. Сущность титриметрии
- •2.1. Кислотно-основное титрование
- •2.2. Вывод формул для расчета pH
- •2.5. Выбор индикатора
- •2.6. Индикаторная погрешность
- •2.7. Выводы
- •3.1.Окислительно-восстановительное титрование (редоксометрия)
- •3.2. Вывод формул для расчета окислительно-восстановительного потенциала
- •3.5. Выбор индикатора
- •3.6. Индикаторная погрешность
- •3.7. Выводы
- •4. Литература:
2.5. Выбор индикатора
Для фиксирования конца титрования используют визуальные (титрование с индикатором, цветным или флуоресцентным) и инструментальные методы (потенциометрическое, амперометрическое, фотометрическое титрование). Цветные индикаторы в кислотно-основном титровании – это слабые органические кислоты и основания, протонированные и непротонированные формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (например, метиловый оранжевый) индикаторы.
Схематически равновесие в растворе индикатора можно представить как кислотно-основную реакцию:
HIn
+ H2O
![]() In
− + H3O+
In
− + H3O+
К индикаторам предъявляют ряд требований:
1) индикатор должен обладать высоким светопоглощением так, чтобы окраска даже его небольшого количества была заметна для глаза. Большая концентрация индикатора может привести к расходу на него титранта;
2) переход окраски должен быть контрастным;
3) область перехода окраски должна быть как можно уже.
Середина области перехода окраски индикатора (при этом рН = рКа) называется показателем индикатора (рТ) и фактически отождествляется с КТТ. Выбирают индикатор для титрования так, чтобы область перехода входила в скачок титрования. Границы скачка титрования определяются заданной точностью.
В нашем случае мы титруем раствор аммиака соляной кислотой, ТЭ = 5,12. Следовательно, нужно использовать индикатор с рТ максимально приближенным к 5,12. Скачок титрования равен ∆рН = 6,25 – 4,00 = 2,25. Интервал перехода индикатора должен лежать в пределах от 4,00 до 6,25, или быть максимально приближенным к скачку. Наиболее удовлетворяющий этим требованиям будет индикатор метиловый красный (цвет меняется из красного в желтый):
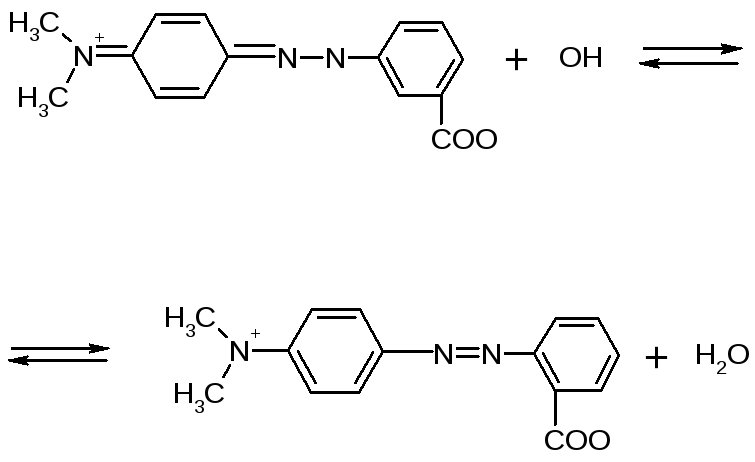
2.6. Индикаторная погрешность
Индикаторная погрешность вызвана несовпадением КТТ с ТЭ.
Индикаторная погрешность (ПТ) – это систематическая погрешность, которую можно рассчитать.
При титровании раствор аммиака будет перетитрован. Поэтому для вычисления индикаторной погрешности используем формулу для расчета рН после ТЭ. Найдем чему равно значение степени оттитрованности:

Найдем
![]() :
:
![]()
Т.к. раствор
перетитрован индикаторная погрешность
будет со знаком плюс. Используя найденные
значения и формулу
![]() ,
рассчитаем погрешность титрования:
,
рассчитаем погрешность титрования:
![]()
2.7. Выводы
1. ТЭ не совпадает с точкой нейтральности, а лежит в кислой области.
2. Скачок титрования значительно меньше, чем при титровании сильного основания сильной кислотой той же концентрации. В случае титрования 0,1 М раствора аммиака скачок составляет 2,25 рН, а в случае титрования 0,1 М раствора щелочи (например, NaOH) он равен 6 рН.
3. Скачок титрования зависит от силы протолитов. Чем слабее основание, тем меньше скачок титрования.
4. С уменьшением концентрации титруемого раствора и увеличением температуры, скачок титрования уменьшается.
5. Для титрования используют индикаторы, рТ которых лежат в кислой среде (например, метиловый красный).
3.1.Окислительно-восстановительное титрование (редоксометрия)
В редоксометрии используются реакции окисления – восстановления, связанные с переходом электронов от одного иона (молекулы) к другому. Вещество, теряющее электроны, в этих реакциях является восстановителем, а приобретающее – окислителем; первое вещество окисляется, а второе – восстановливается.
Вос1
- е
![]()
![]() Ок1
Ок2
+ е
Ок1
Ок2
+ е
![]() Вос2
---------------------------------------------------------
Вос1
+ Ок2
Вос2
---------------------------------------------------------
Вос1
+ Ок2
![]() Ок1
+ Вос2
Ок1
+ Вос2
При редоксометрическом титровании концентрации участвующих в реакции веществ или ионов все время изменяются. Должен, следовательно, изменяться и окислительно – восстановительный потенциал раствора (Е).
