
- •Министерство народного образования
- •1. Титриметрические методы
- •1.1. Сущность титриметрии
- •1.2. Кривые титрования
- •1.3. Кислотно-основное титрование
- •2. Вывод формул рН при титровании сильного основания(kон) сильной кислотой (hCl)
- •3. Кривая титрования 0,01 м раствора koh
- •0.01 М раствором hCl
- •4. Выбор индикатора
- •5. Погрешность титрования
- •6. Вывод по кривой титрования
- •7. Общая характеристика кривой титрования
- •8. Вывод формул расчета потенциала
- •9. Таблица значений потенциала системы
- •11. Выбор индикатора
- •12. Погрешность титрования
- •13. Выводы по кривой титрования
- •14. Список литературы:
7. Общая характеристика кривой титрования
Объект
титрования – анион-восстановитель.
Метод титрования – цериметрия. В
дальнейшем будет рассматриваться
титрование раствора Fe2+
(FeSO4)
с молярной концентрацией эквивалента
0,1 М эквимолярным раствором
![]() .
.
При титровании в растворе проходит реакция (с соответствующими полуреакциями).
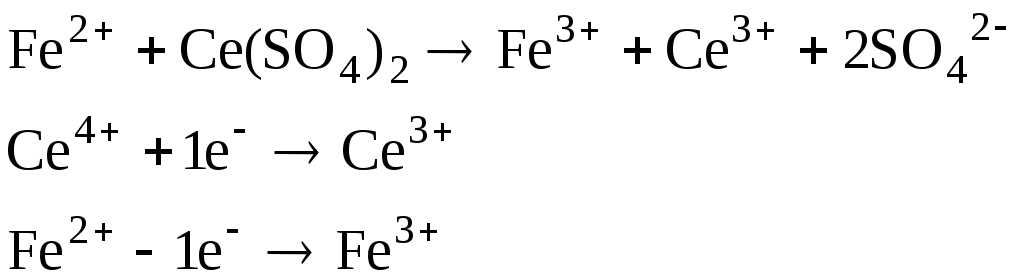
Уравнения
соответствующих формальных потенциалов
выводятся из уравнения Нернста. Так,
для окислительно-восстановительной
пары
![]()
![]()
![]()
Формальный потенциал пары будет определять следующее уравнение (коэффициент активности γ=1), зависящее от pH среды:
![]()
При вычислении используется молярная концентрация эквивалента C=0,1 M как для титранта, так и для титруемого вещества.
8. Вывод формул расчета потенциала
Кривую окислительно-восстановительного титрования можно условно разделить на три этапа. К первому этапу относится расчет окислительно-восстановительного потенциала при степени оттитрованности меньше 1.
При добавлении каждой порции титранта в растворе устанавливается равновесие E1=E2. Рассмотрим уравнения Нернста, записанные для этих двух систем:
![]()
![]()
Нет принципиальной разницы, по какому из уравнений вести расчет потенциала системы, однако удобнее вести расчет потенциала до ТЭ по полуреакции с участием титруемого вещества, а после ТЭ - по полуреакции с участием титранта.
Примем коэффициент активности за 1 и рассмотрим уравнение потенциала системы.
![]()
При
этом
![]() ;
;
![]()
![]() .
.
Учитывая,
что
![]() выражение примет вид
выражение примет вид
![]() .
.
Второй этап рассмотрения кривой титрования – расчет потенциала системы в точке эквивалентности, где концентрации сопряженных форм полуреакций окисления титруемого вещества и восстановления титранта ничтожно малы. Поэтому для вычисления потенциала используют формальный прием. Уравнения полуреакций складывают, предварительно умножив их на количество электронов, участвующих в полуреакции.
![]() ,
где [Ox]
и [Red]
– концентрации ионов, входящих в
сопряженные пары для данной реакции.
Учитывая, что по стехиометрии реакции
,
где [Ox]
и [Red]
– концентрации ионов, входящих в
сопряженные пары для данной реакции.
Учитывая, что по стехиометрии реакции
![]() ,
,
![]() .
.
К
третьему этапу кривой титрования
относится участок с f>1.
Принимая во внимание вышесказанное,
расчет удобнее проводить исходя из
потенциала системы
![]() ,
приняв коэффициенты активности за 1.
Тогда уравнение потенциала системы
будет выглядеть следующим образом:
,
приняв коэффициенты активности за 1.
Тогда уравнение потенциала системы
будет выглядеть следующим образом:
![]()
Так
как![]() ,
и
,
и![]()
![]()
Учитывая,
что
![]() выражение примет вид
выражение примет вид
![]() .
.
9. Таблица значений потенциала системы
|
№ |
f |
Состав раствора |
Формула расчета E |
Значен E, В |
|
1 |
0,1 |
|
|
0,72 |
|
2 |
0,5 |
0,77 | ||
|
3 |
0,9 |
0,83 | ||
|
4 |
0,99 |
0,89 | ||
|
5 |
0,999 |
0,95 | ||
|
6 |
1 |
|
|
1,26 |
|
|
|
|
|
|
|
7 |
1,001 |
|
|
1,56 |
|
8 |
1,01 |
1,62 | ||
|
9 |
1,1 |
1,68 | ||
|
10 |
1,5 |
1,72 |
Величина
скачка потенциала
![]()
10. Кривая титрования 0,1М раствора Fe2+ 0.1M раствором Ce(SO4)2
