Зависимость сродства к электрону атома от атомного номера элемента
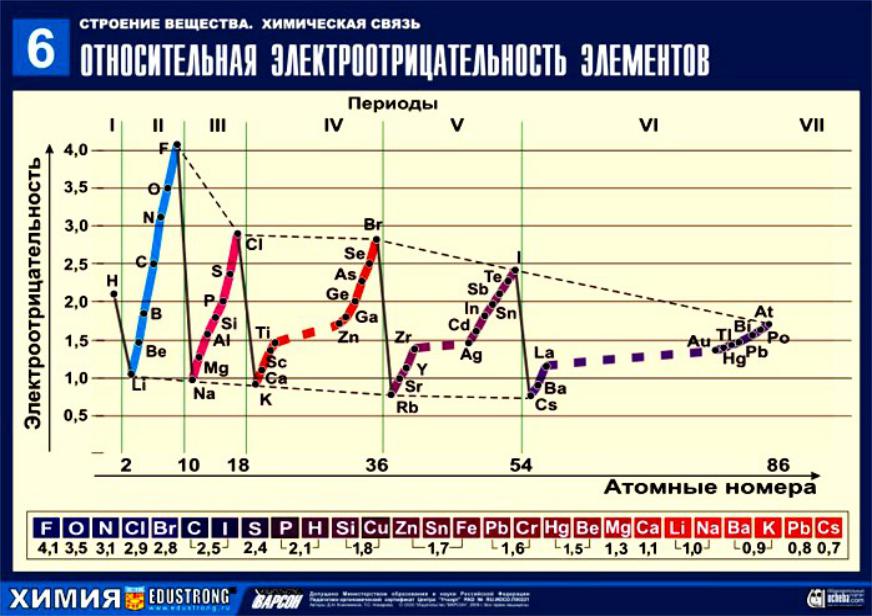
Электроотрицательность атомов
Электроотрицательность ( ) — фундаментальное химическое
свойство атома, количественная характеристика способности атома в молекуле притягивать к себе общие электронные пары.
Теоретическое определение электроотрицательности было предло- жено американским физиком Р. Малликеном. Исходя из положения о том, что способность атома в молекуле притягивать к себе электроны зависит от энергии ионизации атома и его сродства к электрону, он предложил соотношение для электроотрицательности атома
χ 12 (IA EA )
где IA и EA энергия ионизации атома и его сродство к электрону.
Лайнус Полинг ввел собственную шкалу электроотрицательностей, в которой максимальную имеет фтор ( F = 4,1), а минимальную — цезий ( Cs
= 0,7 ).
Широко используют также шкалу Оллреда и Рокоу, в которой элек- троотрицательность рассчитывают по формуле
χ 0,359Z/r2 0,744
где Z - эффективный заряд ядра по Слэйтеру, r -атомный ковалентный |
радиус. |
31 |
|