
- •Курс «Общая химия»
- •Лекция № 7
- •Автор теории электролитической диссоциации – Сванте Аррениус
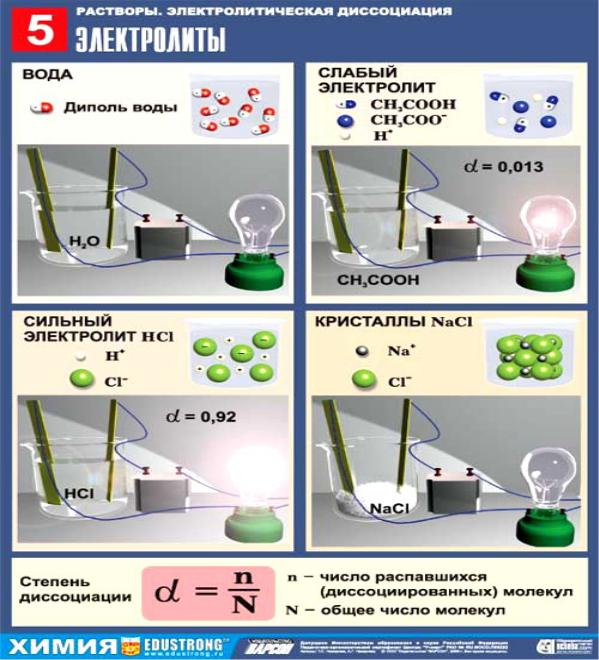
- •Электролиты - это вещества, растворы (и расплавы) которых проводят электрический ток.
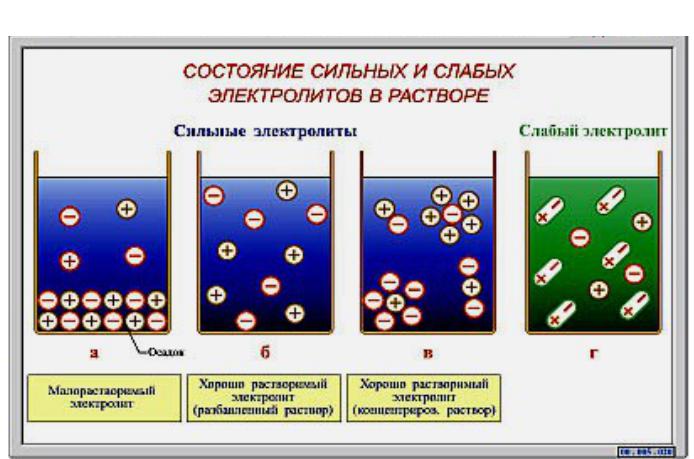
- •В зависимости от степени диссоциации ( ) на ионы электролиты
- •Из-за сильного взаимодействия ионов в концентрированных растворах сильных электролитов вместо концентраций исполь- зуются
- •Коэффициент активности иона тем меньше, чем больше ионов в растворе, т. е. чем
- •Молекулы слабых электролитов даже в сильно разбавленных растворах не полностью диссоциированы на ионы,
- •Константы диссоциации слабых кислот и оснований
- •Если выразить равновесные концентрации ионов через кон- центрацию слабого электролита C и его
- •Многоосновные кислоты и основания диссоциируют ступен- чато. Каждая ступень диссоциации характеризуется своей константой.
- •Благодарю за внимание
Курс «Общая химия»
Лектор: проф.Боева Майсара Каримовна
Башкирский государственный университет Кафедра неорганической химии
1
Лекция № 7
ХИМИЯ РАСТВОРОВ
(Сильные и слабые электролиты)
2

Автор теории электролитической диссоциации – Сванте Аррениус
(1859 – 1927); лауреат Нобелевской премии 1903 г. |
3 |
|
Электролиты - это вещества, растворы (и расплавы) которых проводят электрический ток.
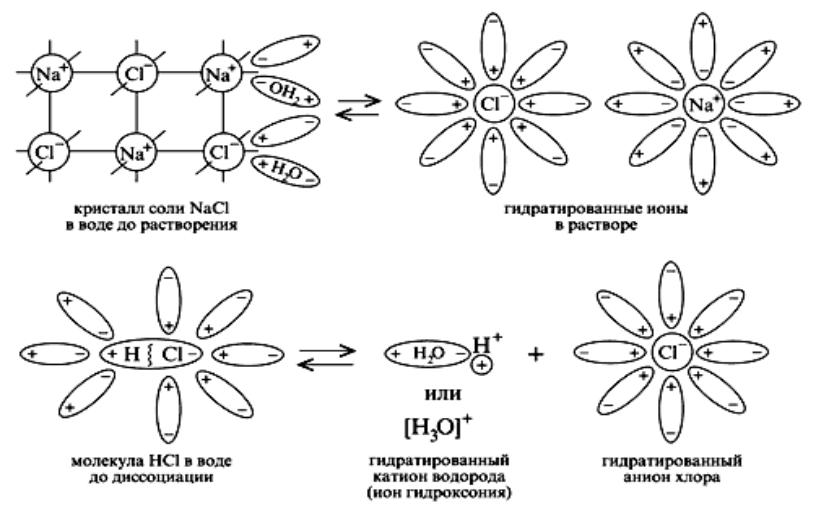
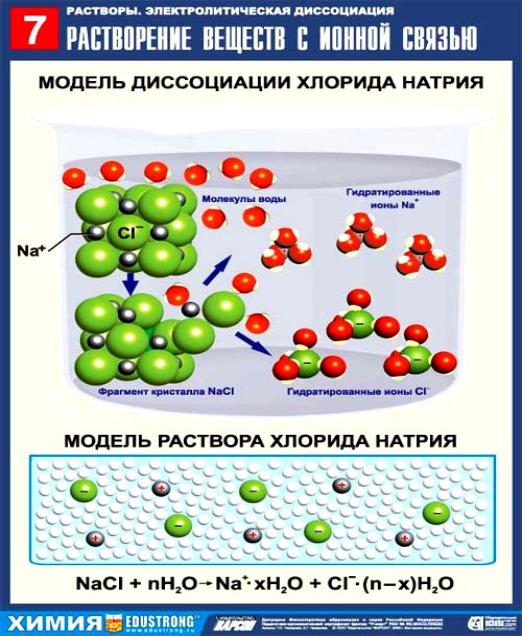
Электролитическая диссоциация - процесс распада электро- литов в растворе на ионы под действием полярных молекул растворителя (чаще всего воды).
4
5
В зависимости от степени диссоциации ( ) на ионы электролиты
подразделяются на
cильные, > 0,3 |
|
|
|
средней силы, 0,03 |
0,3 |
||
слабые, < 0,03 |
|
|
|
α |
|
n |
n – число распавшихся молекул |
N |
N – общее число молекул |
||
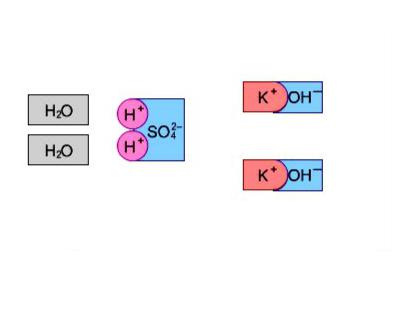
К сильным электролитам относятся: почти все соли; кислоты - НСl, НВr, НI, НNО3, Н2SО4, HClO4 и др.; щелочи (кроме NН4ОН).
Растворы сильных электролитов не содержат недиссоциирован- ных молекул; степень диссоциации сильных электролитов 1.
Слабыми электролитами являются: почти все органические кислоты и основания, вода; некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и
др.; некоторые нерастворимые гидроксиды металлов: Fe(OH)3,
Zn(OH)2 и др., а также гидроксид аммония NH4OH. |
6 |
7
Из-за сильного взаимодействия ионов в концентрированных растворах сильных электролитов вместо концентраций исполь- зуются активности ионов (а):
a = .C, |
|
где - коэффициент активности иона (мера взаимодействия |
|
ионов в растворе). При С 0, 1, а С. |
8 |

Коэффициент активности иона тем меньше, чем больше ионов в растворе, т. е. чем сильнее взаимодействие между ними. Он зависит от ионной силы раствора I:
I 12 i Ci zi2 ,
где С – концентрация, z – заряд всех ионов в растворе.
lgγ Az2 
 I
I
Уравнение Дебая-Хюккеля
А– коэффициент, характеризующий растворитель; для воды
А= 0,5 при 25 ºС.
Для NaCl в 0,001 М растворе I = 0,001, = 0,965; в 0,01 М раст- воре I = 0,01, = 0,902; в 0,1 М растворе I = 0,1, = 0,778; в 1 М растворе I = 1, = 0,658.
Для Na2SO4 в 0,001 М растворе = 0,887, в 0,01 М растворе
= 0,714, в 0,1 М растворе = 0,453, в 1 М растворе = 0,204.
9
Молекулы слабых электролитов даже в сильно разбавленных растворах не полностью диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. Важнейшей характеристикой слабого электролита (BAn) является константа диссоциации Кд.
BAn B+ + An
|
[B ][An- ] |
|
|
|
Kд |
[BAn] |
|
|
|
|
|
|
|
|
Для слабых кислот и оснований |
|
|
||
HAn H+ + An |
|
|||
BOH B+ + OH |
|
|||
KHAn [H ][An- ] |
|
KBOH |
[B ][OH- ] |
|
[HAn] |
|
|
[BOH] |
|
pKHAn = -lgKHAn |
|
pKBOH = -lgKBOH |
10 |
|
