
- •Министерство образования и науки Российской Федерации
- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •1.1.1 Теоретические пояснения
- •1.1.2 Примеры решения типовых задач
- •1.1.3 Варианты задач по теме 1.1
- •1.2. Основные законы химии
- •1.2.1 Стехиометрические законы
- •1.2.2 Газовые законы химии
- •1.2.3 Варианты задач по теме 1.2
- •2.1.1 Химическая кинетика
- •2.1.1.1 Теоретические пояснения
- •2.1.1.2 Примеры решения типовых задач
- •2.1.1.3 Варианты задач по теме 2.1.1
- •2.1.2 Химическое равновесие
- •2.1.2.1 Теоретические пояснения
- •2.1.2.2 Примеры решения типовых задач
- •2.1.2.3 Варианты задач по теме 2.1.2
- •2.2. Растворы
- •2.2.1 Теоретические пояснения
- •II. Концентрационный способ:
- •2.2.2 Примеры решения типовых задач
- •2.2.3 Варианты задач по теме 2.2
- •Рекомендуемая литература
1.1.2 Примеры решения типовых задач
Задача 1. Напишите уравнения реакций образования всех возможных кислых и основных солей: Fe(OH)3 + H3PO4 →
Решение: Кислые или основные соли образуются при неполной нейтрализации многоосновной кислоты (кислые) или многокислотного основания (основные).
Трехосновная отрофосфорная кислота H3PO4 может образовать три вида солей: средняя соль - ортофосфаты, с кислотным основанием PO43-, и два вида кислых солей - дигидроортофосфаты - Н2PO4- и гидроортофосфаты- НPO42-.
Трехкислотное основание гидроксид железа (III) может образовать 4 вида солей: средняя соль – с катионом железа (III) Fe3+, и три вида основных солей – с катионом гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза (III) Fe(OH)2+ . Возможно и образование смешанной соли с катионами гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза(III).
Таким образом, теоретически можно предсказать, что могут быть образованы 2 вида кислых солей и 3 вида основных.
Для
образования кислых солей необходимо,
чтобы основание было в избытке, то есть
мольное отношение
![]() .
То есть, возможны варианты
.
То есть, возможны варианты![]() ,
,![]() и
и![]() .
В соответствие с этим напишем эти три
уравнения.
.
В соответствие с этим напишем эти три
уравнения.
2Fe(OH)3
+ H3PO4
→ [Fe(OH)
![]() Fe(OH)2]
PO4
+
3H2O
Fe(OH)2]
PO4
+
3H2O
ортофосфатгидроксодигидроксожелеза (III)
3Fe(OH)3 + 2H3PO4 → [Fe(OH)]3 (PO4)2 + 6H2O
ортофосфатгидроксожелеза (III)
3Fe(OH)3 + H3PO4 → [Fe(OH)2]3 (PO4) + 3H2O
ортофосфатдигидроксожелеза (III)
Для
образования кислых солей необходимо,
чтобы в реакционной среде кислота была
в избытке. То есть, возможны варианты
![]() и
и![]() и
и![]() .
В соответствие с этим напишем эти три
уравнения.
.
В соответствие с этим напишем эти три
уравнения.
Fe(OH)3
+ 2H3PO4
→ Fe[HPO4![]() H2PO4]
+
3H2O
H2PO4]
+
3H2O
гидроортофосфатдигидроортофосфатжелеза (III)
2Fe(OH)3 + 3H3PO4 → Fe2 (НPO4)3 + 6H2O
ортофосфатгидроксожелеза (III)
Fe(OH)3 + 3H3PO4 → Fe (Н2PO4)3 + 6H2O
ортофосфатдигидроксожелеза (III)
Если студент затрудняется в определении структуры или брутто формулы образовавшейся соли, то можно прибегнуть к схематической формы решения задачи. Рассмотрим пример образования гидроортофосфатдигидроортофосфатжелеза (III) взаимодействием одной моли Fe(OH)3 и двух молей H3PO4.
 H
– O
H
– O

 H
– O
– P=O
H
– O
H
– O
– P=O
H
– O



 O
– H
H
– O
O
P=O
O
– H
H
– O
O
P=O
F

 e
– O – H + H – O→
Fe –
O
+ 3H2O
e
– O – H + H – O→
Fe –
O
+ 3H2O

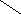 O
– H H – O – P=O О
O
– H H – O – P=O О
 H
– O H – O – P=O
H
– O H – O – P=O
H – O
Задача 2. Имея в распоряжении только калий, воду, воздух и фосфор, получите максимальное число минеральных удобрений.
Решение.
2К
+ 2Н2О
→2КОН + Н2![]()
Воздух →N2 (78%) + О2 (21%)
N2
+ 3Н2
![]() 2NH3
2NH3
![]()
N2+
O2![]() 2NO2
2NO2
2NO + O2→ 2NO2
4NO2 + O2+ 2H2O → 4HNO3
HNO3+ NH3→ NH4NO3 (нитрат аммония или аммиачная селитра)
4Р + 5О2 → 2Р2О5
Р2О5 + 3Н2О → 2Н3РО4
2Н3РО4 + 3NH3 → (NH4 )Н2РО4 + (NH4 )2НРО4 (аммофос)
Н3РО4 + 3КОН → 3Н2О +К3РО4 (ортофосфат калия)
КОН + HNO3→ КNO3 (нитрат калия или калийная селитра)
Задача 3. На примере ортофосфата гидроксокальция покажите химизм последовательного перехода основной соли в кислую (дигидроортофосфата кальция). Назовите все соли.
Решение.
(СаОН)3РО4 + 2Н3РО4→ 6Н2О + Са3(РО4)2
ортофосфата гидроксокальция ортофосфата кальция
Са3(РО4)2 + Н3РО4 → 3СаНРО4
гидроортофосфат кальция
СаНРО4 + Н3РО4 → Са(Н2РО4)2
дигидроортофосфат кальция
Задача 4. Имеются отдельные пробирки с растворами хлоридов алюминия, аммония, кальция и железа (II). По каким признакам и химическими превращениями можно установить содержание каждой пробирки? Приведите уравнения химических реакций.
Решение: Отбираем некоторую часть от этих растворов и помещаем их в пронумерованные (1,2, 3 и 4) пробирки.
Ко всем 4 пробиркам по порциям добавляем раствор гидроксида натрия. В трех из этих пробирок постепенно, по мере добавления гидроксида натрия, появляется осадок. При этом, допустим в пробирке №1 осадок имеет зеленоватую окраску, которая при стоянии буреет. Следовательно, в этой пробирке находился железа (II).
FeCl2
+ 2NaOH
→ Fe(OH)2![]() + 2NaCl
+ 2NaCl
зеленый
4Fe(OH)2
+ O2
+
2H2O
→
4Fe(OH)3![]()
коричневый
В
пробирке №2 выпал белый осадок, который
в избытке щелочи не растворяется.
Следовательно, в пробирке №2 находился
раствор хлорида кальция. СаCl2
+ 2NaOH
→ Са(OH)2
![]() +
2NaCl
+
2NaCl
белый
В
пробирке №3 выпал белый осадок, который
в избытке щелочи растворился. Следовательно,
в пробирке №3 находился раствор хлорида
алюминия. AlCl3
+ 3NaOH
→ Al(OH)3
![]() +
3NaCl
+
3NaCl
белый
Al(OH)3 + NaOH (изб.) → Na[Al(OH)4]
В пробирке № 4, где не выпал осадок, по методу исключения, находился хлорид аммония. Для проверки, содержимое пробирки слегка нагреваем . При этом появляется характерный запах аммиака, а мокрая лакмусовая индикаторная бумаг синеет от паров аммиака.
NH4Cl + NaOH→ NH4OH + NaCl
NH4OH
![]() NH3
NH3
![]() +
H2O
+
H2O
Доказано, что в пробирке №4 находился раствор хлорида аммония.
Задача 5. Каким одним реактивом можно распознать кристаллические вещества сульфита натрия, сульфида натрия, нитрита натрия карбоната кальция и карбоната натрия, находящиеся в отдельных банках без этикеток? Приведите химизм процессов установления химического состава этих веществ.
Решение: Берем пронумерованные пробирки (№1-5), и из банок с соответствующими номерами, отсыпаем несколько кристаллов вещества. Все пробирки до половины заполняем водой и во все пробирки медленно добавляем концентрированный раствор серной кислоты.
Допустим, что в пробирке №1, где находилась водная суспензия нерастворимого в воде вещества. При добавлении серной кислоты наблюдается бурное выделение газа, осадок в начале растворяется и со временем, после прекращения выделения осадка, образуется белый, мелкодисперсный осадок. Эти наблюдения позволяют заключить, что в банке №1 находится карбонат кальция (мел или известняк).
СаСО3 + Н2SO4 → Са SO4 + [Н2СО3]*
[Н2СО3]
→ СО2![]() + Н2O
+ Н2O
* В химии квадратными скобками изображают химически неустойчивые при обычных условиях соединения.
Допустим, в пробирке № 2 наблюдается выделение бесцветного газа, не обладающим характерным запахом. Следовательно, в пробирке №2 находится карбонат натрия.
Na2СО3
+ Н2SO4
→ Na2SO4
+ Н2O
+ СО2![]()
Допустим, в пробирке №3 наблюдается выделения газа с характерным едким запахом, который на воздухе буреет. Следовательно, в банке №3 находится нитрит натрия.
2NaNO2+ Н2SO4 → Na2SO4 + [НNO2]
[НNO2]
→ NO![]() + Н2O
+ Н2O
2NO
+ O2
→
2NO2![]()
бурый газ
Допустим, в пробирке № 4 выделяется газ, с характерным неприятным запахом тухлых яиц. При этом раствор мутнеет и со временем выпадает желтый порошок.
Наблюдение показывают, что в банке № 4 находится сульфид натрия.
Na2S
+ Н2SO4
→
Na2SO4
+
H2S
![]()
запах тухлых яиц
3H2S+
Н2SO4→
4Н2О
+ 4S![]()
желтый порошок
В последней пробирке наблюдаются выделение газа c резким запахом горелых спичек. Следовательно, в банке №5 находится сульфит натрия.
Na2SО3 + Н2SO4 → Na2SO4 + [H2SО3]
[H2SО3]
→ SO2
![]() + Н2О
+ Н2О
