
- •Министерство образования и науки Российской Федерации
- •Общие методические указания
- •Студент, не сдавший ргр, до экзамена (зачёта) не допускается.
- •1.1.1 Теоретические пояснения
- •1.1.2 Примеры решения типовых задач
- •1.1.3 Варианты задач по теме 1.1
- •1.2. Основные законы химии
- •1.2.1 Стехиометрические законы
- •1.2.2 Газовые законы химии
- •1.2.3 Варианты задач по теме 1.2
- •2.1.1 Химическая кинетика
- •2.1.1.1 Теоретические пояснения
- •2.1.1.2 Примеры решения типовых задач
- •2.1.1.3 Варианты задач по теме 2.1.1
- •2.1.2 Химическое равновесие
- •2.1.2.1 Теоретические пояснения
- •2.1.2.2 Примеры решения типовых задач
- •2.1.2.3 Варианты задач по теме 2.1.2
- •2.2. Растворы
- •2.2.1 Теоретические пояснения
- •II. Концентрационный способ:
- •2.2.2 Примеры решения типовых задач
- •2.2.3 Варианты задач по теме 2.2
- •Рекомендуемая литература
2.1.2.3 Варианты задач по теме 2.1.2
Реакция CO + Cl2
 COCl2
протекает в объеме 10 литров. Состав
равновесной смеси: 14г СО; 35,6г Cl2;
и 49,5г СOCl2.
Вычислить константу равновесия реакции.
COCl2
протекает в объеме 10 литров. Состав
равновесной смеси: 14г СО; 35,6г Cl2;
и 49,5г СOCl2.
Вычислить константу равновесия реакции.Константа равновесия реакции FeO + CO
 Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и ]CO2]
=0,01.
Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и ]CO2]
=0,01.Найти константу равновесия реакции N2O4
 2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.
2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.Константа равновесия реакции А+В
 С+D
равна единице. Начальная концентрация
[А]о=0,02моль/л.
Сколько процентов А подвергается
превращению, если начальные концентрации
[В] равны 0,02; 0,1 и 0,2 моль/л?
С+D
равна единице. Начальная концентрация
[А]о=0,02моль/л.
Сколько процентов А подвергается
превращению, если начальные концентрации
[В] равны 0,02; 0,1 и 0,2 моль/л?Для реакции Н2 + Вr2
 2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.
2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
Равновесие в системе H2+I2
 2HI
установилось равновесие при следующих
концентрациях (моль/л): [H2]
= 0,025; [I2]
= 0,005; [HI]
= 0,09. Определить исходные концентрации
иода и водорода.
2HI
установилось равновесие при следующих
концентрациях (моль/л): [H2]
= 0,025; [I2]
= 0,005; [HI]
= 0,09. Определить исходные концентрации
иода и водорода.При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2
 СО + Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.
СО + Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.Оксид углерода (II) и хлор были помещены в закрытый сосуд при постоянной температуре. Начальные их концентрации равны 1 моль/л, давление в сосуде 101325 Па. В результате реакции CO + Cl2
 COCl2
к моменту равновесия осталось 50% СО.
Каково давление в сосуде при равновесии?
COCl2
к моменту равновесия осталось 50% СО.
Каково давление в сосуде при равновесии?Как изменится давление при наступлении равновесия в реакции синтеза аммиака в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода составляют соответственно 2 и 6 моль/л и если равновесие наступит тогда, когда прореагирует 10% первоначального количества азота?
После смешения газов А и В в системе А + В
 С +D
, устанавливается равновесие при
следующих концентрациях (моль/л): [B]
= 0,05; [C]
= 0,02. Константа равновесия реакции равна
4х103.
Найти исходные концентрации А и В.
С +D
, устанавливается равновесие при
следующих концентрациях (моль/л): [B]
= 0,05; [C]
= 0,02. Константа равновесия реакции равна
4х103.
Найти исходные концентрации А и В.Константа равновесия реакции синтеза этилацетата этерификацией уксусной кислоты в жидкой фазе равна 4. Сколько сложного эфира получится, если в исходной смеси взять 100г этанола и 20г уксусной кислоты.
Константа химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана-0,07Мпа, этилена-0,02 Мпа
и водорода 0,02 МПа.
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана-0,07Мпа, этилена-0,02 Мпа
и водорода 0,02 МПа.Константа химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,02 Мпа
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,02 МпаКонстанта равновесия реакции FeO + CO
 Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и ]CO2]
=0,01.
Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и ]CO2]
=0,01.Найти константу равновесия реакции N2O4
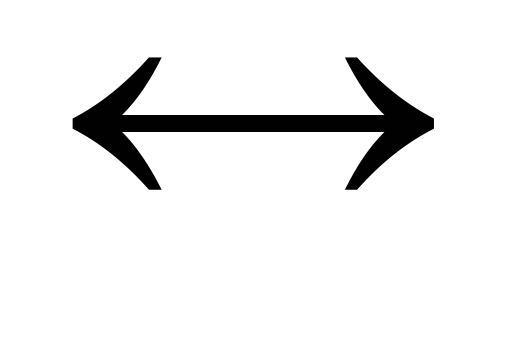 2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.
2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.Константа равновесия реакции А+В
 С+D
равна единице. Начальная концентрация
[А]=0,02моль/л. Сколько процентов А
подвергается превращению, если начальные
концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
С+D
равна единице. Начальная концентрация
[А]=0,02моль/л. Сколько процентов А
подвергается превращению, если начальные
концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?Для реакции Н2 + Вr2
 2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.
2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
Равновесие в системе H2+I2
 2HI
установилось равновесие при следующих
концентрациях (моль/л):[H2]=0,025;
[I2]
=0,005; [HI]=0,09.
Определить исходные концентрации иода
и водорода.
2HI
установилось равновесие при следующих
концентрациях (моль/л):[H2]=0,025;
[I2]
=0,005; [HI]=0,09.
Определить исходные концентрации иода
и водорода.При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2
 СО +Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.
СО +Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.Как изменится давление при наступлении равновесия в реакции синтеза аммиака в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода составляют соответственно 2 и 6 моль/л и если равновесие наступает тогда, когда прореагирует 10% первоначального количества азота?
После смешения газов А и В в системе А + В
 С +D
, устанавливается равновесие при
следующих концентрациях (моль/л):
[B]=0,05;
[C]=0,02.
Константа равновесия реакции равна
4х103.
Найти исходные концентрации А и В.
С +D
, устанавливается равновесие при
следующих концентрациях (моль/л):
[B]=0,05;
[C]=0,02.
Константа равновесия реакции равна
4х103.
Найти исходные концентрации А и В.Константа равновесия реакции синтеза этилацетата этерификацией уксусной кислоты в жидкой фазе равна 4. Сколько сложного эфира получится, если в исходной смеси взять 100г этанола и 20г уксусной кислоты.
Константа химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,07Мпа, этилена-0,02 Мпа
и водорода 0,02 МПа.
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,07Мпа, этилена-0,02 Мпа
и водорода 0,02 МПа.Константа химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,02 Мпа
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,02 МпаКонстанта химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,01 Мпа
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,05Мпа, этилена-0,01 Мпа
и водорода 0,01 МпаКонстанта химического равновесия реакции С2H6(г)
 С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,06Мпа, этилена-0,02 Мпа
и водорода 0,01 МПа
С2Н4(г)
+ Н2(г)
при 1500 К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: Этана-0,06Мпа, этилена-0,02 Мпа
и водорода 0,01 МПа Константа равновесия реакции FeO + CO
 Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и [CO2]
=0,01.
Fe
+ CO2
при некоторой температуре равна 0,5.
Найти равновесные концентрации СО и
СО2,
если начальные концентрации этих
веществ составляли (моль/л): [CO]=
0,05 и [CO2]
=0,01.Найти константу равновесия реакции N2O4
 2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.
2NO2
, если начальная концентрация N2O4
составляет 0,08моль/л, а к моменту
наступления равновесия диссоцировало
50% N2O4
.Константа равновесия реакции А+В
 С+D
равна единице. Начальная концентрация
[А]о =
0,02моль/л. Сколько процентов А подвергается
превращению, если начальные концентрации
[В] равны 0,02; 0,1 и 0,2 моль/л?
С+D
равна единице. Начальная концентрация
[А]о =
0,02моль/л. Сколько процентов А подвергается
превращению, если начальные концентрации
[В] равны 0,02; 0,1 и 0,2 моль/л?Для реакции Н2 + Вr2
 2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.
2HBr
при некоторой температуре К=1. Определить
состав (% по объему) равновесной смеси,
если исходная смесь состояла из 3 молей
Н2
и 2 молей брома.В начальный момент реакции синтез аммиака концентрации были (моль/л):N2 =1,5; H2 =2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
Равновесие в системе H2+I2
 2HI
установилось равновесие при следующих
концентрациях (моль/л):[H2]=0,025;
[I2]
=0,005; [HI]=0,09.
Определить исходные концентрации иода
и водорода.
2HI
установилось равновесие при следующих
концентрациях (моль/л):[H2]=0,025;
[I2]
=0,005; [HI]=0,09.
Определить исходные концентрации иода
и водорода.При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2
 СО + Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.
СО + Н2О.
Константа равновесия при некоторой
температуре равна 0,1. Сколько процентов
СО2
превратится в СО, если смешать 2 моля
СО2
и 1 моль Н2
при той же температуре.
