
Атеросклероз (патофизиологические аспекты)
.pdf
23
Вероятно, именно по этой причине они откладываются в богатых коллагеном тканях – сухо- жилиях, коже и развивающихся атеросклеротических поражениях.
Особенностью скэвенджер-захвата является то, что поступление моди-
фицированных ЛП таким путем в клетку не регулируется или слабо регулиру-
ется по механизму отрицательной обратной связи. Содержание ХС в клетке
при этом линейно нарастает в зависимости от концентрации в окружающей среде ЛП, содержащих ХС. Несмотря на то, что поступление ХС в клетку путем скэ- венджер-захвата подавляет синтез собственно стерина, а также образование апо- В-Е рецепторов, это не спасает клетку от накопления в ней значительных коли- честв ХС, преимущественно в виде эфиров и, в меньшей степени, в виде свобод- ного ХС и кристаллов моногидрата. С помощью скэвенджер-рецепторов осущест- вляется захват и других химически модифицированных ЛПНП (сукцинилирован- ных, ацетоацетилированных, обработанных малоновым диальдегидом и др.), а также ЛПНП, подвергнутых пероксидации. Помимо скэвенджер и классических апо-В,Е и ЛПВП-рецепторов, макрофаги имеют и ряд других рецепторов (рис. 5), в частности:
∙Рецепторы к β-ЛПОНП;
∙Рецепторы к декстран-сульфату, которые взаимодействуют с комплексом ЛПНП-гликозаминогликан;
∙Рецепторы к Fc –фрагменту Ig и к C3-компоненту комплемента, с помощью которых макрофаги могут захватывать иммунные комплексы, включающие апо-В-содержащие ЛП (ЛПНП) в качестве антигена.
Таким образом, макрофаги, имея большой набор рецепторов, могут связы- вать, интернализировать и разрушать как нативные, так и различным образом мо- дифицированные ЛП. Захват нативных ЛП происходит при участии классиче-
ских апо-В,Е-рецепторов, и этот тип захвата никогда не сопровождается нако- плением ЭХС в клетке.
Захват модифицированных ЛП протекает по типу скэвенджер-захвата и сопровождается накоплением в клетке ЭХС и трансформацией макрофагаль-
ной клетки в «пенистую». Последняя представляет собой клетку, «нафарширо- ванную» липидными вакуолями, содержащими ЭХС. Факт значительного накоп-
ления ЭХС в макрофагах и трансформации этих клеток в пенистые при захвате модифицированных ЛПНП позволил сделать вывод, имеющий большое теорети-
ческое и практическое значение: ответственными за развитие атеросклеро-
тического процесса являются не нативные, а модифицированные в организме человека ЛПНП. Именно такие ЛП должны рассматриваться как атероген-
ные. Нативные ЛПНП, вопреки широко распространенному заблуждению, не от- носятся к атерогенным ЛП.
Атерогенность ЛПНП, выделенных из крови людей (как здоровых, так и больных атеро- склерозом), можно определить в лабораторных условиях. Для этого производят инкубацию ЛПНП, предварительно помеченных радиоактивным йодом, с культурами фибробластов и мак-
24
рофагов. Если выделенные ЛПНП активно захватываются макрофагами и слабо – фибробла- стами, то они – атерогенны, если наоборот, то – нет.
Основные разновидности модифицированных ЛП
1.Гликозилированные ЛПНП и ЛПВП, образующиеся в больших количествах при сахарном диабете. Гликозилирование ЛПНП приводит к блокированию ли- зиновых остатков апо-В, что нарушает их взаимодействие с В,Е-рецепторами, замедляет их катаболизм и ведет к развитию ДЛП и гиперхолестеринемии. Гликозилирование ЛПВП, напротив, ускоряет катаболизм этих частиц и сни- жает, тем самым их уровень в крови. Продукты превращения гликозилирован- ных ЛП также способствуют развитию атеросклероза: повышают проницае- мость эндотелия, усиливают адгезию на нем клеток крови, активируют хемо- таксис моноцитов/макрофагов и пролиферацию ГМК в артериальной стенке.
2.Перекисно-модифицированные ЛП. Перекисно-модифицированные ЛП, об- разовавшиеся в результате активации ПОЛ, с участием моноцитов/макрофагов, эндотелиоцитов, ГМК и других клеток, характеризуются следующими призна- ками:
∙слабо распознаются В, Е-рецепторами и легко взаимодействуют со скэ- венджер-рецепторами; при этом макрофаги быстро трансформируются в пенистые клетки;
∙в силу своей цитотоксичности легко повреждают эндотелиальный покров артерий;
∙ингибируют репарацию эндотелия;
∙стимулируют хемотаксис моноцитов в интиму.
3.Аутоиммунные комплексы липопротеин-антитело. Одной из причин обра-
зования антител к ЛП может служить их модификация (пероксидация, десиа- лирование, гликозилирование и т.д.) и приобретение ими аутоантигенных свойств. С этой точки зрения, атеросклероз представляет собой хронический иммуновоспалительный процесс, протекающий по типу гиперчувствительно- сти замедленного типа, при котором антигенным стмулом служат перекисно- модифицированные ЛП. При этом различные цитокины – медиаторы иммун- ного ответа координируют клеточные взаимодействия в очаге атеросклероти- ческого повреждения (А.Н. Климов, 1986).
Кроме перечисленных выше, в организме образуются также такие модифи-
цированные формы ЛП как десиалированные ЛПНП, продукты ограниченного протеолиза ЛП, комплексы ЛПНП с гликозаминогликанами и агрегированные ЛП.
Взаимодействие модифицированных ЛП с макрофагами
Среди клеток РЭС особую роль в захвате модифицированных ЛП и разви- тии атеросклероза играют моноциты/макрофаги. Появление в крови и последую-
25
щее проникновение в интиму модифицированных ЛПНП вызывает миграцию в артериальную стенку моноцитов крови, превращающихся в макрофаги. Мигра- цию моноцитов можно рассматривать как своеобразный ответ на «сигнал о по- мощи» со стороны клеток сосудистой стенки. В настоящее время установлена природа этого «сигнала»; это – различные хемотаксические факторы, стимули- рующие миграцию моноцитов. В качестве таких факторов, образующихся в сосу- дистой стенке, могут выступать перекисно-модифицированные ЛПНП, тромбин, фибронектин, тромбоцитарный фактор роста, калликреин, фрагменты эластина и коллагена. Большая часть макрофагов, мигрировавшая в сосудистую стенку из крови, захватывает модифицированные ЛП, трансформируется в пенистые клетки
ипогибает. При этом в интиме накапливаются ЭХС и кристаллы моногидрата ХС. Очаговые скопления ХС приводят к развитию липидных пятен, а затем и атеро- склеротических бляшек.
Таким образом, при ДЛП нормальная защитная функция макрофагов, на- правленная на захват и удаление из сосудистой стенки модифицированных (т.е., в той или иной степени, чужеродных) ЛП, превращается в реакцию, запускающую
иусиливающую атеросклеротический процесс.
Взаимодействие модифицированных ЛП с эндотелием
По отношению к ЛП плазмы крови эндотелий выполняет следующие функ- ции: 1) является местом действия липопротеинлипазы; 2) участвует в катаболизме ЛПНП путем их взаимодействия с апо-В,Е- и скэвенджер-рецепторами; 3) прямо или косвенно участвует в накоплении ЛП в субэндотелиальном пространстве (ин- тиме) при атеросклерозе.
Несмотря на то, что эндотелиальные клетки имеют на своей мембране скэ- венджер-рецепторы и активно захватывают модифицированные ЛПНП, они нико- гда не накапливают в цитоплазме ЭХС и не трансформируются в подобие пени- стых клеток. Вероятно, это обусловлено высокой ретроэндоцитозной активностью этих клеток, которая позволяет эффективно удалять избыток ЭХС. Кроме того, ХС из мембран эндотелиальных клеток откачивается и ЛПВП.
Однако при гиперхолестеринемии происходит заметное усиление везику- лярного транспорта ЛП через эндотелиальные клетки в интиму. При этом клетки эндотелия активно захватывают как нормальные, так и модифицированные ЛПНП и путем ретроэндоцитоза выводят эти ЛП из просвета сосуда в интиму. Это сопровождается усиленным делением эндотелиальных клеток даже без повреж- дения целостности эндотелиального покрова. Вероятно, данная реакция эндотелия
в условиях гиперхолестеринемии и связанного с ней ухудшения реологии крови является своеобразной «перестраховкой» (или гиперкомпенсацией) на случай возможного повреждения. Таким образом, повышение скорости пролиферации
эндотелия способствует повышенному захвату делящимися клетками плазменных ЛП (нативных и модифицированных), а, следовательно, и липидной инфильтра- ции интимы. По мере дальнейшего прогрессирования процесса происходит по-
26
вреждение эндотелия, что еще больше стимулирует его репаративную регенера- цию и связанный с ней захват различных ЛПНП.
Взаимодействие модифицированных ЛП с ГМК
Хорошо известно, что одной из характерных морфологических черт атеро- склероза является пролиферация ГМК в интиме. Ряд исследователей (в частности, авторы моноклональной теории) придает этому явлению ведущее значение в раз- витии атеросклероза. Другие – рассматривают ее как вторичную защитную реак- цию в ответ на накопление в интиме ХС. В очаге атеросклеротического пораже- ния развиваются три важнейших реакции со стороны ГМК: 1) миграция в инти- му; 2) их пролиферация в интиме и 3) превращение ГМК из сократительного
типа клеток в синтезирующий.
Миграция ГМК из медии в интиму происходит под влиянием хемотаксиче- ских факторов, продуцируемых эндотелиальными клетками, макрофагами и фиб- робластами интимы. Стимуляторами выработки и секреции хемотаксических факторов для этих клеток служат модифицированные ЛП.
Пролиферация ГМК обусловлена действием различных факторов роста, в частности, тромбоцитарного фактора роста.
Мигрировавшие и пролиферирующие в интиме ГМК резко изменяют свои свойства и превращаются из нормальных клеток контрактильного типа в «мета- болически активные» или клетки «синтезирующего типа». Такие клетки спо- собны синтезировать коллаген, эластин, гликозаминогликаны, т.е. соединитель- нотканный матрикс будущей атеросклеротической бляшки. Кроме того, ГМК синтезирующего типа секретируют хемотаксические факторы для моноцитов, а также свой собственный фактор роста, что значительно способствует прогресси- рованию атеросклеротической бляшки.
Взаимодействие нормальных ГМК и клеток синтезирующего типа с моди- фицированными ЛП существенно отличается. Нормальные ГМК не имеют на мембране скэвенджер-рецепторов и поэтому не способны захватывать или как-
либо взаимодействовать с модифицированными ЛП.
Однако ГМК синтезирующего типа, несмотря на то, что они, как и нор- мальные ГМК, не имеют скэвенджер-рецепторов, способны при взаимодействии с модифицированными ЛПНП, накапливать ЭХС в цитоплазме, напоминая при микроскопии пенистые клетки.
Суммируя приведенные выше, а также и другие данные, можно предста-
вить основные клеточные механизмы развития атеросклеротического процесса в виде следующей таблицы.

27
Таблица 2
Молекулярно-клеточные взаимодействия в атерогенезе
Кровь |
|
|
Сосудистая стенка |
|
|
|
|
Атерогенные ЛП: |
Потеря атромбогенности эндотелия |
адгезия тром- |
|||||
Патологические и |
боцитов |
|
|
|
|
|
|
Модифицированные |
Снижение секреции ЭРФ |
адгезия на эндотелии |
|||||
|
тромбоцитов и моноцитов. |
|
|
|
|
||
|
Секреция эндотелием моноцитарного хемотаксиче- |
||||||
|
ского фактора и фактора роста |
адгезия моноци- |
|||||
|
тов, миграция и пролиферация ГМК. |
|
|
|
|||
|
Повышение проницаемости эндотелиального покрова, |
||||||
|
отек субэндотелиального слоя. |
|
|
|
|||
|
Некротические изменения |
участков эндотелия, сек- |
|||||
|
реция факторов роста, усиление репаративной регене- |
||||||
|
рации и захвата атерогенных ЛП . |
|
|
|
|||
|
Накопление липидов в макрофагах и ГМК |
|
пе- |
||||
|
нистые клетки. |
|
|
|
|
|
|
|
Стимуляция макрофагов и лимфоцитов |
секреция |
|||||
|
цитокинов |
клеточные реакции интимы. |
|
|
|||
|
|
|
|||||
Моноциты |
Адгезия на эндотелии и проникновение в интиму. |
|
|||||
|
Связывание ЛПНП на поверхности эндотелия и |
про- |
|||||
|
никновение их в интиму. |
|
|
|
|
||
|
Накопление липидов |
пенистые клетки. |
|
|
|||
|
Выделение ферментов (коллагеназа и эластаза) |
|
|||||
|
расщепление межуточного вещества интимы. |
|
|||||
|
Секреция монокинов |
дальнейшая адгезия моно- |
|||||
|
цитов на эндотелии, рост и пролиферация ГМК и |
||||||
|
фибробластов, изменение фенотипа ГМК (превраще- |
||||||
|
ние в клетки синтезирующего типа). |
|
|
|
|||
|
|
|
|
|
|
||
Тромбоциты |
Адгезия на эндотелии: |
|
|
|
|
||
|
Связывание и модификация ЛП на поверхности эндо- |
||||||
|
телия. |
|
|
|
|
|
|
|
Экспрессия специфических белков. |
|
|
|
|||
|
Дальнейшая адгезия тромбоцитов; стимуляция эндо- |
||||||
|
цитоза |
накопление липидов в макрофагах |
|
|
|||
|
Пенистые клетки; выделение фактора роста |
|
|||||
|
Миграция и пролиферация ГМК, изменение феноти- |
||||||
|
па ГМК (превращение в клетки синтезирующего ти- |
||||||
|
па). |
|
|
|
|
|
|
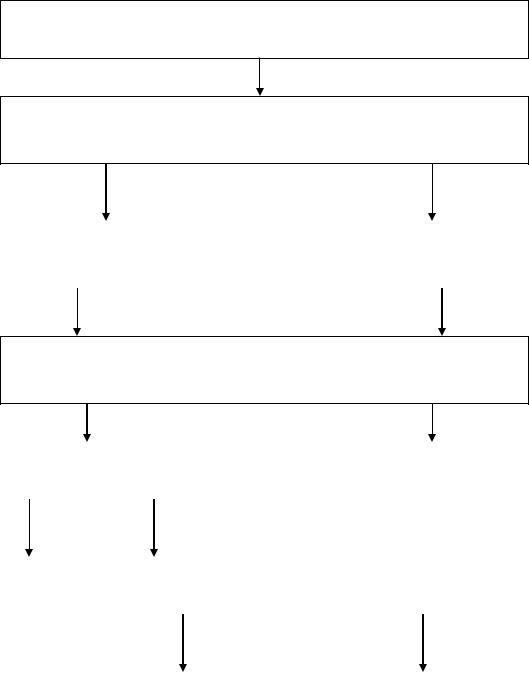
28
Патогенез ранних морфологических изменений в сосудистой стенке при атеросклерозе представлен на схеме 2. (по В.А. Нагорневу, 1988 г.).
Схема 2.
Избыточное отложение плазменных нативных и модифициро-
ванных ЛП в интиме артерий
Последующая модификация ЛП в интиме, пролиферация кле- ток, нерегулируемый захват модифицированных ЛП клетками
Трансформация клеток |
|
Разрастание соеди- |
в пенистые клетки |
|
нительной ткани |
|
|
|
Дегенерация (разрушение пенистых клеток, лизис и фрагментация волокнистых структур)
Липидное пятно |
|
Очаговый некроз |
|
|
|
Регрессия |
|
Прогрессирующая атеросклеротическая |
|
|
бляшка |
|
|
|
Осложнение поражение |
|
Фиброзная бляшка |
|
|
|
29
9 ФАКТОРЫ РИСКА АТЕРОСКЛЕРОЗА
Атеросклероз – мультифакторное заболевание, возникновение которого свя- зано с многими факторами риска. Большинство кардиологов разделяют все фак- торы риска атеросклероза на управляемые и неуправляемые. Данный подход позволяет не просто констатировать наличие тех или иных факторов риска в це- лой популяции, но и осуществлять, по возможности, коррекцию конкретных фак- торов риска у конкретного индивидуума.
Кнеуправляемым факторам риска относят: ∙ Возраст ∙ Пол
∙ Наследственность
Куправляемым факторам риска относят:
∙Нерациональное питание с высоким содержанием животных жиров
∙Артериальная гипертензия
∙Ожирение
∙Курение
∙Интоксикация
∙Множественные психо-эмоциональные стрессы
∙Гиподинамия
∙Гипофункция щитовидной железы, сахарный диабет, нарушение толерантно- сти к глюкозе и т.д.
Несмотря на наличие множества факторов риска, все они в той или иной сте- пени вызывают главное нарушение, являющееся ведущей причиной развития атеросклероза – атерогенную дислипопротеинемию (ДЛП). Таким образом, ДЛП является не фактором риска атеросклероза, а фактором, непосредственно обусловливающим развитие этого заболевания.
10. ДИСЛИПОПРОТЕИНЕМИИ
Под термином «дислипопротеинемии» (ДЛП) понимают изменения в со- держании ЛП в плазме крови, характеризующиеся их повышением, снижением или практически полным отсутствием. Сюда же относят случаи появления в кро- ви необычных или патологических ЛП. Таким образом, понятие ДЛП охватывает все разновидности изменения уровня ЛП в крови. Более узким термином являет- ся гиперлипопротеинемия, отражающая увеличение содержания какого-либо класса ЛП в крови.
Первую классификацию ДЛП в 1967 г. предложил Д. Фредриксон, а в 1970г. ее одобрила ВОЗ. Классификация ДЛП по ВОЗ и характеристика клинических проявлений различных ДЛП представлены в таблицах.
30
Таблица 3
Классификация дислипопротеинемий
(ВОЗ, 1970)
|
Тип |
Холестерин |
|
Холестерин |
Триглицери- |
Нарушения уровня |
||
|
ДЛП |
плазмы |
|
ЛПНП |
ды плазмы |
|
липопротеинов |
|
|
I |
Повышен |
|
Понижен или |
Повышены |
Избыток хиломикро- |
||
|
|
|
|
в норме |
|
нов |
||
|
IIа |
Повышен |
|
Повышен |
В норме |
Избыток ЛПНП |
||
|
|
или в норме |
|
|
|
|
|
|
|
IIб |
Повышен |
|
Повышен |
Повышены |
Избыток ЛПНП и |
||
|
|
|
|
|
|
ЛПОНП |
||
|
III |
Повышен |
|
Понижен или |
Повышены |
Избыток ремнантов |
||
|
|
|
|
в норме |
|
хиломикронов и |
||
|
|
|
|
|
|
ЛППП |
||
|
IV |
Повышен |
|
В норме |
Повышены |
Избыток ЛПОНП |
||
|
|
или в норме |
|
|
|
|
|
|
|
V |
Повышен |
|
В норме |
Повышены |
Избыток хиломикро- |
||
|
|
|
|
|
|
нов и ЛПОНП |
||
|
|
|
|
|
|
|
Таблица 4 |
|
|
|
Клиническая характеристика дислипопротеинемий |
||||||
|
|
|
|
|
|
|
||
|
Тип |
|
|
Кл инические проявления |
|
|
||
|
ДЛП |
|
|
|
|
|
|
|
|
I |
Приступы болей в животе, панкреатит, гепато-спленомегалия, кожные |
|
|||||
|
|
ксантомы, липемия ретины. |
|
|
|
|
||
|
|
Первичные проявляются в детском возрасте. |
|
|
|
|||
|
|
Р и с к р а з в и т и я а т е р о с к л е р о з а н е в ы ш е , |
ч е м в о б щ е й |
|
||||
|
|
п о п ул я ц и и |
|
|
|
|
|
|
|
II. |
Сухожильные |
и кожные ксантомы резко выражены, |
ксантелазмы, ли- |
|
|||
|
|
пидная дуга роговицы. |
|
|
|
|
||
|
|
В ы с о к и й р и с к р а з в и т и я а т е р о с к л е р о т и ч е с к и х п о р а - |
|
|||||
|
|
ж е н и й а о р т ы , к о р о н а р н ы х с о с уд о в , к л а п а н о в с е р д ц а . |
|
|||||
|
|
Первичные проявляются в детском возрасте. |
|
|
|
|||
|
III. |
Кожные и сухожильные ксантомы желтого или оранжевого цвета, ксан- |
|
|||||
|
|
телазмы, липидная дуга роговицы, иногда острый панкреатит. |
|
|||||
|
|
В ы с о к и й р и с к р а з в и т и я а т е р о с к л е р о з а к о р о н а р н ы х , |
|
|||||
|
|
ц е р е б р а л ь н ы х и п е р и ф е р и ч е с к и х а р т е р и й . |
|
|||||
|
|
Часто сопутствует ожирение, сахарный диабет, гиперурикемия. |
|
|||||
|
|
Первичные проявляются в 20-30 лет у мужчин и 30-45 лет у женщин |
|
|||||

31
IV. Иногда ксантомы, липидная дуга роговицы, острый панкреатит. Часто сопутствуют ожирение, нарушение толерантности к глюкозе, гиперури- кемия, артериальная гипертония. Повышен риск развития коронарного атеросклероза.
V.Те же, что и при I типе, но возникают у взрослых и очень редко в детст- ве.
Сопутствующие – сахарный диабет, подагра, артериальная гипертония. Р и с к р а з в и т и я а т е р о с к л е р о з а н е в ы ш е , ч е м в о б щ е й
п о п у л я ц и и
|
Этиологические факторы дислипопротеинемий |
Таблица 5 |
|||
|
|
|
|||
|
|
|
|
|
|
Тип |
|
Первичные |
Вторичные |
||
ГЛП |
|
|
|
|
|
I. |
Семейная |
гиперхиломикронемия |
Сахарный диабет, панкреатит, |
|
|
|
дефицит липопротеинлипазы |
парапротеинозы, |
системная |
|
|
|
дефицит апо-С-II |
красная волчанка |
|
|
|
|
ингибитор липопротеинлипазы |
|
|
|
|
II. |
Семейная гиперхолестеринемия (IIа) |
Избыточное потребление холе- |
|
||
|
Семейная комбинированная |
стерина и насыщенных ЖК, ги- |
|
||
|
Гиперхолестеринемия (IIб) |
потиреоз, нефротический син- |
|
||
|
дефицит рецепторов ЛПНП |
дром, миелома, порфирия, прием |
|
||
|
Полигенная гиперхолестеринемия |
андрогенных стероидов в высо- |
|
||
|
|
|
ких дозах |
|
|
III. |
Семейная дисбеталипопротеинемия |
Гипотиреоз, сахарный диабет, |
|
||
|
Мутантный аллель апо-Е |
ожирение, парапротеинозы |
|
||
IV. |
Семейная |
комбинированная гипер- |
Сахарный диабет, ожирение, ги- |
|
|
|
липидемия |
|
потиреоз, подагра, нефротиче- |
|
|
|
Семейная гипертриглицеридемия |
ский синдром, парапротеинозы, |
|
||
|
|
|
злоупотребление |
алкоголем, |
|
|
|
|
прием кортикостероидов и про- |
|
|
|
|
|
тивозачаточных таблеток, со- |
|
|
|
|
|
держащих эстрогены |
|
|
V. |
Семейная гипертриглицеридемия |
Сахарный диабет, нефротиче- |
|
||
|
дефицит Апо С – II |
ский синдром, подагра, миелома, |
|
||
|
|
|
злоупотребление |
алкоголем, |
|
|
|
|
прием тиазидовых |
диуретиков, |
|
|
|
|
бета-адреноблокаторов, проти- |
|
|
|
|
|
возачаточных таблеток |
|
|

32
Современная классификация ДЛП отражает основные причины возникно- вения ДЛП. Согласно ей, ДЛП подразделяются на первичные и вторичные. В свою очередь, первичные ДЛП бывают: а) наследственно обусловленные (5-7%) и б) обусловленные факторами внешней среды (питанием) (более 90%). Вторичные ДЛП представляют нарушения ЛП-обмена, возникающие вследствие различ- ных соматических заболеваний (сахарный диабет, нефротический синдром и т.д.). Подробный перечень основных этиологических факторов первичных и вторич- ных ДЛП представлен в таблице 5.
Наибольший вклад в возникновение первичных ДЛП вносит фактор пита- ния: он обусловливает более 90% первичных ДЛП в популяции (рис.9).
Рис. 9. Процентное распределение содержания ХС в крови и распространенность различных типов гиперхолестеринемии (ГХС) в популяции (по А.Н.Климову, Н.Г.Никульчевой, 1995).
Питание современного человека в развитых странах имеет три важнейших компонента атерогенности:
∙Избыток ХС
∙Избыток насыщенных жиров
∙Избыток калорий.
Эпидемиологические исследования, проведенные в крупных выборках населения семи стран (Голландия, Греция, Италия, США, Финляндия, Югославия и Япония) показали, что уро- вень ХС плазмы крови людей четко коррелирует с распространенностью коронарного атеро- склероза. В Югославии и Японии были выявлены изоляты с очень низким уровнем ХС плазмы крови (около 160 мг/дл или 4,16 ммоль/л) и рекордно низкой смертностью от сердечно- сосудистых заболеваний (менее 5 случаев на 1000 населения за 10 лет). В Финляндии, где сред- нее содержание ХС в крови составляло 265 мг/дл или 6,89 ммоль/л, частота летальных инфарк- тов была в 14 (!) раз выше, чем в упомянутых изолятах. Эти же исследования показали взаимо- связь пищевых привычек и частоты инфаркта миокарда. Установлено, что высокие показатели потребления мяса, яиц, животных жиров, преобладающие в США, странах средней Европы, коррелируют с почти повсеместной распространенностью атерогенных ДЛП, тогда как в азиат- ских и африканских странах, где преобладает употребление рыбы и растительной пищи, ДЛП практически не встречаются. Яркий пример роли пищевого ХС и насыщенных жиров в разви- тии ИБС приводится в недавнем исследовании судьбы двух групп японцев, проживающих в Японии и Калифорнии. У японцев, живущих на родине, где преобладает рыбно-растительная диета, содержание ХС в крови оказалось минимальным – около 180 мг/дл (4,68 ммоль/л). У ка-
