
- •Глава 1. Общие положения
- •Глава 2. Особенности отдельных способов
- •Глава 3. Особенности рекламы отдельных видов товаров
- •Глава 4. Саморегулирование в сфере рекламы
- •Глава 5. Государственный надзор в сфере рекламы
- •Глава 6. Заключительные положения
- •Глава I. Общие положения
- •Глава II. Защита прав потребителей при продаже
- •Глава III. Защита прав потребителей при выполнении
- •Глава IV. Государственная и общественная защита
- •Глава 1. Общие положения
- •Глава 2. Полномочия федеральных органов исполнительной
- •Глава 3. Государственная фармакопея
- •Глава 4. Государственный контроль при обращении
- •Глава 5. Разработка, доклинические исследования
- •Глава 6. Осуществление государственной регистрации
- •Глава 7. Клинические исследования лекарственных
- •Глава 8. Производство и маркировка лекарственных средств
- •Глава 9. Ввоз лекарственных средств на территорию
- •Глава 10. Фармацевтическая деятельность
- •Глава 11. Уничтожение лекарственных средств
- •Глава 12. Государственное регулирование цен
- •Глава 13. Мониторинг безопасности лекарственных препаратов,
- •Глава 14. Информация о лекарственных препаратах
- •Глава 15. Ответственность за нарушение законодательства
- •Глава 16. Заключительные положения
- •Глава 1. Общие положения
- •Глава 2. Полномочия федеральных органов исполнительной
- •Глава 3. Государственная фармакопея
- •Глава 4. Государственный контроль при обращении
- •Глава 5. Разработка, доклинические исследования
- •Глава 6. Осуществление государственной регистрации
- •Глава 7. Клинические исследования лекарственных
- •Глава 8. Производство и маркировка лекарственных средств
- •Глава 9. Ввоз лекарственных средств на территорию
- •Глава 10. Фармацевтическая деятельность
- •Глава 11. Уничтожение лекарственных средств
- •Глава 12. Государственное регулирование цен
- •Глава 13. Мониторинг безопасности лекарственных препаратов,
- •Глава 14. Информация о лекарственных препаратах
- •Глава 15. Ответственность за нарушение законодательства
- •Глава 16. Заключительные положения
- •Глава 1. Общие положения
- •Глава 2. Организация и осуществление лицензирования
- •Глава 3. Заключительные положения и порядок вступления
- •Глава I. Общие положения
- •Глава II. Организационные основы деятельности
- •Глава III. Особенности деятельности,
- •Глава IV. Условия осуществления отдельных видов
- •Глава V. Использование наркотических средств
- •Глава VI. Противодействие незаконному обороту
- •Глава VII. Наркологическая помощь больным наркоманией
- •Глава VIII. Заключительные положения
- •Глава 1. Общие положения
- •Глава 2. Основные принципы охраны здоровья
- •Глава 3. Полномочия федеральных органов государственной власти, органов государственной власти субъектов Российской Федерации и органов местного самоуправления в сфере охраны здоровья
- •Глава 4. Права и обязанности граждан в сфере охраны здоровья
- •Глава 5. Организация охраны здоровья
- •Глава 6. Охрана здоровья матери и ребенка, вопросы семьи и репродуктивного здоровья
- •Глава 7. Медицинская экспертиза и медицинское освидетельствование
- •Глава 8. Медицинские мероприятия, осуществляемые в связи со смертью человека
- •Глава 9. Медицинские работники и фармацевтические работники, медицинские организации
- •Глава 10. Программа государственных гарантий бесплатного оказания гражданам медицинской помощи
- •Глава 11. Финансовое обеспечение в сфере охраны здоровья
- •Глава 12. Организация контроля в сфере охраны здоровья
- •Глава 13. Ответственность в сфере охраны здоровья
- •Глава 14. Заключительные положения
- •21 Октября 1997 г.
- •1. Общие положения
- •2. Основные правила изготовления жидких
- •3. Концентрированные растворы
- •4. Аптечные бюреточные установки и
- •1000 Г этилового спирта концентрации: 30, 40, 50,
- •60, 70, 80, 90, 95, 96%%
- •60, 70, 80, 90, 95%%
- •Глава 1. Общие положения
- •Глава 2. Технические регламенты
- •Глава 3. Стандартизация
- •Глава 4. Подтверждение соответствия
- •Глава 5. Аккредитация органов по сертификации
- •Глава 6. Государственный контроль (надзор)
- •Глава 7. Информация о нарушении требований
- •Глава 8. Информация о технических регламентах
- •Глава 9. Финансирование в области
- •Глава 10. Заключительные и переходные положения
- •Часть I
- •Часть II
Глава 13. Ответственность в сфере охраны здоровья
Статья 98. Ответственность в сфере охраны здоровья
1. Органы государственной власти и органы местного самоуправления, должностные лица организаций несут ответственность за обеспечение реализации гарантий и соблюдение прав и свобод в сфере охраны здоровья, установленных законодательством Российской Федерации.
2. Медицинские организации, медицинские работники и фармацевтические работники несут ответственность в соответствии с законодательством Российской Федерации за нарушение прав в сфере охраны здоровья, причинение вреда жизни и (или) здоровью при оказании гражданам медицинской помощи.
3. Вред, причиненный жизни и (или) здоровью граждан при оказании им медицинской помощи, возмещается медицинскими организациями в объеме и порядке, установленных законодательством Российской Федерации.
4. Возмещение вреда, причиненного жизни и (или) здоровью граждан, не освобождает медицинских работников и фармацевтических работников от привлечения их к ответственности в соответствии с законодательством Российской Федерации.
Глава 14. Заключительные положения
Статья 99. Признание не действующими на территории Российской Федерации отдельных законодательных актов Союза ССР и утратившими силу отдельных законодательных актов РСФСР и Российской Федерации (их отдельных положений)
1. Признать не действующими на территории Российской Федерации:
1) Закон СССР от 19 декабря 1969 года N 4589-VII "Об утверждении Основ законодательства Союза ССР и союзных республик о здравоохранении" (Ведомости Верховного Совета СССР, 1969, N 52, ст. 466);
2) Указ Президиума Верховного Совета СССР от 1 июня 1970 года N 5215-VII "О порядке введения в действие Основ законодательства Союза ССР и союзных республик о здравоохранении" (Ведомости Верховного Совета СССР, 1970, N 23, ст. 192);
3) Указ Президиума Верховного Совета СССР от 26 марта 1971 года N 1364-VIII "Об утверждении текста присяги врача Советского Союза и Положения о порядке принесения присяги" (Ведомости Верховного Совета СССР, 1971, N 13, ст. 145);
4) Указ Президиума Верховного Совета СССР от 18 июня 1979 года N 286-X "О внесении изменений и дополнений в Основы законодательства Союза ССР и союзных республик о здравоохранении" (Ведомости Верховного Совета СССР, 1979, N 25, ст. 438);
5) Указ Президиума Верховного Совета СССР от 15 ноября 1983 года N 10274-X "О дополнении текста присяги врача Советского Союза" (Ведомости Верховного Совета СССР, 1983, N 47, ст. 722);
6) пункт 4 раздела I Указа Президиума Верховного Совета СССР от 8 июня 1984 года N 340-XI "О внесении изменений и дополнений в некоторые законодательные акты Союза ССР" (Ведомости Верховного Совета СССР, 1984, N 24, ст. 422);
7) статью 1 Закона СССР от 27 ноября 1985 года N 3662-XI "О внесении изменений в некоторые законодательные акты СССР в связи с Основными направлениями реформы общеобразовательной и профессиональной школы и утверждением новой редакции Основ законодательства Союза ССР и союзных республик о народном образовании" (Ведомости Верховного Совета СССР, 1985, N 48, ст. 919);
8) Указ Президиума Верховного Совета СССР от 25 августа 1987 года N 7612-XI "О мерах профилактики заражения вирусом СПИД" (Ведомости Верховного Совета СССР, 1987, N 34, ст. 560);
9) Указ Президиума Верховного Совета СССР от 5 января 1988 года N 8282-XI "Об утверждении Положения об условиях и порядке оказания психиатрической помощи" (Ведомости Верховного Совета СССР, 1988, N 2, ст. 19);
10) Закон СССР от 26 мая 1988 года N 9004-XI "Об утверждении Указов Президиума Верховного Совета СССР о внесении изменений и дополнений в законодательные акты СССР" в части утверждения Указа Президиума Верховного Совета СССР от 5 января 1988 года "Об утверждении Положения об условиях и порядке оказания психиатрической помощи" (Ведомости Верховного Совета СССР, 1988, N 22, ст. 361);
11) Закон СССР от 23 апреля 1990 года N 1447-I "О профилактике заболевания СПИД" (Ведомости Съезда народных депутатов СССР и Верховного Совета СССР, 1990, N 19, ст. 324);
12) Постановление Верховного Совета СССР от 23 апреля 1990 года N 1448-I "О порядке введения в действие Закона СССР "О профилактике заболевания СПИД" (Ведомости Съезда народных депутатов СССР и Верховного Совета СССР, 1990, N 19, ст. 325);
13) Закон СССР от 23 апреля 1990 года N 1449-I "О внесении дополнения в Основы законодательства Союза ССР и союзных республик о здравоохранении" (Ведомости Съезда народных депутатов СССР и Верховного Совета СССР, 1990, N 19, ст. 326);
14) пункт 5 раздела I Закона СССР от 22 мая 1990 года N 1501-I "О внесении изменений и дополнений в некоторые законодательные акты СССР по вопросам, касающимся женщин, семьи и детства" (Ведомости Съезда народных депутатов СССР и Верховного Совета СССР, 1990, N 23, ст. 422).
2. Признать утратившими силу:
1) Постановление Верховного Совета РСФСР от 29 июля 1971 года "О введении в действие Закона РСФСР "О здравоохранении" (Ведомости Верховного Совета РСФСР, 1971, N 31, ст. 657);
2) Указ Президиума Верховного Совета РСФСР от 20 октября 1971 года "О порядке введения в действие Закона Российской Советской Федеративной Социалистической Республики о здравоохранении" (Ведомости Верховного Совета РСФСР, 1971, N 42, ст. 880);
3) пункт 4 Указа Президиума Верховного Совета РСФСР от 15 июля 1974 года "О внесении изменений и дополнений в некоторые законодательные акты РСФСР" (Ведомости Верховного Совета РСФСР, 1974, N 29, ст. 782);
4) Указ Президиума Верховного Совета РСФСР от 11 июля 1979 года "Об усилении борьбы с распространением венерических заболеваний" (Ведомости Верховного Совета РСФСР, 1979, N 29, ст. 712);
5) Закон РСФСР от 3 августа 1979 года "Об утверждении Указа Президиума Верховного Совета РСФСР "Об усилении борьбы с распространением венерических заболеваний" (Ведомости Верховного Совета РСФСР, 1979, N 32, ст. 792);
6) пункт 3 Указа Президиума Верховного Совета РСФСР от 18 января 1985 года "О внесении изменений и дополнений в некоторые законодательные акты РСФСР" (Ведомости Верховного Совета РСФСР, 1985, N 4, ст. 117);
7) раздел IV Указа Президиума Верховного Совета РСФСР от 1 октября 1985 года N 1524-XI "О внесении изменений и дополнений в некоторые законодательные акты РСФСР" (Ведомости Верховного Совета РСФСР, 1985, N 40, ст. 1398);
8) пункт 4 раздела I Указа Президиума Верховного Совета РСФСР от 29 января 1986 года N 2525-XI "Об изменении и признании утратившими силу некоторых законодательных актов РСФСР об административных правонарушениях" (Ведомости Верховного Совета РСФСР, 1986, N 6, ст. 175);
9) Указ Президиума Верховного Совета РСФСР от 6 августа 1986 года N 3785-XI "О внесении изменений и дополнений в некоторые законодательные акты РСФСР и утверждении Положения о лечебно-воспитательном профилактории для больных наркоманией" (Ведомости Верховного Совета РСФСР, 1986, N 33, ст. 919);
10) Основы законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 года N 5487-I (Ведомости Съезда народных депутатов Российской Федерации и Верховного Совета Российской Федерации, 1993, N 33, ст. 1318);
11) пункт 3 статьи 1 Федерального закона от 2 марта 1998 года N 30-ФЗ "О внесении изменений и дополнений в отдельные законодательные акты Российской Федерации в связи с принятием Федерального закона "О рекламе" (Собрание законодательства Российской Федерации, 1998, N 10, ст. 1143);
12) Федеральный закон от 20 декабря 1999 года N 214-ФЗ "О внесении изменения в статью 60 Основ законодательства Российской Федерации об охране здоровья граждан" (Собрание законодательства Российской Федерации, 1999, N 51, ст. 6289);
13) Федеральный закон от 2 декабря 2000 года N 139-ФЗ "О внесении изменений и дополнения в Основы законодательства Российской Федерации об охране здоровья граждан" (Собрание законодательства Российской Федерации, 2000, N 49, ст. 4740);
14) статью 11 Федерального закона от 10 января 2003 года N 15-ФЗ "О внесении изменений и дополнений в некоторые законодательные акты Российской Федерации в связи с принятием Федерального закона "О лицензировании отдельных видов деятельности" (Собрание законодательства Российской Федерации, 2003, N 2, ст. 167);
15) пункт 1 статьи 9 Федерального закона от 27 февраля 2003 года N 29-ФЗ "Об особенностях управления и распоряжения имуществом железнодорожного транспорта" (Собрание законодательства Российской Федерации, 2003, N 9, ст. 805);
16) статью 5 Федерального закона от 30 июня 2003 года N 86-ФЗ "О внесении изменений и дополнений в некоторые законодательные акты Российской Федерации, признании утратившими силу отдельных законодательных актов Российской Федерации, предоставлении отдельных гарантий сотрудникам органов внутренних дел, органов по контролю за оборотом наркотических средств и психотропных веществ и упраздняемых федеральных органов налоговой полиции в связи с осуществлением мер по совершенствованию государственного управления" (Собрание законодательства Российской Федерации, 2003, N 27, ст. 2700);
17) статью 22 Федерального закона от 29 июня 2004 года N 58-ФЗ "О внесении изменений в некоторые законодательные акты Российской Федерации и признании утратившими силу некоторых законодательных актов Российской Федерации в связи с осуществлением мер по совершенствованию государственного управления" (Собрание законодательства Российской Федерации, 2004, N 27, ст. 2711);
18) статью 35 Федерального закона от 22 августа 2004 года N 122-ФЗ "О внесении изменений в законодательные акты Российской Федерации и признании утратившими силу некоторых законодательных актов Российской Федерации в связи с принятием федеральных законов "О внесении изменений и дополнений в Федеральный закон "Об общих принципах организации законодательных (представительных) и исполнительных органов государственной власти субъектов Российской Федерации" и "Об общих принципах организации местного самоуправления в Российской Федерации" (Собрание законодательства Российской Федерации, 2004, N 35, ст. 3607);
19) Федеральный закон от 1 декабря 2004 года N 151-ФЗ "О внесении изменений в Основы законодательства Российской Федерации об охране здоровья граждан" (Собрание законодательства Российской Федерации, 2004, N 49, ст. 4850);
20) Федеральный закон от 21 декабря 2005 года N 170-ФЗ "О внесении изменения в статью 61 Основ законодательства Российской Федерации об охране здоровья граждан" (Собрание законодательства Российской Федерации, 2005, N 52, ст. 5583);
21) статью 5 Федерального закона от 31 декабря 2005 года N 199-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с совершенствованием разграничения полномочий" (Собрание законодательства Российской Федерации, 2006, N 1, ст. 10);
22) Федеральный закон от 2 февраля 2006 года N 23-ФЗ "О внесении изменения в статью 52 Основ законодательства Российской Федерации об охране здоровья граждан" (Собрание законодательства Российской Федерации, 2006, N 6, ст. 640);
23) статью 6 Федерального закона от 29 декабря 2006 года N 258-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с совершенствованием разграничения полномочий" (Собрание законодательства Российской Федерации, 2007, N 1, ст. 21);
24) статью 6 и пункт 2 статьи 33 Федерального закона от 18 октября 2007 года N 230-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с совершенствованием разграничения полномочий" (Собрание законодательства Российской Федерации, 2007, N 43, ст. 5084);
25) статью 15 Федерального закона от 23 июля 2008 года N 160-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с совершенствованием осуществления полномочий Правительства Российской Федерации" (Собрание законодательства Российской Федерации, 2008, N 30, ст. 3616);
26) статью 1 Федерального закона от 8 ноября 2008 года N 203-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам медико-психологической реабилитации военнослужащих" (Собрание законодательства Российской Федерации, 2008, N 45, ст. 5149);
27) статью 6 Федерального закона от 25 декабря 2008 года N 281-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации" (Собрание законодательства Российской Федерации, 2008, N 52, ст. 6236);
28) статью 7 Федерального закона от 24 июля 2009 года N 213-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации и признании утратившими силу отдельных законодательных актов (положений законодательных актов) Российской Федерации в связи с принятием Федерального закона "О страховых взносах в Пенсионный фонд Российской Федерации, Фонд социального страхования Российской Федерации, Федеральный фонд обязательного медицинского страхования и территориальные фонды обязательного медицинского страхования" (Собрание законодательства Российской Федерации, 2009, N 30, ст. 3739);
29) статью 1 Федерального закона от 25 ноября 2009 года N 267-ФЗ "О внесении изменений в Основы законодательства Российской Федерации об охране здоровья граждан и отдельные законодательные акты Российской Федерации" (Собрание законодательства Российской Федерации, 2009, N 48, ст. 5717);
30) статью 4 Федерального закона от 27 декабря 2009 года N 365-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с совершенствованием деятельности органов государственной власти субъектов Российской Федерации и органов местного самоуправления" (Собрание законодательства Российской Федерации, 2009, N 52, ст. 6441);
31) статью 1 Федерального закона от 27 июля 2010 года N 192-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в части повышения доступности лекарственного обеспечения жителей сельских поселений" (Собрание законодательства Российской Федерации, 2010, N 31, ст. 4161);
32) статью 2 Федерального закона от 28 сентября 2010 года N 243-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с принятием Федерального закона "Об инновационном центре "Сколково" (Собрание законодательства Российской Федерации, 2010, N 40, ст. 4969);
33) статью 6 Федерального закона от 18 июля 2011 года N 242-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам осуществления государственного контроля (надзора) и муниципального контроля" (Собрание законодательства Российской Федерации, 2011, N 30, ст. 4590).
Статья 100. Заключительные положения
1. До 1 января 2016 года:
1) право на осуществление медицинской деятельности в Российской Федерации имеют лица, получившие высшее или среднее медицинское образование в Российской Федерации в соответствии с федеральными государственными образовательными стандартами и имеющие сертификат специалиста;
2) право на занятие фармацевтической деятельностью в Российской Федерации имеют лица, получившие высшее или среднее фармацевтическое образование в Российской Федерации в соответствии с федеральными государственными образовательными стандартами и имеющие сертификат специалиста, а также лица, обладающие правом на занятие медицинской деятельностью и получившие дополнительное профессиональное образование в части розничной торговли лекарственными препаратами, при условии их работы в расположенных в сельских населенных пунктах, в которых отсутствуют аптечные организации, обособленных подразделениях медицинских организаций (амбулаториях, фельдшерских и фельдшерско-акушерских пунктах, центрах (отделениях) общей врачебной (семейной) практики), имеющих лицензию на осуществление фармацевтической деятельности;
3) лица, получившие медицинское или фармацевтическое образование, не работавшие по своей специальности более пяти лет, могут быть допущены к медицинской деятельности или фармацевтической деятельности в соответствии с полученной специальностью после прохождения обучения по дополнительным профессиональным образовательным программам (профессиональной переподготовки) и при наличии сертификата специалиста;
4) лица, получившие медицинское или фармацевтическое образование в иностранных государствах, допускаются к медицинской деятельности или фармацевтической деятельности после установления в Российской Федерации эквивалентности документов иностранных государств об образовании в порядке, установленном законодательством Российской Федерации об образовании, сдачи экзамена по специальности в порядке, устанавливаемом уполномоченным федеральным органом исполнительной власти, и получения сертификата специалиста, если иное не предусмотрено международными договорами Российской Федерации.
2. Сертификаты специалиста, выданные медицинским и фармацевтическим работникам до 1 января 2016 года, действуют до истечения указанного в них срока. Форма, условия и порядок выдачи сертификата специалиста устанавливаются уполномоченным федеральным органом исполнительной власти.
3. Медицинское и фармацевтическое образование осуществляется по профессиональным образовательным программам:
1) начального профессионального образования;
2) среднего профессионального образования;
3) высшего профессионального образования;
4) послевузовского профессионального образования - интернатура, ординатура, аспирантура, докторантура;
5) по дополнительным профессиональным образовательным программам - повышение квалификации, профессиональная переподготовка.
4. Подготовка по программам интернатуры обеспечивает приобретение специалистом необходимого уровня знаний, умений и навыков, а также квалификации, позволяющей занимать должности медицинских работников и фармацевтических работников. Продолжительность обучения в интернатуре не может превышать один год.
5. Подготовка по программам ординатуры обеспечивает приобретение специалистами знаний, умений и навыков, необходимых для осуществления профессиональной деятельности по определенной медицинской специальности или фармацевтической специальности, а также приобретение квалификации, позволяющей занимать должности медицинских работников и фармацевтических работников по определенной медицинской или фармацевтической специальности.
6. С 1 сентября 2017 года послевузовское медицинское и фармацевтическое образование может быть получено в ординатуре, аспирантуре и докторантуре.
7. До 1 января 2015 года финансовое обеспечение оказания специализированной медицинской помощи (за исключением высокотехнологичной медицинской помощи) в медицинских организациях, подведомственных федеральным органам исполнительной власти, государственным академиям наук, осуществляется за счет бюджетных ассигнований федерального бюджета и средств обязательного медицинского страхования в рамках территориальных программ обязательного медицинского страхования.
8. До 1 января 2015 года финансовое обеспечение полномочий Российской Федерации и субъектов Российской Федерации по оказанию скорой медицинской помощи осуществляется соответственно за счет бюджетных ассигнований федерального бюджета и бюджетных ассигнований бюджетов субъектов Российской Федерации и средств обязательного медицинского страхования в рамках территориальных программ обязательного медицинского страхования.
9. До 1 января 2015 года финансовое обеспечение высокотехнологичной медицинской помощи осуществляется за счет бюджетных ассигнований федерального бюджета и бюджетов субъектов Российской Федерации, в том числе средств, переданных в бюджеты территориальных фондов обязательного медицинского страхования.
10. До 1 января 2015 года:
1) уполномоченный федеральный орган исполнительной власти формирует перечень видов высокотехнологичной медицинской помощи с учетом возможного оказания отдельных ее видов в рамках первичной специализированной медико-санитарной и специализированной медицинской помощи;
2) лицензирование медицинской деятельности, предусматривающей оказание услуг по оказанию высокотехнологичной медицинской помощи, является полномочием Российской Федерации.
11. До 1 января 2013 года медицинскими организациями могут применяться порядки оказания медицинской помощи и стандарты медицинской помощи, утвержденные уполномоченным федеральным органом исполнительной власти в соответствии с настоящим Федеральным законом, в том числе в рамках реализации региональных программ модернизации здравоохранения субъектов Российской Федерации.
12. Здания, сооружения, оборудование, транспортные средства и другое имущество, используемые органами местного самоуправления в целях охраны здоровья и находящиеся в муниципальной собственности до дня вступления в силу настоящего Федерального закона, передаются в собственность соответствующих субъектов Российской Федерации в срок до 1 января 2013 года в порядке, установленном законодательством Российской Федерации.
13. Здания, сооружения, оборудование, транспортные средства и другое имущество, используемые органами местного самоуправления в целях охраны здоровья и находящиеся в муниципальной собственности до передачи осуществления полномочий органам местного самоуправления, предусмотренных частью 2 статьи 16 настоящего Федерального закона, могут быть сохранены в собственности муниципальных образований при условии их использования по целевому назначению.
14. Медицинские работники и фармацевтические работники на период работы в медицинских организациях государственной системы здравоохранения субъектов Российской Федерации сохраняют право пользования служебными жилыми помещениями, предоставленными им в период работы в медицинских организациях муниципальной системы здравоохранения.
15. Лицензии на осуществление отдельных видов деятельности, выданные до 1 января 2012 года медицинским организациям муниципальной системы здравоохранения, не подлежат переоформлению в связи с передачей указанных медицинских организаций в состав государственной системы здравоохранения и действуют до истечения указанного в них срока. Лицензии на осуществление медицинской деятельности, выданные до 1 января 2012 года медицинским организациям, не подлежат переоформлению в связи с изменением классификации видов медицинской помощи и перечня оказываемых услуг, установленного положением о лицензировании медицинской деятельности, и действуют до истечения указанного в них срока.
16. Лицам, имеющим право на выбор врача и выбор медицинской организации в соответствии с положениями части 2 статьи 21 настоящего Федерального закона, до момента реализации указанного права первичная врачебная медико-санитарная помощь оказывается в медицинских организациях, в которых указанные лица находились на медицинском обслуживании, врачами-терапевтами, врачами-терапевтами участковыми, врачами-педиатрами, врачами-педиатрами участковыми, врачами общей практики (семейными врачами) и фельдшерами, осуществлявшими медицинское обслуживание указанных лиц.
17. С 1 января по 31 декабря 2012 года Российская Федерация в порядке, установленном статьей 15 настоящего Федерального закона, передает органам государственной власти субъектов Российской Федерации осуществление полномочия по лицензированию медицинской деятельности (за исключением деятельности, предусматривающей оказание услуг по оказанию высокотехнологичной медицинской помощи):
1) медицинских организаций, подведомственных субъекту Российской Федерации и находящихся по состоянию на 1 января 2011 года в муниципальной собственности;
2) медицинских организаций муниципальной и частной систем здравоохранения.
18. В 2012 году реализация программы государственных гарантий бесплатного оказания гражданам медицинской помощи и территориальных программ государственных гарантий бесплатного оказания гражданам медицинской помощи осуществляется в соответствии с нормативными правовыми актами, принятыми во исполнение статьи 20 [1] Основ законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 года N 5487-I.
Статья 101. Порядок вступления в силу настоящего Федерального закона
1. Настоящий Федеральный закон вступает в силу со дня его официального опубликования, за исключением положений, для которых настоящей статьей установлены иные сроки вступления их в силу.
2. Глава 1, статьи 4 - 9, статья 10 (за исключением пункта 4), статьи 11 - 13, часть 1, пункты 1 - 4, 6 - 17 части 2 статьи 14, подпункты "б" и "в" пункта 1 части 1, часть 2, пункт 1 части 3, части 4 - 11 статьи 15, статьи 16 - 19, части 1 - 7 и 9 - 11 статьи 20, статьи 21 - 36, статьи 38 - 57, части 1, 2 и 4 статьи 58, статьи 59 - 63, части 1, 3 и 4 статьи 64, статьи 65 - 68, часть 5 статьи 69, статьи 70 - 83, части 1, 2, 4 - 8 статьи 84, статьи 85 - 100 настоящего Федерального закона вступают в силу с 1 января 2012 года.
3. Пункт 4 статьи 10, подпункт "а" пункта 1 части 1, часть 12 статьи 15, часть 1 статьи 37 и часть 3 статьи 84 настоящего Федерального закона вступают в силу с 1 января 2013 года.
4. Пункт 2 части 1, пункт 2 части 3 статьи 15 настоящего Федерального закона вступают в силу с 1 января 2014 года.
5. Часть 3 статьи 58 и часть 2 статьи 64 настоящего Федерального закона вступают в силу с 1 января 2015 года.
6. Части 1 - 4, 6 и 7 статьи 69 настоящего Федерального закона вступают в силу с 1 января 2016 года.
7. Положения части 4 статьи 38 настоящего Федерального закона в части утверждения порядка государственной регистрации медицинских изделий применяются с 1 июля 2012 года.
8. Положения частей 5 - 8 статьи 34 настоящего Федерального закона применяются до 1 января 2015 года.
9. Части 3 - 5 статьи 100 применяются до дня вступления в силу федерального закона об образовании.
Президент Российской Федерации Д. Медведев
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ ПОСТАНОВЛЕНИЕ ОТ 30 ИЮНЯ 1998 Г. N 681 ОБ УТВЕРЖДЕНИИ ПЕРЕЧНЯ НАРКОТИЧЕСКИХ СРЕДСТВ, ПСИХОТРОПНЫХ ВЕЩЕСТВ И ИХ ПРЕКУРСОРОВ, ПОДЛЕЖАЩИХ КОНТРОЛЮ В РОССИЙСКОЙ ФЕДЕРАЦИИ
(в ред. Постановлений Правительства РФ от 06.02.2004 N 51,
от 17.11.2004 N 648, от 08.07.2006 N 421, от 04.07.2007 N 427,
от 22.06.2009 N 507, от 21.12.2009 N 1042,
от 31.12.2009 N 1186, от 21.04.2010 N 255,
от 03.06.2010 N 398, от 30.06.2010 N 486,
от 29.07.2010 N 578, от 30.10.2010 N 882,
от 27.11.2010 N 934, от 08.12.2010 N 990)
В соответствии с Федеральным законом "О наркотических средствах и психотропных веществах" (Собрание законодательства Российской Федерации, 1998, N 2, ст. 219) Правительство Российской Федерации постановляет:
Утвердить прилагаемый перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации.
Установить, что внесение изменений в указанный перечень осуществляется на основании предложений Министерства здравоохранения и социального развития Российской Федерации либо Федеральной службы Российской Федерации по контролю за оборотом наркотиков, которые представляют в установленном порядке соответствующие проекты актов Правительства Российской Федерации.
(в ред. Постановления Правительства РФ от 21.12.2009 N 1042)
Председатель Правительства
Российской Федерации
С.КИРИЕНКО
Утвержден
Постановлением Правительства
Российской Федерации
от 30 июня 1998 г. N 681
ПЕРЕЧЕНЬ
НАРКОТИЧЕСКИХ СРЕДСТВ, ПСИХОТРОПНЫХ ВЕЩЕСТВ
И ИХ ПРЕКУРСОРОВ, ПОДЛЕЖАЩИХ КОНТРОЛЮ
В РОССИЙСКОЙ ФЕДЕРАЦИИ
(в ред. Постановлений Правительства РФ от 08.07.2006 N 421,
от 04.07.2007 N 427, от 22.06.2009 N 507,
от 31.12.2009 N 1186, от 21.04.2010 N 255,
от 03.06.2010 N 398, от 30.06.2010 N 486,
от 29.07.2010 N 578, от 30.10.2010 N 882,
от 27.11.2010 N 934, от 08.12.2010 N 990)
Список наркотических средств
и психотропных веществ, оборот которых
в Российской Федерации запрещен в соответствии
с законодательством Российской Федерации и международными
договорами Российской Федерации (список I)
Наркотические средства
Аллилпродин
Альфамепродин
Альфаметадол
Альфа-метилфентанил
Альфа-метилтиофентанил
Альфапродин
Альфацетилметадол
Анилэридин
Ацетил-альфаметилфентанил
Ацетилдигидрокодеин
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Ацетилированный опий
Ацетилкодеин
Ацетилметадол
Ацеторфин
БДБ [L-(3,4-метилендиоксифенил)-2-бутанамин]
Безитрамид
Бензетидин
Бензилморфин
Бета-гидрокси-3-метилфентанил
Бета-гидроксифентанил
Бетамепродин
Бетаметадол
Бетапродин
Бетацетилметадол
Броламфетамин (ДОБ, d, L-4-бромо-2,5-диметокси-альфа-метил- фенетиламин)
(введено Постановлением Правительства РФ от 30.06.2010 N 486)
(1-Бутил-1H-индол-3-ил)(нафталин-1-ил)метанон (JWH-073) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Гашиш (анаша, смола каннабиса)
Героин (диацетилморфин)
Гидрокодон
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
N-гидрокси-МДА
Гидроксипетидин
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
2-[(1R,3S)-3-Гидроксициклогексил]-5-(2-метилоктан-2-ил)фенол (CP 47,497) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2-[(1R,3S)-3-Гидроксициклогексил]-5-(2-метилгептан-2-ил)фенол (CP 47,497)-C6) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2-[(1R,3S)-3-Гидроксициклогексил]-5-(2-метилдекан-2-ил)фенол (CP 47,497)-C9) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2-[(1R,3S)-3-Гидроксициклогексил]-5-(2-метилнонан-2-ил)фенол (CP 47,497)-C8) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Гидроморфинол
Гидроморфон
Дезоморфин
Диампромид
Диацетилморфин (героин)
Дигидроморфин
Дименоксадол
N-Диметиламфетамин
Димепгептанол
Диметилтиамбутен
(6aR, 10aR)-9-(Гидроксиметил)-6,6-диметил-3-(2-метилоктан-2-ил)-6a, 7, 10, 10a-тетрагидробензо[с]хромен-1-ол (HU-210) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2С-Т-7 (2,5-диметокси-4-N-пропилтиофенэтиламин)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Диоксафетил бутират
Дипипанон
Дифеноксин
Диэтилтиамбутен
ДМА (d, L-2,5-диметокси-альфа-метил-фенил-этиламин)
ДМГП (диметилгептилпиран)
ДМТ (диметилтриптамин)
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
ДОХ (d, L-2,5-диметокси-4-хлор-амфетамин)
ДОЭТ (d, L-2,5-диметокси-4-этил-амфетамин)
Дротебанол
ДЭТ (N,N-диэтилтриптамин)
Изометадон
Каннабис (марихуана)
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Кетобемидон
Клонитазен
Кодоксим
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Кустарно изготовленные препараты из эфедрина или из препаратов, содержащих эфедрин
Кустарно изготовленные препараты из псевдоэфедрина или из препаратов, содержащих псевдоэфедрин
Кустарно изготовленные препараты из фенилпропаноламина или из препаратов, содержащих фенилпропаноламин
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Левометорфан
Левоморамид
Леворфанол (леморан)
Левофенацилморфан
Лизергиновая кислота и ее производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(в ред. Постановления Правительства РФ от 30.10.2010 N 882)
d-Лизергид (ЛСД, ЛСД-25)
Лист кока
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Маковая солома
Масло каннабиса (гашишное масло)
МБДБ [N-Метил-1-(3,4-метилендиоксифенил)-2-бутанамин]
МДА (тенамфетамин)
МДМА (d, L-3,4-метилендиокси-N-альфа-диметил-фенил-этиламин)
3-Моноацетилморфин
6-Моноацетилморфин
Мескалин
Метадон (фенадон, долофин)
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Метадона промежуточный продукт (4-циано-2-диметиламино-4,4-дифенилбутан)
Метазоцин
Метамфетамин (первитин)
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Метилдезорфин
Метилдигидроморфин
Метилон (3,4-метилендиокси-N-метилкатинон)
(введено Постановлением Правительства РФ от 29.07.2010 N 578)
2-Метил-1-пентил-1H-индол-3-ил-(1-нафтил)метан (JWH-196) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2-Метил-1-пентил-1H-индол-3-ил-(4-метил-1-нафтил)метан (JWH-194) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
2-Метил-1-пентил-1H-индол-3-ил-(4-метокси-1-нафтил)метан (JWH-197) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(2-Метил-1-пентил-1H-индол-3-ил)(нафталин-1-ил)метанон (JWH-007) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метилнафталин-1-ил)(2-метил-1-пентил-1H-индо-3-ил)метанон (JWH-149) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(2-Метил-1-пентил-1H-индол-3-ил)(4-метоксинафталин-1-ил)метанон (JWH-098) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
3-метилтиофентанил
3-метилфентанил
N-метилэфедрон и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Метопон
Мефедрон (4-метилметкатинон)
(введено Постановлением Правительства РФ от 29.07.2010 N 578)
Мирофин
Млечный сок разных видов мака, не являющихся маком снотворным (растение вида Papaver somniferum L), но содержащих алкалоиды мака, включенные в списки наркотических средств и психотропных веществ
(в ред. Постановления Правительства РФ от 27.11.2010 N 934)
ММДА (2-метокси-альфа-4-метил 4,5-(метилендиокси)-фенетиламин)
Морамида, промежуточный продукт (2-метил-3-морфолин-1, 1-дифенил-пропан-карбоновая кислота)
Морферидин
Морфин метилбромид
Морфин-N-окись
(1-[2-(4-Морфолино)этил]-1-H-индол-3-ил)(нафталин-1-ил)метан (JWH-195) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метилнафталин-1-ил)(1-[2-(4-морфолино)этил]-1H-индол-3-ил)метан (JWH-192) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метокси-1-нафтил)(1-[2-(4-морфолино)этил]-1H-индол-3-ил)метан (JWH-199) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(1-[2-(4-Морфолино)этил]-1H-индол-3-ил)(нафталин-1-ил)метанон (JWH-200) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метилнафталин-1-ил)(1-[2-(4-морфолино)этил]-1H-индол-3-ил)метанон (JWH-193) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метокси-1-нафтил)(1-[2-(4-морфолино)этил]-1H-индол-3-ил)метанон (JWH-198) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
МППП (МФПП (1-метил-4-фенил-4-пиперидинол пропионат (эфир))
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
(E)-1-[1-(Нафталин-1-илметилиден)-1H-инден-3-ил]пентан (JWH-176) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Никодикодин
Никокодин
Никоморфин
Норациметадол
Норкодеин
Норлеворфанол
Норметадон
Норморфин
Норпипанон
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Оксиморфон
Опий - свернувшийся сок мака снотворного (растение вида Papaver somniferum L)
(в ред. Постановления Правительства РФ от 27.11.2010 N 934)
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Орипавин
Пара-флуорофентанил (пара-фторфентанил)
Парагексил
(4-Метилнафталин-1-ил)(1-пентил-1H-индол-3-ил)метанон (JWH-122) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(4-Метоксинафталин-1-ил)(1-пентил-1H-индол-3-ил)метанон (JWH-081) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
(Нафталин-1-ил)(1-пентил-1H-индол-3-ил)метанон (JWH-018) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
1-Пентил-1H-индол-3-ил-(1-нафтил)метан (JWH-175) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
1-Пентил-1H-индол-3-ил-(4-метил-1-нафтил)метан (JWH-184) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
1-Пентил-1H-индол-3-ил-(4-метокси-1-нафтил)метан (JWH-185) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
ПЕПАП (L-фенэтил-4-фенил-4-пиперидинол ацетат (эфир))
Петидин
Петидин, промежуточный продукт A (4-циано-1-метил-4-фенилпиперидин)
(в ред. Постановления Правительства РФ от 08.07.2006 N 421)
Петидин, промежуточный продукт B (этиловый эфир-4-фенилпиперидин-4-карбоновой кислоты)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Петидин, промежуточный продукт C (1-метил-4-фенилпиперидин-4-карбоновой кислоты)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Пиминодин
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
ПМА (4-метокси-альфа-метилфенил-этиламин)
Прогептазин
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Псилоцибин
Псилоцин
Рацеметорфан
Рацеморамид
Рацеморфан
Ролициклидин
Сальвинорин A
(введено Постановлением Правительства РФ от 31.12.2009 N 1186)
2С-В (4-бром-2,5-диметоксифенетиламин)
СТП (ДОМ) [2-амино-1-(2,5-диметокси-4-метил)фенилпропан]
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Тебакон (ацетилдигидрокодеинон)
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Теноциклидин (ТЦП)
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Тетрагидроканнабинол (все изомеры)
Тиофентанил
ТМА (d, L-3,4,5-триметокси-альфа-метилфенил-амин)
TFMPP (1-(3-трифлюорометилфенил) пиперазин)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Фенадоксон
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Феназоцин
Фенампромид
Фенатин
Фенциклидин
Феноморфан
Феноперидин
Фенфлурамин
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Фолькодин
Фуретидин
Хлорфенилпиперазин
(введено Постановлением Правительства РФ от 30.06.2010 N 486)
Позиция исключена. - Постановление Правительства РФ от 27.11.2010 N 934
Экгонин, его сложные эфиры и производные, которые могут быть превращены в экгонин и кокаин
Экстракт маковой соломы (концентрат маковой соломы)
N-ЭТИЛ-МДА (d, L-N-этил-альфа-метил-3,4-(метилендиокси) - фенетиламил)
Этилметилтиамбутен
1-Этил-1-пентил-3-(1-нафтоил)индол (JWH-116) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(введено Постановлением Правительства РФ от 31.12.2009 N 1186, в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Этициклидин
Этоксеридин
Этонитазен
Эторфин
Этриптамин
Эфедрон (меткатинон) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Психотропные вещества
Амфетамин
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Катин (d-норпсевдоэфедрин)
Катинон (L-альфа-аминопропиофенон) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Меклоквалон
Метаквалон
4-метиламинорекс
Метилфенидат (риталин)
Фенетиллин
(введено Постановлением Правительства РФ от 30.06.2010 N 486)
1-Фенил-2-пропанон
(введено Постановлением Правительства РФ от 21.04.2010 N 255)
Изомеры, в том числе стереоизомеры (если таковые определенно не исключены), наркотических средств и психотропных веществ, перечисленных в этом списке, в тех случаях, когда существование таких изомеров, в том числе стереоизомеров, возможно в рамках данного химического обозначения
(в ред. Постановления Правительства РФ от 08.07.2006 N 421)
Эфиры сложные и простые наркотических средств и психотропных веществ, перечисленных в данном списке
Соли всех наркотических средств и психотропных веществ, перечисленных в данном списке, если существование таких солей возможно
Все смеси, в состав которых входят наркотические средства и психотропные вещества данного списка, независимо от их количества
Список наркотических средств
и психотропных веществ, оборот которых
в Российской Федерации ограничен и в отношении
которых устанавливаются меры контроля в соответствии
с законодательством Российской Федерации
и международными договорами Российской
Федерации (список II)
Наркотические средства
р-Аминопропиофенон (РАРР) и его оптические изомеры (антидот против цианидов)
Альфентанил
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
BZP (N-бензилпиперазин)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Бупренорфин
Глютетимид (Ноксирон)
Декстроморамид
Декстропропоксифен (ибупроксирон, проксивон, спазмопроксивон)
Дигидрокодеин
Дигидроэторфин
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Дифеноксилат
Капсулы, содержащие 30 мг кодеина и 10 мг фенилтолоксамина
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Кодеин
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Кокаин
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Кодеин N-окись
4-MTA (альфа-метил-4-метилтиофенетиламин)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Морфин
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Морфилонг
Оксикодон (текодин)
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Омнопон
Пентазоцин
Проперидин
Пропирам
Просидол
Пиритрамид (дипидолор)
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Ремифентанил
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Сомбревин
Суфентанил
Таблетки "Алнагон" (кодеина фосфата 20 мг, кофеина 80 мг, фенобарбитала 20 мг, кислоты ацетилсалициловой 20 мг)
Таблетки (кодеина камфосульфоната 0,025 г, сульфагваякола калия 0,100 г, густого экстракта гринделии 0,017 г)
Таблетки кодеина 0,03 г + парацетамола 0,500 г
Таблетки кодеина фосфата 0,015 г + сахара 0,25 г
Таблетки кодеина 0,01 г, 0,015 г + сахара 0,25 г
Таблетки кодеина 0,015 г + натрия гидрокарбоната 0,25 г
Таблетки "Кодтерпин" (кодеина 0,015 г + натрия гидрокарбоната 0,25 г + терпингидрата 0,25 г)
Таблетки от кашля. Состав: травы термопсиса в порошке - 0,01 г (0,02 г), кодеина - 0,02 г (0,01 г), натрия гидрокарбоната - 0,2 г, корня солодки в порошке - 0,2 г
Тебаин
Тилидин
Тримеперидин (промедол)
Фентанил
Этилморфин
Эскодол
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Позиция исключена. - Постановление Правительства РФ от 08.07.2006 N 421
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Психотропные вещества
Амобарбитал (барбамил)
Амфепрамон (фепранон, диэтилпропион) и его производные, за исключением производных, включенных в качестве самостоятельных позиций в перечень
(в ред. Постановления Правительства РФ от 30.10.2010 N 882)
Кетамин
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Фенметразин
Фентермин
Этаминал натрия (пентобарбитал)
(в ред. Постановления Правительства РФ от 30.06.2010 N 486)
Хальцион (триазолам)
Изомеры (если таковые определенно не исключены) наркотических средств и психотропных веществ, перечисленных в этом списке, в тех случаях, когда существование таких изомеров возможно в рамках данного химического обозначения
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Стереоизомеры (если таковые определенно не исключены) наркотических средств и психотропных веществ, перечисленных в этом списке, в тех случаях, когда существование таких стереоизомеров возможно в рамках данного химического обозначения
(введено Постановлением Правительства РФ от 08.07.2006 N 421)
Соли всех наркотических средств и психотропных веществ, перечисленных в данном списке, если существование таких солей возможно
Список психотропных веществ, оборот которых
в Российской Федерации ограничен и в отношении
которых допускается исключение некоторых мер
контроля в соответствии с законодательством
Российской Федерации и международными договорами
Российской Федерации (список III)
(в ред. Постановления Правительства РФ от 04.07.2007 N 427)
Аллобарбитал
Аминептин
Аминорекс
Апрофен
Бензфетамин
Буталбитал
Бутобарбитал
Буторфанол
(введено Постановлением Правительства РФ от 30.06.2010 N 486)
Винилбитал
Галазепам
Галоксазолам
4-гидроксибутират натрия и другие соли оксимасляной кислоты
(введено Постановлением Правительства РФ от 08.12.2010 N 990)
Позиция исключена. - Постановление Правительства РФ от 22.06.2009 N 507
Декстрометорфан
Делоразепам
Камазепам
Кетазолам
Клобазам
Клоксазолам
Клоразепат
Клотиазепам
Левамфетамин
Лефетамин
Лопразолам
Лорметазепам
Мазиндол
Метилфенобарбитал
Метилприлон
Мефенорекс
Позиция исключена. - Постановление Правительства РФ от 08.12.2010 N 990
Ниметазепам
Нордазепам
Оксазолам
(введено Постановлением Правительства РФ от 08.12.2010 N 990)
Пемолин
Позиция исключена. - Постановление Правительства РФ от 30.06.2010 N 486
Пиназепам
Пипрадрол
Пировалерон
Празепам
Секбутабарбитал
Секобарбитал
Тианептин
(введено Постановлением Правительства РФ от 30.06.2010 N 486)
Тарен
Фендиметразин
Фенкамфамин
Фенпропорекс
Флудиазепам
Циклобарбитал
Ципепрол
Этил лофлазепат
Этиламфетамин
Этинамат
Этхлорвинол
Соли веществ, перечисленных в данном списке, если существование таких солей возможно
Список прекурсоров, оборот которых
в Российской Федерации ограничен и в отношении
которых устанавливаются меры контроля в соответствии
с законодательством Российской Федерации и международными
договорами Российской Федерации (список IV)
(в ред. Постановления Правительства РФ от 03.06.2010 N 398)
Таблица I
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых устанавливаются
особые меры контроля <*>
Наименование
Концентрация
Ангидрид уксусной кислоты10 процентов или более
N-метилэфедрин 10 процентов или более
Норпсевдоэфедрин, исключая d-норпсевдоэфедрин10 процентов или более
(катин)
Псевдоэфедрин10 процентов или более
Фенилпропаноламин (норэфедрин) 10 процентов или более
Эргометрин (эргоновин) 10 процентов или более
Эрготамин10 процентов или более
Эфедрин10 процентов или более
--------------------------------
<*> Включая соли перечисленных веществ, если существование таких солей возможно.
Таблица II
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых устанавливаются
общие меры контроля <*>
Наименование
Концентрация
Аллилбензол15 процентов или более
Антраниловая кислота 15 процентов или более
N-ацетилантраниловая кислота 15 процентов или более
Бензальдегид 15 процентов или более
1-бензил-3-метил-4-пиперидинон 15 процентов или более
Бромистый этил 15 процентов или более
1-бром-2-фенилэтан 15 процентов или более
Бутиролактон и его изомеры 15 процентов или более
1,4-бутандиол15 процентов или более
1-гидрокси-1-метил-2-фенилэтоксисульфат15 процентов или более
1-диметиламино-2-пропанол15 процентов или более
1-диметиламино-2-хлорпропан15 процентов или более
2,5-диметоксибензальдегид15 процентов или более
Изосафрол15 процентов или более
Метилакрилат 15 процентов или более
Метилметакрилат15 процентов или более
3-метил-1-фенетил-4-пиперидинон15 процентов или более
3,4-метилендиоксифенил-2-пропанон15 процентов или более
N-(3-метил-4-пиперидинил) анилин 15 процентов или более
N-(3-метил-4-пиперидинил) пропионанилид15 процентов или более
Пиперидин15 процентов или более
Пиперональ 15 процентов или более
Сафрол, в том числе в виде сассафрасового масла15 процентов или более
4-метоксибензилметилкетон15 процентов или более
1-фенил-2-нитропропен15 процентов или более
Фенилуксусная кислота15 процентов или более
Фенэтиламин15 процентов или более
1-(2-фенилэтил)-4-анилинопиперидин 15 процентов или более
2-(1-фенилэтил)-3-метоксикарбонил-4-пиперидон15 процентов или более
1-хлор-2-фенилэтан 15 процентов или более
Циклогексиламин15 процентов или более
--------------------------------
<*> Включая соли перечисленных веществ, если существование таких солей возможно.
Таблица III
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых допускается
исключение некоторых мер контроля <*>
Наименование
Концентрация
Ацетилхлорид 40 процентов или более
Ацетон (2-пропанон)60 процентов или более
Ацетонитрил15 процентов или более
Бензилхлорид 40 процентов или более
Бензилцианид 40 процентов или более
Диэтиловый эфир (этиловый эфир, серный эфир) 45 процентов или более
Метиламин40 процентов или более
Метилэтилкетон (2-бутанон) 80 процентов или более
Нитрометан 40 процентов или более
Нитроэтан40 процентов или более
Перманганат калия45 процентов или более
Серная кислота 45 процентов или более
Соляная кислота15 процентов или более
Тетрагидрофуран45 процентов или более
Тионилхлорид 40 процентов или более
Толуол 70 процентов или более
Уксусная кислота 80 процентов или более
--------------------------------
<*> Включая соли перечисленных в таблице веществ, если существование таких солей возможно, исключая соли серной, соляной и уксусной кислот.
Примечания. 1. Отнесение вещества к соответствующему наркотическому средству, психотропному веществу или их прекурсору, внесенному в настоящий перечень, не зависит от того, какие фирменные (торговые) наименования, синонимы или аббревиатуры используются в качестве его наименования.
(п. 1 в ред. Постановления Правительства РФ от 03.06.2010 N 398)
2. Контроль распространяется на препараты, содержащие наркотические средства и психотропные вещества, указанные в настоящем перечне, независимо от их количества и наличия нейтральных компонентов (вода, крахмал, сахар, бикарбонат натрия, тальк и т.п.).
(в ред. Постановления Правительства РФ от 03.06.2010 N 398)
В отношении комбинированных лекарственных препаратов, содержащих, кроме основного контролируемого вещества, другие фармакологически активные компоненты, контроль устанавливается в индивидуальном порядке путем включения данного комбинированного лекарственного препарата в соответствующий список настоящего перечня.
3. Препарат, содержащий несколько прекурсоров, внесенных в таблицы списка IV настоящего перечня, контролируется как содержащийся в нем прекурсор, предусмотренный таблицей списка IV настоящего перечня, имеющей наименьший порядковый номер.
(п. 3 в ред. Постановления Правительства РФ от 03.06.2010 N 398)
4. Смеси, содержащие несколько перечисленных в таблице III списка IV веществ, подлежат контролю, если их суммарная концентрация равна или превышает концентрацию, установленную для одного из веществ, величина которой в таблице имеет наибольшее значение.(п. 4 введен Постановлением Правительства РФ от 03.06.2010 N 398)
5. Концентрация веществ, указанных в списке IV настоящего перечня, определяется исходя из массовой доли вещества в составе смеси (раствора).
(п. 5 введен Постановлением Правительства РФ от 03.06.2010 N 398)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 12 ноября 1997 г. N 330
О МЕРАХ
ПО УЛУЧШЕНИЮ УЧЕТА, ХРАНЕНИЯ, ВЫПИСЫВАНИЯ И ИСПОЛЬЗОВАНИЯ
НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ
(в ред. Приказов Минздрава РФ от 09.01.2001 N 2,
от 16.05.2003 N 205,
Приказов Минздравсоцразвития РФ от 26.06.2008 N 296н,
от 17.11.2010 N 1008н)
В целях упорядочения учета, хранения, выписывания и использования наркотических средств и психотропных веществ, приказываю:
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
1. Ввести в действие:
- "Типовые требованияпо технической укрепленности и оснащению средствами охранно-пожарной сигнализации помещений с хранением наркотических средств" (Приложение 1).
- "Формуспециального рецептурного бланка на наркотическое средство и психотропное вещество" (Приложение 2).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Расчетные нормативыпотребности наркотических средств и психотропных веществ для амбулаторных и стационарных больных" (Приложение 3).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Правилахранения и учета наркотических средств и психотропных веществ в аптеках" (Приложение 4).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Правилахранения и учета наркотических средств и психотропных веществ и специальных рецептурных бланков в лечебно-профилактических учреждениях" (Приложение 5).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Положениео списании и уничтожении наркотических средств и психотропных веществ и специальных рецептов, неиспользованных онкологическими больными" (Приложение 6).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Правилахранения, учета и отпуска наркотических средств и психотропных веществ и специальных рецептурных бланков на наркотические средства в аптечных складах (базах)" (Приложение 7).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Правилахранения и учета наркотических средств в контрольно-аналитических лабораториях" (Приложение 8).
- "Правилахранения и учета наркотических средств в научно-исследовательских институтах, лабораториях и учебных заведениях" (Приложение 9).
- "Актна уничтожение использованных ампул из-под наркотических средств и психотропных веществ" (Приложение 10).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
- "Формувнеочередного донесения, представляемого Министерству здравоохранения Российской Федерации о хищении и краже наркотиков из аптечных и лечебно-профилактических учреждений" (Приложение 11).
2. Руководителям органов управления здравоохранением и фармацевтическими организациями в субъектах Российской Федерации:
2.1. Возложить на руководителей лечебно-профилактических учреждений персональную ответственность за учет, сохранность, отпуск, назначение и использование наркотических средств и психотропных веществ и специальных рецептурных бланков в соответствии с приложениями 1-11, введенными данным приказом.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
2.2. Обеспечивать лечебно-профилактические учреждения специальными рецептурными бланками на наркотические средства и психотропные вещества, получаемые с аптечных складов (баз). Запас специальных рецептурных бланков на наркотические средства и психотропные вещества в органах управления здравоохранением и лечебно-профилактических учреждениях не должен превышать месячной потребности.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
2.3. Обязать руководителей лечебно-профилактических учреждений (или их заместителей) обеспечить хранение специальных рецептурных бланков на наркотические средства только в сейфе, ключ от которого должен находиться у данных руководителей; осуществлять систематический контроль за назначением наркотических средств и психотропных веществ и установленным порядком их выписывания (Приложение 2). Категорически запретить врачам выдавать, а также выписывать рецепты на наркотические средства и психотропные вещества больным, страдающим наркоманией.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
2.4. Обязать лечащих врачей назначение и использование наркотических средств и психотропных веществ, независимо от лекарственной формы, оформлять записями в истории болезни и листке назначения с указанием наименования лекарственной формы наркотического средства и психотропного вещества, его количества и дозировки.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
2.5. Обязать лечащих или дежурных врачей использованные ампулы из-под наркотических средств и психотропных веществ сдавать в этот же день, за исключением выходных и праздничных дней, заместителю руководителя по лечебной части, а в учреждениях, где он отсутствует, - руководителю лечебно-профилактического учреждения. Уничтожение использованных ампул производить не реже одного раза в 10 дней комиссией под председательством руководителя, с оформлением соответствующего актапо установленной форме (Приложение 10).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
3. Постоянному комитету по контролю наркотиков, руководителям лечебно-профилактических учреждений, руководителям научно-исследовательских учреждений при определении потребности в наркотических средствах и психотропных веществах руководствоваться нормами расхода наркотических средств и психотропных веществ, издаваемыми Постоянным комитетом по контролю наркотиков (Таблицы 2и3).
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
4. Руководителям органов управления здравоохранением и фармацевтическими организациями в субъектах Российской Федерации систематически организовывать проверки правильности назначения и оформления лиц, допущенных (в том числе и временно) к работе по получению, хранению, учету и отпуску наркотических средств и психотропных веществ в аптечных и лечебно-профилактических учреждениях. В случае выявления фактов нарушения порядка назначения и допуска лиц к работе с наркотическими средствами и психотропными веществами виновных привлекать к строгой ответственности в соответствии с законодательством Российской Федерации.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
5. Руководителям органов управления здравоохранением и фармацевтическими организациями в субъектах Российской Федерации довести данный приказ до сведения медицинских и фармацевтических работников, осуществлять постоянный контроль за его исполнением.
6. Считать недействующим на территории Российской Федерации приказ Министерства здравоохранения СССР от 30.12.1982 г. N 1311 "О мерах по устранению серьезных недостатков и дальнейшему усилению борьбы с наркоманиями, улучшению учета, хранения, прописывания и использования наркотических лекарственных средств" (приложение 2"Форма специального рецептурного бланка на наркотическое лекарственное средство",приложение 3"Нормы расхода наркотических лекарственных средств",приложение 4"Форма внеочередного донесения, представляемого Министерству здравоохранения СССР, о хищении и краже наркотиков из аптечных и лечебно-профилактических учреждений",приложение 5"Правила хранения и учета наркотических лекарственных средств в хозрасчетных аптеках",приложение 6"Правила хранения и учета наркотических лекарственных средств и специальных рецептурных бланков в лечебно-профилактических учреждениях",приложение 7"Правила хранения, учета и отпуска наркотических лекарственных средств и специальных рецептурных бланков на наркотические средства в аптечных складах",приложение 8"Правила хранения и учета наркотических средств в контрольно-аналитических лабораториях аптечных управлений",приложение 9"Правила хранения и учета наркотических средств в научно-исследовательских институтах, лабораториях и учебных заведениях системы здравоохранения",приложение 10"Положение о списании и уничтожении наркотических лекарственных средств и специальных рецептов, неиспользованных онкологическими больными",приложение 11"Акт на уничтожение использованных ампул из-под наркотических лекарственных средств в учреждениях здравоохранения").
7. Контроль за выполнением настоящего приказа возложить на заместителя Министра здравоохранения Вилькена А.Е.
Министр
здравоохранения
Российской Федерации
Т.Б.ДМИТРИЕВА
Приложение N 1
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
Согласовано
Заместитель Министра
внутренних дел
Российской Федерации
А.Н.КУЛИКОВ
5 марта 1993 года
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
4 марта 1993 года
ТИПОВЫЕ ТРЕБОВАНИЯ
ПО ТЕХНИЧЕСКОЙ УКРЕПЛЕННОСТИ И ОСНАЩЕНИЮ СРЕДСТВАМИ
ОХРАННО-ПОЖАРНОЙ СИГНАЛИЗАЦИИ ПОМЕЩЕНИЙ
С ХРАНЕНИЕМ НАРКОТИЧЕСКИХ СРЕДСТВ
Утратили силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Приложение N 2
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ФОРМА
СПЕЦИАЛЬНОГО РЕЦЕПТУРНОГО БЛАНКА НА НАРКОТИЧЕСКОЕ
ЛЕКАРСТВЕННОЕ СРЕДСТВО
Утратила силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Приложение N 3
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
РАСЧЕТНЫЕ НОРМАТИВЫ
ПОТРЕБНОСТИ НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ
ДЛЯ АМБУЛАТОРНЫХ И СТАЦИОНАРНЫХ БОЛЬНЫХ
(в ред. Приказов Минздрава РФ от 09.01.2001 N 2,
от 16.05.2003 N 205)
Таблица 1
РАСЧЕТНЫЕ НОРМАТИВЫ
ПОТРЕБНОСТИ НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ
НА 1000 ЧЕЛОВЕК НАСЕЛЕНИЯ В ГОД (В ГРАММАХ)
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
|
NN п/п |
Наименование лекарственного средства |
Норматив на 1000 человек |
|
1. |
Морфина гидрохлорид |
0,3 |
|
2. |
Промедол (тримеперидин) |
5,0 |
|
3. |
Омнопон |
0,3 |
|
4. |
Кокаин |
0,02 |
|
5. |
Дионин (этилморфин) |
0,1 |
|
6. |
Эстоцин гидрохлорид |
0,3 |
|
7. |
Кодеин |
70,3 |
|
8. |
Опий |
833,3 |
|
9. |
Фентанил |
0,006 |
Примечание: Нормативы установлены путем пересчета всех лекарственных форм на чисто действующее вещество, в связи с чем при сравнении заявки с расчетной потребностью по нормативам следует сделать пересчет всех лекарственных форм, содержащих указанные вещества, на чисто действующий препарат.
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Таблица 2
РАСЧЕТНЫЕ НОРМАТИВЫ
ПОТРЕБНОСТИ В НАРКОТИЧЕСКИХ СРЕДСТВАХ
И ПСИХОТРОПНЫХ ВЕЩЕСТВАХ НА ОДНУ КОЙКУ В ГОД
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
|
NN |
Название отделения ЛПУ |
Наименование наркотического средства и психотропного вещества <**> |
Наименование наркотического средства и психотропного вещества <**> | ||||||||||||
|
Мор- фина гид- ро- хло- рид 1% (амп) |
Омно- пон 1% - 1,0 (амп) |
Омно- пон 2% - 1,0 (амп) |
Про- медол 1% - 1,0 (амп) |
Про- медол 2% - 1,0 (амп) |
Мор- фино- по- доб- ные в сумме (амп) |
Фен- танил 0,005 - 2% <*> (амп) |
Про- ме- дол (гр) |
Проме- дол табл. (упак) |
Эсто- цин в табл. 0,015 (упак) |
Этил- морфи- на ги- дро- хлорид (гр) |
Кодеин и его соли (гр) |
Коде- ино- со- дер- жащие таб- летки от кашля (упак) |
Кокаи- на гидро- хлорид (гр) | ||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
1 |
Терапевти- ческое |
3,0 |
0,5 |
2,0 |
0,5 |
5,0 |
11,0 |
0,4 |
0,25 |
1,5 |
0,6 |
0,5 |
0,2 |
5,0 |
- |
|
2 |
Гастроэнте- рологическое |
3,0 |
- |
0,5 |
0,5 |
5,5 |
9,5 |
1,0 |
- |
0,5 |
- |
- |
- |
2 |
- |
|
3 |
Кардиологи- ческое |
1,0 |
0,5 |
1,5 |
0,5 |
5,5 |
9,0 |
1,5 |
- |
1,0 |
- |
2,0 |
- |
1,0 |
- |
|
4 |
Пульмоноло- гическое |
1,0 |
1,0 |
2,0 |
1,0 |
6,0 |
11,0 |
0,5 |
- |
- |
- |
0,06 |
0,2 |
4,0 |
- |
|
5 |
Аллергологи- ческое |
- |
- |
- |
- |
1,0 |
1,0 |
- |
- |
- |
- |
- |
- |
1,0 |
- |
|
6 |
Эндокриноло- гическое |
- |
- |
0,6 |
- |
1,0 |
1,6 |
3,0 |
- |
- |
- |
0,01 |
- |
0,1 |
- |
|
7 |
Нефрологи- ческое |
3,0 |
- |
0,5 |
0,5 |
5,5 |
9,5 |
1,0 |
- |
0,5 |
- |
- |
- |
1,5 |
- |
|
8 |
Гематологи- ческое |
2,5 |
2,0 |
12,0 |
4,0 |
36,0 |
56,5 |
5,0 |
- |
0,5 |
- |
0,3 |
- |
1,5 |
- |
|
9 |
Профпатоло- гическое |
1,0 |
1,0 |
2,0 |
0,5 |
6,0 |
10,0 |
- |
- |
- |
- |
0,06 |
0,2 |
3,0 |
- |
|
10 |
Хирурги- ческое |
6,0 |
1,5 |
8,5 |
7,0 |
58,0 |
81,0 |
6,0 |
0,4 |
1,0 |
0,2 |
0,4 |
0,3 |
6,0 |
0,04 |
|
11 |
Травматоло- гическое |
3,0 |
1,0 |
5,0 |
3,0 |
21,0 |
33,0 |
2,0 |
- |
0,5 |
- |
0,5 |
- |
3,0 |
0,03 |
|
12 |
Ортопеди- ческое |
- |
- |
0,2 |
1,0 |
4,0 |
5,2 |
- |
- |
- |
- |
- |
- |
- |
- |
|
13 |
Урологи- ческое |
5,0 |
0,5 |
5,0 |
4,0 |
31,0 |
45,0 |
7,0 |
0,3 |
- |
- |
0,07 |
0,2 |
3,0 |
- |
|
14 |
Торакальной хирургии |
2,0 |
- |
5,0 |
20,0 |
150,5 |
177,0 |
5,0 |
- |
- |
0,2 |
- |
- |
5,0 |
- |
|
15 |
Ожоговое |
9,5 |
3,0 |
13,0 |
15,0 |
115,0 |
155,5 |
11,0 |
0,6 |
4,0 |
0,2 |
0,3 |
0,5 |
5,0 |
0,5 |
|
16 |
Реанима- ционное |
9,0 |
1,0 |
10,0 |
20,0 |
145,0 |
185,0 |
100,0 |
- |
- |
- |
- |
- |
- |
- |
|
17 |
Инфекционное |
2,0 |
3,0 |
2,0 |
31,0 |
5,0 |
43,0 |
0,2 |
- |
1,0 |
- |
0,3 |
- |
7,5 |
- |
|
18 |
Для беремен- ных и роже- ниц |
4,0 |
0,5 |
1,0 |
6,0 |
4,0 |
15,5 |
1,0 |
- |
1,0 |
- |
0,25 |
- |
1,0 |
- |
|
19 |
Патологии беременных |
- |
- |
- |
- |
0,5 |
0,5 |
- |
- |
- |
- |
- |
- |
0,1 |
- |
|
20 |
Гинекологи- ческое |
3,0 |
2,5 |
9,0 |
2,5 |
14,0 |
31,0 |
4,0 |
- |
7,0 |
0,9 |
0,05 |
- |
1,5 |
- |
|
21 |
Неврологи- ческое |
0,5 |
- |
0,5 |
2,0 |
1,0 |
4,0 |
0,6 |
0,3 |
- |
- |
0,45 |
0,6 |
1,5 |
0,03 |
|
22 |
Психиатри- ческое |
0,2 |
- |
- |
- |
0,2 |
0,4 |
- |
- |
- |
- |
0,15 |
0,4 |
0,1 |
- |
|
23 |
Офтальмоло- гическое |
0,3 |
0,5 |
0,5 |
0,5 |
4,0 |
5,8 |
1,0 |
0,3 |
- |
0,2 |
0,7 |
- |
1,5 |
0,2 |
|
24 |
Отоларинго- логическое |
2,0 |
- |
6,0 |
0,5 |
3,5 |
12,0 |
0,6 |
0,3 |
- |
- |
1,3 |
- |
2,5 |
3,0 |
|
25 |
Дерматовене- рологическое |
- |
- |
- |
- |
0,1 |
0,1 |
- |
- |
- |
- |
0,1 |
- |
4,0 |
- |
|
26 |
Туберкулез- ное |
2,0 |
- |
1,5 |
1,0 |
2,0 |
6,5 |
- |
0,1 |
1,2 |
0,2 |
0,35 |
- |
4,0 |
0,01 |
|
27 |
Наркологи- ческое |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
0,1 |
- |
|
28 |
Педиатри- ческое |
0,2 |
0,1 |
- |
0,3 |
- |
0,3 |
- |
- |
1,2 |
- |
0,05 |
1,0 |
1,0 |
- |
|
29 |
Онкологи- ческое |
2,5 |
- |
15,5 |
2,0 |
60,0 |
80,0 |
10,0 |
- |
0,5 |
- |
0,4 |
- |
1,7 |
- |
|
30 |
Радиорентге- нологическое |
0,5 |
2,5 |
12,0 |
3,0 |
7,0 |
26,0 |
1,0 |
- |
0,1 |
- |
- |
- |
- |
- |
|
31 |
Приемное |
- |
- |
0,1 |
- |
0,25 |
0,38 |
- |
- |
- |
- |
- |
- |
0,45 |
- |
|
32 |
В сельской участк.боль- нице,включая амбулаторный прием |
10,0 |
1,0 |
6,0 |
2,0 |
7,0 |
26,0 |
20,0 |
0,2 |
0,2 |
- |
0,2 |
0,5 |
6,0 |
0,1 |
|
33 |
Поликлиника и амбулатория |
2,0 |
0,7 |
0,3 |
1,0 |
2,0 |
6,0 |
- |
- |
0,5 |
- |
0,2 |
- |
2,0 |
0,04 |
|
34 |
Стоматологи- ческая поли- клиника |
- |
0,2 |
0,3 |
0,3/ 0,3 |
-/ 0,5 |
0,35/ 0,85 |
-/ 1,0 |
- |
- |
- |
- |
- |
- |
0,2 |
|
35 |
Онкологи- ческий диспансер |
140 |
- |
- |
55,0 |
80,0 |
275,0 |
- |
- |
- |
- |
- |
- |
- |
- |
|
36 |
Туберкулез- ный диспансер |
- |
- |
1,0 |
0,5 |
1,0 |
3,0 |
- |
- |
- |
- |
- |
- |
3,5 |
- |
|
37 |
На 1000 случаев ока- зания скорой мед. помощи |
14,0 |
- |
7,0 |
- |
39,0 |
60,0 |
2,5 |
- |
1,5 |
- |
- |
- |
- |
- |
--------------------------------
<*> Нормы расхода фентанила 0,005% на одного больного, оперируемого под общим обезболиванием, - в пределах 18 ампул
<**> Нормативы на просидол для медицинской практики в хирургических, травматологических, онкологических, стоматологических, гинекологических, лечебно-профилактических учреждениях утверждены по аналогии с расчетными нормативами на промедол.
Примечания:
1) Руководителям органов управления здравоохранением субъектов Российской Федерации разрешается по представлениям руководителей лечебно-профилактических учреждений увеличивать приведенные в настоящей таблице расчетные нормативы, но не более, чем в 1,5 раза.
2) Руководителям лечебно-профилактических учреждений разрешается перераспределять между отделениями указанные в настоящей таблице наркотические средства и психотропные вещества в пределах общего норматива потребности на учреждение по каждому наименованию.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
3) При наличии медицинских показаний для купирования выраженного болевого синдрома в указанных в настоящей таблице отделениях лечебно-профилактических учреждений разрешается использовать неинвазивные формы наркотических средств и психотропных веществ в количествах, соответствующих медицинским показаниям и состоянию больного.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
(примечания введены ПриказомМинздрава РФ от 09.01.2001 N 2).
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Таблица 3
РАСЧЕТНЫЕ НОРМАТИВЫ
ПОТРЕБНОСТИ В НАРКОТИЧЕСКИХ СРЕДСТВАХ И ПСИХОТРОПНЫХ ВЕЩЕСТВАХ
НА ОДНУ КОЙКУ В ГОД ДЛЯ ОНКОЛОГИЧЕСКОГО ОТДЕЛЕНИЯ (ПАЛАТЫ)
ПАЛЛИАТИВНОЙ ПОМОЩИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО
УЧРЕЖДЕНИЯ И ХОСПИСА
(в ред. Приказов Минздрава РФ от 09.01.2001 N 2,
от 16.05.2003 N 205)
┌───┬───────────────────────┬────────────────────────┬───────────┐
│ N │ Наименование │ Форма выпуска и │ Количество│
│п/п│лекарственного средства│ дозировка │ │
├───┼───────────────────────┼────────────────────────┼───────────┤
│ 1 │ 2 │ 3 │ 4 │
├───┼───────────────────────┼────────────────────────┼───────────┤
│ 1.│Бупренорфин │Таблетки для │ │
│ │ │сублингвального │ │
│ │ │приема 0,2 мг │157,5 табл.│
│ │ │Раствор для инъекций, │ │
│ │ │ампулы 0,3 мг в 1 мл │105 ампул │
│ │ │ампулы 0,6 мг в 1 мл │52,5 амп. │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 94,5 мг │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 2.│Дигидрокодеин-ретард │Таблетки для приема │ │
│ │ │внутрь │ │
│ │ │60 мг │158,7 табл.│
│ │ │90 мг │105,8 табл.│
│ │ │120 мг │79,3 табл. │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 28,56 гр │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 3.│Дипидолор (пиритрамид) │Раствор для инъекций, │ │
│ │ │ампулы 0,75% по 2 мл │210 амп. │
├───┼───────────────────────┼────────────────────────┼───────────┤
│ 4.│Морфина сульфат │Таблетки продленного │ │
│ │(МСТ континус или │действия для приема │ │
│ │другие аналоги с │внутрь │ │
│ │продолжительностью │10 мг │120 табл. │
│ │действия не менее │30 мг │40 табл. │
│ │12 часов) │60 мг │20 табл. │
│ │ │100 мг │12 табл. │
│ │ │200 мг │16 табл. │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 6,0 гр. │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 5.│Морфина гидрохлорид │Таблетки для приема │ │
│ │ │внутрь │ │
│ │ │10 мг │63 табл. │
│ │ │Раствор для инъекций, │ │
│ │ │ампулы 10 мг в 1 мл │63 ампулы │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 1,26 гр. │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 6.│Омнопон │Раствор для инъекций, │ │
│ │ │ампулы 1% по 1 мл │60 ампул │
│ │ │ампулы 2% по 1 мл │30 ампул │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>-1,2 гр. │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 7.│Промедол │Раствор для инъекций, │ │
│ │(тримеперидина │ампулы 1% по 1 мл │40 ампул │
│ │гидрохлорид) │ампулы 2% по 1 мл │20 ампул │
│ │ │Таблетки для приема │ │
│ │ │внутрь 25 мг │126 табл. │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 4,95 гр │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 8.│Просидол │Таблетки для буккального│ │
│ │ │приема │ │
│ │ │10 мг │765 табл. │
│ │ │20 мг │382,5 табл.│
│ │ │25 мг │306 табл. │
│ │ │Раствор для инъекций, │ │
│ │ │ампулы 10 мг в 1 мл │191,3 амп. │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 24,86 гр │
├───┼───────────────────────┼────────────────────────┬───────────┤
│ 9.│Фентанил- │Пластырь │ │
│ │трансдермальная │25 мкг/час │7,5 пласт. │
│ │лекарственная форма │50 мкг/час │3,75 пласт │
│ │ │75 мкг/час │2,5 пласт. │
│ │ │100 мкг/час │1,9 пласт. │
│ │ │ │В лечебных │
│ │ │ │целях │
│ │ │ │пластырь │
│ │ │ │не подлежит│
│ │ │ │дроблению │
│ │ ├────────────────────────┴───────────┤
│ │ │суммарно <*>- 750 мкг/час │
└───┴───────────────────────┴────────────────────────────────────┘
--------------------------------
<*> в пересчете на чистое действующее вещество.
Примечание: По каждому из пунктов настоящего приложения допускается превышение количества конкретной дозированной формы лекарственного средства в пределах указанного суммарного количества в пересчете на чистое действующее вещество.
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Таблица 4
НОРМЫ ОТПУСКА
ОПИОИДНЫХ АНАЛЬГЕТИКОВ ДЛЯ ИНКУРАБЕЛЬНЫХ
ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Утратили силу. - ПриказМинздрава РФ от 09.01.2001 N 2.
Приложение N 4
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПРАВИЛА
ХРАНЕНИЯ И УЧЕТА НАРКОТИЧЕСКИХ СРЕДСТВ И
ПСИХОТРОПНЫХ ВЕЩЕСТВ В АПТЕКАХ
Утратили силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ФОРМА
УЧЕТА НАРКОТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ В АПТЕКАХ
Исключена. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 5
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПРАВИЛА
ХРАНЕНИЯ И УЧЕТА НАРКОТИЧЕСКИХ СРЕДСТВ И
ПСИХОТРОПНЫХ ВЕЩЕСТВ И СПЕЦИАЛЬНЫХ РЕЦЕПТУРНЫХ
БЛАНКОВ В ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ УЧРЕЖДЕНИЯХ
Утратили силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
КНИГА
УЧЕТА НАРКОТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В ОТДЕЛЕНИЯХ И КАБИНЕТАХ
Исключена. - ПриказМинздрава РФ от 16.05.2003 N 205.
Утвержден
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ЖУРНАЛ
УЧЕТА СПЕЦИАЛЬНЫХ РЕЦЕПТУРНЫХ БЛАНКОВ НА
НАРКОТИЧЕСКИЕ СРЕДСТВА И ПСИХОТРОПНЫЕ ВЕЩЕСТВА
В ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ УЧРЕЖДЕНИЯХ
Исключен. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 6
Утверждено
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПОЛОЖЕНИЕ
О СПИСАНИИ И УНИЧТОЖЕНИИ НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ И СПЕЦИАЛЬНЫХ РЕЦЕПТОВ,
НЕИСПОЛЬЗОВАННЫХ ОНКОЛОГИЧЕСКИМИ БОЛЬНЫМИ
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
1. Наркотические средства и психотропные вещества с истекшим сроком годности, бой, брак, сданные родственниками умерших больных подлежат списанию и уничтожению в присутствии представителей органов внутренних дел, органов управления здравоохранением и органов охраны окружающей среды в установленном порядке". <*>
(п. 1 в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
--------------------------------
<*> ПриказМинздрава России от 28 марта 2003 года N 127 "Об утверждении Инструкции по уничтожению наркотических средств и психотропных веществ, входящих в списки II и III Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, дальнейшее использование которых в медицинской практике признано нецелесообразным" (регистрация в Минюсте России 5 мая 2003 года, регистрационный N 4484).
(сноска введена ПриказомМинздрава РФ от 16.05.2003 N 205)
2. С целью предупреждения неправильного использования наркотических средств и психотропных веществ, оставшихся после смерти онкологических больных на дому, руководители учреждений должны организовать учет сданных родственниками неиспользованных рецептов и остатков наркотических средств и психотропных веществ. Приказом по лечебно-профилактическому учреждению возлагается на работника, ответственного за оформление свидетельств о смерти, прием у родственников умершего онкологического больного неиспользованных рецептов, остатков лекарственных средств, содержащих наркотические средства и психотропные вещества. Данный работник должен провести сверку расхода препарата с момента получения очередного рецепта, записанного в амбулаторную карту. Количество сданных рецептов и препаратов, их наименования и лекарственные формы (ампулы, таблетки, порошки) регистрируются в специальном журнале, пронумерованном, прошнурованном, подписанном руководителем учреждения и скрепленном круглой печатью. Форма журналаприлагается.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
Сданные рецепты и препараты подлежат хранению в сейфе до их уничтожения.
В журнале учета делается отметка о количестве уничтоженных наркотических средств и психотропных веществ. По факту уничтожения составляется акт в количестве по числу сторон, принимающих участие в уничтожении наркотических средств и психотропных веществ.
(абзац введен ПриказомМинздрава РФ от 16.05.2003 N 205)
3. Исключен. - ПриказМинздрава РФ от 16.05.2003 N 205.
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Начальник Управления
организации медицинской
помощи населению
А.И.ВЯЛКОВ
Утвержден
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ЖУРНАЛ
УЧЕТА НЕИСПОЛЬЗОВАННЫХ РЕЦЕПТОВ И ОСТАТКОВ НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ, СДАННЫХ РОДСТВЕННИКАМИ
УМЕРШИХ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
|
NN п/п |
Дата пос- туп- ления |
Ф.И.О. адрес боль- ного |
Общее коли- чест- во рецеп- тов |
в т.ч. по но- мерам |
Наиме- нование сдан- ных нарко- тичес- ких ве- ществ |
Коли- чество ампул, порош- ков, табле- ток |
Фамилия и под- пись сдавше- го |
Фамилия и под- пись приняв- шего |
Отметка о коли- честве и способе уничто- жения |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Утверждаю
Главный врач
(директор)
(название
лечебно-профилактического
учреждения)
"____"____________199 г.
М.П.
АКТ
Исключен. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 7
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПРАВИЛА
ХРАНЕНИЯ, УЧЕТА И ОТПУСКА НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ И СПЕЦИАЛЬНЫХ РЕЦЕПТУРНЫХ
БЛАНКОВ НА АПТЕЧНЫХ СКЛАДАХ (БАЗАХ)
Утратили силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
КНИГА
УЧЕТА НАРКОТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
НА АПТЕЧНЫХ СКЛАДАХ (БАЗАХ)
Исключена. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 8
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПРАВИЛА
ХРАНЕНИЯ И УЧЕТА НАРКОТИЧЕСКИХ СРЕДСТВ
В КОНТРОЛЬНО-АНАЛИТИЧЕСКИХ ЛАБОРАТОРИЯХ
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
1. Наркотические средства, используемые контрольно-аналитической лабораторией, должны храниться в закрытых опломбированных сейфах.
2. Ответственным за хранение наркотических средств и психотропных веществ является заведующий лабораторией (центром), его заместитель или лицо, уполномоченное на это приказом по учреждению. У него должны находиться ключи от сейфа, где хранятся наркотические средства.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
3. Наркотические средства или лекарства, их содержащие, выданные провизору-аналитику для анализа, хранятся изолированно под замком у химика-аналитика.
4. Наркотические средства и психотропные вещества, поступающие на анализ от фармацевтических организаций (аптечные склады, базы, аптеки), по окончании анализа хранятся в течение 3 месяцев, после чего остатки их возвращаются фармацевтическим организациям.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
Забракованные наркотические средства и психотропные вещества после истечения срока хранения уничтожаются согласно действующим правилам.
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
Остатки лекарственных форм, содержащих наркотические средства и психотропные вещества, хранятся:
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
а) поступившие из городских аптек в течение 10 дней;
б) поступившие из сельских аптек в течение 20 дней, после чего уничтожаются с участием представителя вышестоящей организации, что оформляется актом по лаборатории.
5. Наркотические средства и психотропные вещества, независимо от лекарственной формы, подлежат предметно-количественному учету в специальном журнале регистрации операций, пронумерованном, сброшюрованном и заверенном подписью руководителя контрольно-аналитической лаборатории и скрепленном печатью контрольно-аналитической лаборатории.
Форма журнала регистрации утверждается руководителем контрольно-аналитической лаборатории в установленном порядке.
(п. 5 в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
6. Документы на наркотические средства должны храниться у заведующего лабораторией в течение 3-х лет.
Начальник Управления
организации обеспечения
лекарствами и медицинской
техникой
Т.Г.КИРСАНОВА
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
КНИГА
УЧЕТА НАРКОТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ,
ПОСТУПАЮЩИХ ДЛЯ АНАЛИЗА
Исключена. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 9
Утверждены
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ПРАВИЛА
ХРАНЕНИЯ И УЧЕТА НАРКОТИЧЕСКИХ СРЕДСТВ В
НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ИНСТИТУТАХ, ЛАБОРАТОРИЯХ И
УЧЕБНЫХ ЗАВЕДЕНИЯХ СИСТЕМЫ ЗДРАВООХРАНЕНИЯ
Утратили силу. - ПриказМинздравсоцразвития РФ от 17.11.2010 N 1008н.
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
КНИГА
УЧЕТА НАРКОТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ В
НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ ИНСТИТУТАХ, ЛАБОРАТОРИЯХ
И УЧЕБНЫХ ЗАВЕДЕНИЯХ
Исключена. - ПриказМинздрава РФ от 16.05.2003 N 205.
Приложение N 10
Утвержден
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
Утверждаю
Главный врач
"___"_______________19 г.
АКТ <*>
НА УНИЧТОЖЕНИЕ ИСПОЛЬЗОВАННЫХ АМПУЛ ИЗ-ПОД
НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ
В УЧРЕЖДЕНИЯХ ЗДРАВООХРАНЕНИЯ
Комиссия в составе (не менее 3-х человек)
Ф.И.О., должность_________________________________________________
__________________________________________________________________
__________________________________________________________________
число, месяц, год_________________________________________________
произвела уничтожение использованных ампул из-под наркотических
средств и психотропных веществ за период с............по..........
в количестве (прописью)........................ штук от...........
количества больных, которым были применены наркотические вещества
(Фамилия, и.о. больного и N истории болезни).
Ампулы уничтожены путем раздавливания.
Председатель (подпись)
Члены комиссии: (подпись)
(подпись)
(подпись)
------------------------------
<*> Акт хранится в течение 3-х лет
Председатель Постоянного
комитета по контролю
наркотиков
Э.А.БАБАЯН
Приложение N 11
Утверждена
Приказом Министерства
здравоохранения
Российской Федерации
от 12 ноября 1997 г. N 330
ФОРМА
ВНЕОЧЕРЕДНОГО ДОНЕСЕНИЯ, ПРЕДСТАВЛЯЕМОГО
МИНИСТЕРСТВУ ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
(О ХИЩЕНИИ И КРАЖЕ НАРКОТИКОВ ИЗ АПТЕЧНЫХ И
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ УЧРЕЖДЕНИЙ)
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
|
NN п/п |
О чем доносится |
Содержание донесения |
Кто представ- вляет |
Порядок представ- ления |
|
|
Экстренное из- вещение о хище- нии и краже наркотических средств и пси- хотропных ве- ществ из фарма- цевтических (аптечных) ор- ганизаций и ле- чебно-профилак- тических учреж- дений |
Наименование учреж- дения и его адрес. Наличие специальных средств, обеспечива- ющих сохранность наркотических средств и психотроп- ных веществ (охран- ная сигнализация, вневедомственная ох- рана, сторожевая ох- рана, охраны нет). Характеристика зда- ния (построено по типовому проекту, приспособленное зда- ние, кирпичное, де- ревянное). Способы хранения наркотичес- ких средств и пси- хотропных веществ (в специально оборудо- ванном помещении, в сейфе, в металличес- ком шкафу и др.). Наличие решеток на окнах помещения (да, нет). Дата соверше- ния кражи. Способ проникновения прес- тупников в помеще- ние. Наименование похи- щенных лекарственных средств и их коли- чество. Дата сообще- ния о краже органам внутренних дел |
Руководи- тель органа управления здравоохра- нением, фармацевти- ческими ор- ганизациями субъекта РФ |
Экстренное извещение направля- ется в ПККН, Ми- нистерство здравоох- ранения Российской Федерации с приложе- нием копии донесения в террито- риальные органы управления внутренних дел |
(в ред. ПриказаМинздрава РФ от 16.05.2003 N 205)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 28 марта 2003 г. N 127
ОБ УТВЕРЖДЕНИИ ИНСТРУКЦИИ
ПО УНИЧТОЖЕНИЮ НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ, ВХОДЯЩИХ В СПИСКИ II И III
ПЕРЕЧНЯ НАРКОТИЧЕСКИХ СРЕДСТВ, ПСИХОТРОПНЫХ ВЕЩЕСТВ
И ИХ ПРЕКУРСОРОВ, ПОДЛЕЖАЩИХ КОНТРОЛЮ В РОССИЙСКОЙ
ФЕДЕРАЦИИ, ДАЛЬНЕЙШЕЕ ИСПОЛЬЗОВАНИЕ
КОТОРЫХ В МЕДИЦИНСКОЙ ПРАКТИКЕ
ПРИЗНАНО НЕЦЕЛЕСООБРАЗНЫМ
В соответствии с Постановлением Правительства Российской
Федерации от 18 июня 1999 года N 647 "О порядке дальнейшего
использования или уничтожения наркотических средств, психотропных
веществ и их прекурсоров, а также инструментов и оборудования,
которые были конфискованы или изъяты из незаконного оборота либо
дальнейшее использование которых признано нецелесообразным"
(Собрание законодательства Российской Федерации, 1999, N 27, ст.
3360) приказываю:
1. Утвердить "Инструкцию по уничтожению наркотических средств
и психотропных веществ, входящих в списки II и III Перечня
наркотических средств, психотропных веществ и их прекурсоров,
подлежащих контролю в Российской Федерации, дальнейшее
использование которых в медицинской практике признано
нецелесообразным" (приложение).
2. Контроль за выполнением настоящего Приказа возложить на
заместителя Министра А.В. Катлинского.
Министр
Ю.Л.ШЕВЧЕНКО
Приложение
Утверждено
Приказом
Министерства здравоохранения
Российской Федерации
от 28.03.2003 N 127
ИНСТРУКЦИЯ
ПО УНИЧТОЖЕНИЮ НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ, ВХОДЯЩИХ В СПИСКИ II И III
ПЕРЕЧНЯ НАРКОТИЧЕСКИХ СРЕДСТВ, ПСИХОТРОПНЫХ ВЕЩЕСТВ
И ИХ ПРЕКУРСОРОВ, ПОДЛЕЖАЩИХ КОНТРОЛЮ В РОССИЙСКОЙ
ФЕДЕРАЦИИ, ДАЛЬНЕЙШЕЕ ИСПОЛЬЗОВАНИЕ
КОТОРЫХ В МЕДИЦИНСКОЙ ПРАКТИКЕ
ПРИЗНАНО НЕЦЕЛЕСООБРАЗНЫМ
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Настоящая Инструкция определяет порядок уничтожения
наркотических средств и психотропных веществ, входящих в списки II
и III Перечня наркотических средств, психотропных веществ и их
прекурсоров, подлежащих контролю в Российской Федерации (далее -
наркотические средства и психотропные вещества), дальнейшее
использование которых и медицинской практике признано
нецелесообразным.
1.2. Уничтожение наркотических средств и психотропных веществ
осуществляется в случаях, когда:
- истек срок годности;
- наркотическое средство или психотропное вещество
подвергалось химическому или физическому воздействию, следствием
которого стала его непригодность, исключающая возможность
восстановления или переработки;
- неиспользованные наркотические средства принимаются от
родственников умерших больных;
- трудно определить, является препарат наркотическим средством
или психотропным веществом;
- конфискованное из незаконного оборота наркотическое средство
или психотропное вещество не может быть использовано в
медицинских, научных или иных целях.
1.3. Наркотические средства и психотропные вещества,
дальнейшее использование которых признано нецелесообразным
органами, осуществляющими их изъятие или конфискацию, подлежат
уничтожению в полном объеме, за исключением случаев, когда этими
органами на основании заключений Минздрава России и
Минэкономразвития России или комиссий, состоящих из представителей
указанных министерств на местах и органа, осуществившего изъятие
или конфискацию, будет принято решение об обращении их в доход
государства и о передаче их для использования в целях,
предусмотренных законодательством Российской Федерации.
1.4. Основанием для уничтожения конфискованных или изъятых из
незаконного оборота наркотических средств и психотропных веществ
является решение суда, постановление следователя или работника
органа дознания о прекращении уголовного дела или об отказе в
возбуждении уголовного дела, а также постановление органа или
должностного лица о назначении административного наказания либо о
прекращении производства по делу об административном
правонарушении <*>.
--------------------------------
<*> Постановление Правительства Российской Федерации от 24
июля 2002 года N 557 "О внесении дополнений в Постановление
Правительства Российской Федерации от 18 июня 1999 года N 647"
(Собрание законодательства Российской Федерации, 29.07.2002, N 30,
ст. 3057).
1.5. Уничтожение наркотических средств и психотропных веществ,
дальнейшее использование которых признано нецелесообразным, в том
числе конфискованных или изъятых из незаконного оборота,
осуществляется государственными унитарными предприятиями или
государственными учреждениями при наличии у них лицензии на виды
деятельности, связанные с оборотом наркотических средств и
психотропных веществ, с указанием права на их уничтожение <*>.
--------------------------------
<*> Постановление Правительства Российской Федерации от 21
июня 2002 года N 454 "О лицензировании деятельности, связанной с
оборотом наркотических средств и психотропных веществ" (Собрание
законодательства Российской Федерации, 01.07.2002, N 26, ст. 2597;
14.10.2002, N 41, ст. 3983).
1.6. Для уничтожения наркотических средств и психотропных
веществ в государственных унитарных предприятиях или
государственных учреждениях, имеющих лицензии на виды
деятельности, связанные с оборотом наркотических средств и
психотропных веществ с правом их уничтожения, создаются комиссии,
состоящие из представителей органов внутренних дел, органов
управления здравоохранением и органов охраны окружающей среды.
Юридические лица, не имеющие лицензий на виды деятельности,
связанные с оборотом наркотических средств и психотропных веществ
с правом на их уничтожение, но осуществляющие виды деятельности,
связанные с оборотом наркотических средств и психотропных веществ,
заключают договора с государственными унитарными предприятиями или
государственными учреждениями, имеющими такие лицензии, и передают
им подлежащие уничтожению наркотические средства и психотропные
вещества с оформлением приемо-сдаточного акта.
По мере накопления наркотических средств и психотропных
веществ юридическим лицом не позднее 30 числа каждого месяца
производится их списание с последующим уничтожением в срок не
позднее пяти дней.
1.7. Необходимость уничтожения наркотических средств и
психотропных веществ, за исключением конфискованных или изъятых из
незаконного оборота, обосновывается ответственным лицом,
назначенным приказом руководителя учреждения здравоохранения,
аптечного учреждения (организации).
При этом издается приказ о списании наркотических средств и
психотропных веществ и последующем их уничтожении, в котором
указывается:
- название наркотических средств и психотропных веществ, с
указанием их лекарственных форм, дозировок, фасовок и номеров
серий;
- вес нетто и брутто наркотических средств и психотропных
веществ, подлежащих списанию и уничтожению;
- причины списания и уничтожения;
- лицо, ответственное за списание и уничтожение;
- место и способ уничтожения.
Учреждения и организации, не имеющие лицензии на виды
деятельности, связанные с оборотом наркотических средств и
психотропных веществ с правом их уничтожения, указывают номер
договора и дату его заключения с государственным унитарным
предприятием или государственным учреждением, имеющим подобные
лицензии.
Копии приказа направляются:
- в орган управления здравоохранением субъекта Российской
Федерации;
- в орган внутренних дел субъекта Российской Федерации;
- в орган охраны окружающей среды субъекта Российской
Федерации.
2. ПОРЯДОК УНИЧТОЖЕНИЯ НАРКОТИЧЕСКИХ СРЕДСТВ
И ПСИХОТРОПНЫХ ВЕЩЕСТВ
2.1. Уничтожение наркотических средств и психотропных веществ
проводится на специально оборудованных площадках (полигонах) и
(или) в специально подготовленных помещениях.
2.2. Персонал, производящий работы по уничтожению
наркотических средств и психотропных веществ, должен иметь допуск
к работе с наркотическими средствами и психотропными веществами,
знать физико-химические и токсические свойства уничтожаемых
веществ и протекающие при обезвреживании и уничтожении их
химические реакции.
2.3. Особенности уничтожения наркотических средств и
психотропных веществ:
- жидкие лекарственные формы (растворы для инъекций в ампулах
и во флаконах, микстуры, капли) уничтожают путем раздавливания
(ампулы) с последующим разведением содержимого ампул и флаконов
водой в соотношении 1:100 и сливом образующегося раствора в
канализацию; остатки ампул и флаконов вывозятся обычным порядком,
как производственный или бытовой мусор;
- твердые лекарственные формы (порошки, таблетки, капсулы),
содержащие водорастворимые субстанции наркотических средств и
психотропных веществ, подлежат после дробления до порошкообразного
состояния разведению водой в соотношении 1:100 и сливу
образующейся суспензии (или раствора) в канализацию;
- твердые лекарственные формы (порошки, таблетки, капсулы),
содержащие субстанции наркотических средств и психотропных
веществ, нерастворимые в воде, мягкие лекарственные формы (мази,
суппозитории), трансдермальные формы наркотических средств, в том
числе уже использованные, а также фармацевтические субстанции
уничтожаются путем сжигания.
Лекарственные средства, подлежащие сжиганию, обертывают в
макулатуру, обильно смоченную доступной горючей жидкостью,
помещают в противень и сжигают под тягой (если уничтожение
проводят в помещении) или на костре (если уничтожение проводят на
полигоне). Зола вывозится или закапывается обычным порядком как
вещество 4-го класса опасности в установленном порядке.
2.4. При уничтожении наркотических средств и психотропных
веществ комиссией составляется акт, в котором указываются:
- дата и место составления акта;
- место работы, должность, фамилия, имя, отчество лиц,
принимающих участие в уничтожении;
- основание для уничтожения;
- сведения о наименовании (с указанием вида лекарственной
формы, дозировки, единицы измерения, серии) и количестве
уничтожаемого наркотического средства, психотропного вещества, а
также о таре или об упаковке, в которой они хранились;
- способ уничтожения.
Количество экземпляров акта определяется по числу сторон,
принимающих участие в уничтожении наркотических средств и
психотропных веществ.
2.5. Передача для дальнейшего использования наркотических
средств и психотропных веществ, в отношении которых принято
решение об их уничтожении, запрещается.
2.6. Персональную ответственность за осуществление контроля за
деятельностью, связанной с оборотом наркотических средств и
психотропных веществ, несет руководитель юридического лица <*>.
<*> Статья 10 Федерального закона от 8 января 1998 года N 3-ФЗ
"О наркотических средствах и психотропных веществах" (Собрание
законодательства Российской Федерации, 1998, N 2, ст. 219).
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 15 сентября 2010 г. N 805н
ОБ УТВЕРЖДЕНИИ МИНИМАЛЬНОГО АССОРТИМЕНТА
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ,
НЕОБХОДИМЫХ ДЛЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
(в ред. Приказа Минздравсоцразвития РФ от 26.04.2011 N 351н)
В соответствии со статьей 55 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; N 31, ст. 4161) приказываю:
1. Утвердить минимальный ассортимент лекарственных препаратов для медицинского применения, необходимых для оказания медицинской помощи, согласно приложению.
2. Признать утратившим силу Приказ Министерства здравоохранения и социального развития Российской Федерации от 29 апреля 2005 г. N 312 "О минимальном ассортименте лекарственных средств" (зарегистрирован Министерством юстиции Российской Федерации 20 мая 2005 г. N 6606).
3. Федеральной службе по надзору в сфере здравоохранения и социального развития и ее территориальным органам по субъектам Российской Федерации обеспечить контроль исполнения Приказа.
(п. 3 введен Приказом Минздравсоцразвития РФ от 26.04.2011 N 351н)
Министр
Т.А.ГОЛИКОВА
Приложение
к Приказу
Министерства здравоохранения
и социального развития
Российской Федерации
от 15 сентября 2010 г. N 805н
МИНИМАЛЬНЫЙ АССОРТИМЕНТ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ,
НЕОБХОДИМЫХ ДЛЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
(в ред. Приказа Минздравсоцразвития РФ от 26.04.2011 N 351н)
I. Для аптек: готовых лекарственных форм,
производственных, производственных с правом изготовления
асептических лекарственных препаратов
Наименование лекарственного Лекарственные формы
препарата (международное
непатентованное или химическое)
Активированный уголь капсулы или таблетки
Алгелдрат + Магния таблетки;
гидроксид суспензия для приема внутрь
Аминофиллин таблетки
Амоксициллин капсулы или таблетки;
порошок для приготовления суспензии для
приема внутрь
Ампициллин таблетки
Аскорбиновая кислота драже или таблетки
Атенолол таблетки
Ацетилсалициловая кислота таблетки
Ацетилцистеин гранулы для приготовления раствора для
приема внутрь или порошок для
приготовления раствора для приема внутрь
Ацикловир крем для наружного применения или мазь
для наружного применения;
таблетки
Беклометазон аэрозоль для ингаляций
Бетаксолол капли глазные
Бисакодил суппозитории ректальные;
таблетки
Бриллиантовый зеленый раствор для наружного применения
спиртовой
Верапамил таблетки
Гидрокортизон крем для наружного применения или мазь
для наружного применения
Гидрохлортиазид таблетки
Дексаметазон капли глазные
Диклофенак гель для наружного применения или крем
для наружного применения или мазь для
наружного применения;
капли глазные;
таблетки;
суппозитории ректальные
Доксициклин капсулы или
таблетки
Дротаверин таблетки
Занамивир порошок для ингаляций дозированный
Ибупрофен капсулы или таблетки;
суспензия для приема внутрь
Изосорбид мононитрат капсулы или таблетки
Изосорбида динитрат таблетки
Ингавирин капсулы
Йод + [Калия йодид + Этанол] раствор для наружного применения
спиртовой
Кагоцел таблетки
Каптоприл таблетки
Клотримазол крем или
мазь для наружного применения;
таблетки вагинальные
Ко-тримоксазол суспензия для приема внутрь;
таблетки
Лоперамид капсулы или
таблетки
Лоратадин сироп для приема внутрь;
таблетки
Левоментола раствор в таблетки
ментил изовалерате
Метилфенилтиометил- капсулы или
диметиламинометил- таблетки
гидроксиброминдол карбоновой
кислоты этиловый эфир
Метоклопрамид таблетки
Мяты перечной масло + капли для приема внутрь
Фенобарбитал +
Этилбромизовалеринат
Нафазолин капли
Нитроголицерин спрей подъязычный дозированный;
таблетки
Нифедипин таблетки
Омепразол капсулы или
таблетки
Осельтамивир порошок для приготовления суспензии для
приема внутрь
Панкреатин капсулы или
таблетки
Парацетамол суспензия для приема внутрь;
суппозитории ректальные;
таблетки
Пилокарпин капли глазные
Ранитидин таблетки
Сальбутамол аэрозоль для ингаляций или
раствор для ингаляций
Сеннозид А + Б таблетки
Спиронолактон капсулы или
таблетки
Тетрациклин мазь глазная
Тимолол капли глазные
Фамотидин таблетки
Фуросемид таблетки
Хлорамфеникол таблетки
Хлоропирамин таблетки
Ципрофлоксацин капли глазные;
капли ушные или
капли глазные и ушные;
таблетки
Эналаприл таблетки
II. Для аптечных пунктов, аптечных киосков и индивидуальных
предпринимателей, имеющих лицензию на фармацевтическую
деятельность
Наименование лекарственного Лекарственные формы
препарата (международное
непатентованное или химическое
или торговое)
Активированный уголь капсулы или
таблетки
Алгелдрат + Магния таблетки;
гидроксид суспензия для приема внутрь
Аскорбиновая кислота драже или
таблетки
Ацетилсалициловая кислота таблетки
Ацетилцистеин гранулы для приготовления раствора
для приема внутрь или
порошок для приготовления раствора
для приема внутрь
Бисакодил суппозитории ректальные;
таблетки
Бриллиантовый зеленый раствор для наружного применения
спиртовой
Гидрокортизон крем для наружного применения или
мазь для наружного применения
Диклофенак гель для наружного применения или
крем для наружного применения
или мазь для наружного применения;
суппозитории ректальные;
таблетки;
капли глазные
Дротаверин таблетки
Ибупрофен капсулы или таблетки;
суспензия для приема внутрь
Йод + [Калия йодид + Этанол] раствор для наружного применения
спиртовой
Кацегол таблетки
Клотримазол крем или
мазь для наружного применения;
таблетки вагинальные
Лоперамид капсулы или
таблетки
Лоратадин сироп для приема внутрь;
таблетки
Левоментола раствор в таблетки
ментил изовалерате
Мяты перечной масло + капли для приема внутрь
Фенобарбитал +
Этилбромизовалеринат
Нафазолин капли
Нафазолин капли
Нитроглицерин спрей подъязычный дозированный
Панкреатин капсулы или таблетки
Парацетамол суспензия для приема внутрь;
суппозитории ректальные;
таблетки
Ранитидин таблетки
Сеннозид А + Б таблетки
Сульфацетамид капли глазные
Тетрациклин мазь глазная
Фамотидин таблетки
Министерство Здравоохранения
Российской Федерации
Приказ
от 16 октября 1997 г. N 305
О нормах отклонений, допустимых при приготовлении лекарственных средств и фасовке промышленной продукции в аптеках
С целью повышения качества лекарственных средств, изготовляемых в условиях аптек, приказываю:
1. Ввести в действие "Инструкцию по оценке качества лекарственных средств, изготовляемых в аптеках" (приложение 1) и "Нормы отклонений, допустимые при изготовлении лекарственных форм (в том числе гомеопатических) и фасовке промышленной продукции в аптеках" (приложения 2, 3, 4).
2. Органам управления здравоохранения и фармацевтическим организациям в субъектах Российской Федерации обеспечить во всех аптеках, аптечных пунктах (с правом изготовления лекарственных средств) и территориальных контрольно-аналитических лабораториях, осуществляющих контроль качества лекарственных средств, изготовляемых в аптеках, выполнение требований "Инструкции по оценке качества лекарственных средств, изготовляемых в аптеках" (приложение 1) и "Норм отклонений, допустимых при изготовлении лекарственных форм (в том числе гомеопатических) и фасовке промышленной продукции в аптеках (приложения 2, 3, 4).
3. Считать недействующими на территории Российской Федерации приказ Министерства здравоохранения СССР от 27.09.91 N 276 "О нормах отклонений, допустимых при изготовлении лекарственных форм и фасовке промышленной продукции в аптеках".
4. Контроль за выполнением настоящего приказа возложить на заместителя Министра Вилькена А.Е.
Министр Т.Б.Дмитриева
Приложение 1
Инструкция
по оценке качества лекарственных средств, изготовляемых в аптеках
(утв. приказом Минздрава РФ от 16 октября 1997 г. N 305)
1. Качество лекарственных средств (в том числе гомеопатических), изготовляемых в аптеках, устанавливается по комплексу показателей, характеризующих их качество.
Уровень качества лекарственных средств оценивается в соответствии с требованиями, регламентированными действующими Государственной Фармакопеей, приказами и инструкциями Министерства здравоохранения Российской Федерации.
См. инструкцию по изготовлению в аптеках жидких лекарственных форм, утв. приказом Минздрава РФ от 21 октября 1997 г. N 308
2. Для оценки качества лекарственных средств, изготовленных в аптеках, применяются два термина; "Удовлетворяется" ("Годная продукция") или "Не удовлетворяет" ("Брак") требованиям действующих требованиям действующих Государственной Фармакопеи, приказов и инструкций Министерства здравоохранения Российской Федерации.
3. Уровень качества изготовленных лекарственных средств определяется органолептическими и измерительными методами.
См. Инструкцию по контролю качества лекарственных средств, изготовляемых в аптеках, утвержденную приказом Минздрава РФ от 16 июля 1997 года N 214
4. Неудовлетворительность изготовленных лекарственных средств устанавливается по следующим показателям их качества:
4.1. Несоответствие по описанию (внешний вид, цвет, запах);
4.2. Несоответствие по прозрачности или цветности;
4.3. Несоответствие по распадаемости;
4.4. Несоответствие по измельченности или смешиванию порошков, мазей, суппозитариев, гомеопатических тритураций;
4.5. Наличие видимых механических включений;
4.6. несоответствие прописи по подлинности;
4.6.1. Ошибочная замена одного лекарственного вещества другим, отсутствие прописанного или наличие непрописанного вещества;
4.6.2. Замена лекарственных средств на аналогичные по фармакологическому действию без обозначения этой замены на требовании, рецепте (копии рецепта, этикетке);
4.7. Отклонения от прописи по массе или объему;
4.7.1. Отклонение по общей массе (объему);
4.7.2. Отклонения по массе отдельных доз и их количеству;
4.7.3. Отклонения по массе навески (или концентрации) отдельных лекарственных веществ;
4.8. Несоответствие по величине рН;
4.9. Несоответствие по величине плотности;
4.10. Несоответствие по стерильности;
4.11. Несоответствие по микробиологической чистоте;
4.12. Нарушение фиксированности укупорки (для стерильных лекарственных форм);
4.13. Нарушение действующих правил оформления лекарственных средств, предназначенных к отпуску.
5. Изменения в составе лекарственных форм (если необходимо) должны производиться с согласия врача, за исключением случаев, установленных действующими Государственной Фармакопеей, приказами и инструкциями Минздрава России и должны отмечаться на требовании, рецепте (копии рецепта, этикетке). При отсутствии указанной отметки на требовании, рецепте (копии рецепта, этикетке) качество изготовления лекарственной формы оценивается "Неудовлетворительно".
6. Изменения в количестве отпущенного лекарственного средства или отпуск таблеток вместо порошков должны также отмечаться на требовании, рецепте (копии рецепта, этикетке).
7. При определении отклонений в проверяемых лекарственных формах следует использовать измерительные средства того же типа (с одинаковыми метрологическими характеристиками), что и при их изготовлении в аптеках.
Начальник Управления
организации обеспечения
лекарствами и медицинской техникой Т.Г.Кисанов
Приложение 2
Нормы отклонений,
допустимые при изготовлении лекарственных форм
(в том числе гомеопатических) в аптеках
(утв. приказом Минздрава РФ от 16 октября 1997 г. N 305)
2.1. Отклонения, допустимые в массе отдельных доз (в том числе при
фасовке)*(1) порошков и общей массе гомеопатических
тритураций*(2)
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 0,1 . +- 15 .
_________________________________________________________________________
. Свыше 0,1 до 0,3 . +- 10 .
_________________________________________________________________________
. Свыше 0,3 до 1 . +- 5 .
_________________________________________________________________________
. Свыше 1 до 10 . +- 3 .
_________________________________________________________________________
. Свыше 10 до 100 . +- 3 .
_________________________________________________________________________
. Свыше 100 до 250 . +- 2 .
_________________________________________________________________________
. Свыше 250 . +- 0,3 .
_________________________________________________________________________
2.2. Отклонения, допустимые в общей массе гранул гомеопатических (в
том числе при фасовке) для одной упаковки
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 1 . +- 5 .
_________________________________________________________________________
. Свыше 1 до 100 . +- 3 .
_________________________________________________________________________
2.3. Отклонения, допустимые в массе отдельных доз суппозиториев и
пилюль
Определяют среднюю массу взвешиванием (с точностью до 0,01 г) не менее 10 суппозиториев*(3) или пилюль.
Отклонения в массе суппозиториев и пилюль от средней массы определяют взвешиванием каждого суппозитория или пилюли с минимальной выборкой 5 штук.
Допустимые отклонения от средней массы не должны превышать:
- для суппозиториев +- 5 %
- для пилюль массой до 0,3 г +- 10 %
- для пилюль массой свыше 0,3 г +- 5 %
2.4. Отклонения, допустимые в массе навески отдельных лекарственных
веществ в порошках, пилюлях и суппозиториях (при изготовлении
методом выкатывания или выливания)*(4)
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 0,02 . +- 20 .
_________________________________________________________________________
. Свыше 0,02 до 0,05 . +- 15 .
_________________________________________________________________________
. Свыше 0,05 до 0,2 . +- 10 .
_________________________________________________________________________
. Свыше 0,2 до 0,3 . +- 8 .
_________________________________________________________________________
. Свыше 0,3 до 0,5 . +- 6 .
_________________________________________________________________________
. Свыше 0,5 до 1 . +- 5 .
_________________________________________________________________________
. Свыше 1 до 2 . +- 4 .
_________________________________________________________________________
. Свыше 2 до 5 . +- 3 .
_________________________________________________________________________
. Свыше 5 до 10 . +- 2 .
_________________________________________________________________________
. Свыше 10 . +- 1 .
_________________________________________________________________________
2.5. Отклонения, допустимые в общем объеме жидких лекарственных форм
при изготовлении массо-объемным способом*(5)
_________________________________________________________________________
. Прописанный объем, мл . Отклонения % .
_________________________________________________________________________
. До 10 . +- 10 .
_________________________________________________________________________
. Свыше 10 до 20 . +- 8 .
_________________________________________________________________________
. Свыше 20 до 50 . +- 4 .
_________________________________________________________________________
. Свыше 50 до 150 . +- 3 .
_________________________________________________________________________
. Свыше 150 до 200 . +- 2 .
_________________________________________________________________________
. Свыше 200 . +- 1 .
_________________________________________________________________________
2.6. Отклонения, допустимые в общем объеме растворов для инъекций,
изготовляемых в виде серийной внутриаптечной заготовки при
фасовке (розливе) в градуированные бутылки для крови
_________________________________________________________________________
. Прописанный объем, мл . Отклонения % .
_________________________________________________________________________
. До 50 . +- 10 .
_________________________________________________________________________
. Свыше 50 . +- 5 .
_________________________________________________________________________
При отмеривании (и фасовке) жидкостей после слива струей дается выдержка на слив капель:
- для невязких жидкостей - в течение 1 мин;
- для вязких - 3 мин.
2.7. Отклонения, допустимые в массе навески отдельных лекарственных
веществ в жидких лекарственных формах при изготовлении
массо-объемным способом*(5)
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 0,02 . +- 20 .
_________________________________________________________________________
. Свыше 0,02 до 0,1 . +- 15 .
_________________________________________________________________________
. Свыше 0,1 до 0,2 . +- 10 .
_________________________________________________________________________
. Свыше 0,2 до 0,5 . +- 8 .
_________________________________________________________________________
. Свыше 0,5 до 0,8 . +- 7 .
_________________________________________________________________________
. Свыше 0,8 до 1 . +- 6 .
_________________________________________________________________________
. Свыше 1 до 2 . +- 5 .
_________________________________________________________________________
. Свыше 2 до 5 . +- 4 .
_________________________________________________________________________
. Свыше 5 . +- 3 .
_________________________________________________________________________
2.8. Отклонения, допустимые в общей массе жидких лекарственных форм
при изготовлении способом по массе*(5)
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 10 . +- 10 .
_________________________________________________________________________
. Свыше 10 до 20 . +- 8 .
_________________________________________________________________________
. Свыше 20 до 50 . +- 5 .
_________________________________________________________________________
. Свыше 50 до 150 . +- 3 .
_________________________________________________________________________
. Свыше 150 до 200 . +- 2 .
_________________________________________________________________________
. Свыше 200 . +- 1 .
_________________________________________________________________________
2.9. Отклонения, допустимые в массе навески отдельных лекарственных
средств в жидких лекарственных формах при изготовлении
способом по массе и в мазях*(5)
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 0,1 . +- 20 .
_________________________________________________________________________
. Свыше 0,1 до 0,2 . +- 15 .
_________________________________________________________________________
. Свыше 0,2 до 0,3 . +- 12 .
_________________________________________________________________________
. Свыше 0,3 до 0,5 . +- 10 .
_________________________________________________________________________
. Свыше 0,5 до 0,8 . +- 8 .
_________________________________________________________________________
. Свыше 0,8 до 1 . +- 7 .
_________________________________________________________________________
. Свыше 1 до 2 . +- 6 .
_________________________________________________________________________
. Свыше 2 до 10 . +- 5 .
_________________________________________________________________________
. Свыше 10 . +- 3 .
_________________________________________________________________________
1. Отклонения, допустимые в массе навески отдельных лекарственных веществ в жидких лекарственных формах при изготовлении способом по массе или массо-объемным способом, а также в мазях, определяются не на концентрацию в процентах, а на массу навески каждого вещества, входящего в эти лекарственные формы (приложение 2, пп. 2.7 и 2.9.).
Например, при изготовлении 10 мл 2% раствора пилокарпина гидрохлорида берут массу навески 0,2 г, для которой допускается отклонение +- 10 %. При анализе достаточно установить, что было взято не менее 0,18 г и не более 0,22 г пилокарпина гидрохлорида.
2.10. Отклонения, допустимые в общей массе мазей
_________________________________________________________________________
. Прописанная масса, г . Отклонения, % .
_________________________________________________________________________
. До 5 . +- 15 .
_________________________________________________________________________
. Свыше 5 до 10 . +- 10 .
_________________________________________________________________________
. Свыше 10 до 20 . +- 8 .
_________________________________________________________________________
. Свыше 20 до 30 . +- 7 .
_________________________________________________________________________
. свыше 30 до 50 . +- 5 .
_________________________________________________________________________
. Свыше 50 до 100 . +- 3 .
_________________________________________________________________________
. Свыше 100 . +- 2 .
_________________________________________________________________________
Примечания:
1. При определении допустимых отклонений в проверяемых лекарственных средствах, изготовленных в виде серий внутриаптечной заготовки, следует пользоваться нормами отклонений, приведенными в приложении 2, пп. 2.1. - 2.10. и в приложении 4, а также в действующей нормативной документации, регламентирующей изготовление и контроль качества различных лекарственных форм в аптеках. (Методические указания по изготовлению и контролю качества лекарственных средств в аптеках; Методические рекомендации по приготовлению, анализу и использованию лекарственных препаратов; Инструкция по приготовлению и контролю качества лекарственных препаратов в условиях аптек).
При изготовлении лекарственных средств в виде серий внутриаптечной заготовки отклонения, допустимые в массе навески отдельных веществ, определяются на массу навески каждого вещества, взятую для изготовления требуемого объема (или массы) данной серии (в одной емкости от одной загрузки препарата).
Например, при изготовлении 2 л 0,9 % раствора натрия хлорида берут массу навески 18 г, для которой допускается отклонение +- 3 %. При химическом контроля достаточно установить, что было взято не менее 17,46 г и не более 18,54 г натрия хлорида.
Отклонения, допустимые в массе навески отдельных веществ в лекарственных средствах, изготовленных в виде серий внутриаптечной заготовки и изъятых из аптеки для проверки, определяются, как указано выше (п.2 и п.3).
Например, на проверку изъята лекарственная форма по прописи:
- Раствор натрия хлорида 0,9 % - 200 мл.
При химическом контроле достаточно установить, что в растворе содержится не менее 1, 71 г и не более 1, 89 г натрия хлорида (отклонение +- 5 %, приложение 2., п.2.7.).
2. При проверке лекарственных средств, изготовляемых в гомеопатических аптеках по индивидуальным прописям, следует пользоваться нормами отклонений, приведенными в приложении 2 (пп. 2.1. - 2.4., 2.8. - 2.10.).
2.11. Отклонения, допустимые в концентратах:*(6)
- при содержании лекарственного вещества до 20 %
не более +- 2 % от обозначенного процента;
- при содержании лекарственного вещества свыше 20 %
не более +- 1 % от обозначенного процента.
2.12. Отклонения, допустимые в гомеопатических тритурациях,
растворах и разведениях жидких лекарственных средств*(7)
- при содержании лекарственного вещества 10 %
(первое десятичное разведение - Д1)
Не более +- 5 % от обозначенного процента;
- при содержании лекарственного вещества 1 %
(второе десятичное разведение - Д2)
не более +- 5 % от обозначенного процента;
- при содержании лекарственного вещества 0,1 %
(третье десятичное разведение - Д3)
не более +- 10 % от обозначенного процента.
Начальник управления
организации обеспечения
лекарствами и медицинской техникой Т.Г.Кирсанов
Приложение 3
Нормы отклонений, допустимые при фасовке промышленной продукции
в аптеках
(утв. приказом Минздрава РФ от 16 октября 1997 г. N 305)
3.1. Отклонения, допустимые при фасовке по массе таблеток, драже,
капсул (ангро) для одной упаковки*(8)
_________________________________________________________________________
. Измеряемая масса, г . Отклонения, % .
_________________________________________________________________________
. Свыше 10 до 100 . +- 3 .
_________________________________________________________________________
. Свыше 100 до 250 . +- 2 .
_________________________________________________________________________
. Свыше 250 . +- 0,3 .
_________________________________________________________________________
3.2. Отклонения, допустимые при фасовке жидких лекарственных форм по
объему (для одной упаковки)
_________________________________________________________________________
. Измеряемый объем, мл . Отклонения, % .
_________________________________________________________________________
. До 5 . +- 8 .
_________________________________________________________________________
. Свыше 5 до 25 . +- 5 .
_________________________________________________________________________
. Свыше 25 до 100 . +- 3 .
_________________________________________________________________________
. Свыше 100 до 300 . +- 1,5 .
_________________________________________________________________________
. Свыше 300 до 1000 . +- 1 .
_________________________________________________________________________
. Свыше 1000 . +- 0,5 .
_________________________________________________________________________
3.3. Отклонения, Допустимые при фасовке жидких лекарственных форм по
массе (для одной упаковки)
_________________________________________________________________________
. Измеряемая масса, г . Отклонения, % .
_________________________________________________________________________
. До 5 . +- 4 .
_________________________________________________________________________
. Свыше 5 до 100 . +- 2 .
_________________________________________________________________________
. Свыше 100 до 5000 . +- 0,6 .
_________________________________________________________________________
3.4. Отклонения, допустимые при фасовке по массе мазей и линиментов
(для одной упаковки)
_________________________________________________________________________
. Измеряемая масса, г . Отклонения, % .
_________________________________________________________________________
. До 5 . +- 5 .
_________________________________________________________________________
. Свыше 5 до 50 . +- 4 .
_________________________________________________________________________
. Свыше 50 до 100 . +- 2,5 .
_________________________________________________________________________
. Свыше 100 до 5000 . +- 1 .
_________________________________________________________________________
3.5. Отклонения, допустимые при фасовке растительного сырья
(для одной упаковки)
_________________________________________________________________________
. Измеряемая масса, г . Отклонения, % .
_________________________________________________________________________
. До 100 . +- 5 .
_________________________________________________________________________
. Свыше 100 до 200 . +- 3 .
_________________________________________________________________________
. Свыше 200 до 1000 . +- 2 .
_________________________________________________________________________
. Свыше 1000 . +- 1 .
_________________________________________________________________________
3.6. Отклонения, допустимые при фасовке ваты (для одной упаковки)
_________________________________________________________________________
. Измеряемая масса, г . Отклонения, % .
_________________________________________________________________________
. Свыше 50 до 100 . +- 8 .
_________________________________________________________________________
. Свыше 100 до 250 . +- 5 .
_________________________________________________________________________
. Свыше 250 . +- 4 .
_________________________________________________________________________
Начальник Управления
организации обеспечения
лекарствами и медицинской техникой Т.Г.Кирсанов
Приложение 4
Погрешности при измерении величины рН*(9)
(утв. приказом Минздрава РФ от 16 октября 1997 г. N 305)
_________________________________________________________________________
. Метод измерения . Минимальная погрешность в единицах .
. . рН при измерении .
. ___________________________________________
. . с интервалом . с интервалом .
. . рН 1 - 2 . рН 0.3 - 0.7 .
_________________________________________________________________________
. Потенциометрический . 0,6 . 0,05 .
_________________________________________________________________________
. Индикаторной бумагой . 1 . 0,3 .
_________________________________________________________________________
_________________________________________________________________________
*(1) В том числе при фасовке порошковыми дозаторами.
*(2) Отклонения, допустимые в массе отдельных доз порошков (в том числе при фасовке), определяются на прописанную дозу одного порошка. Отклонения, допустимые в общей массе гомеопатических тритурация, определяются на прописанную массу тритурация.
*(3) При изготовлении менее 10 штук взвешивают все суппозитории.
*(4) Отклонения, допустимые в массе навески отдельных лекарственных веществ в порошках, пилюлях и суппозиториях (при изготовлении методом выкатывания или выливания), определяются на дозу каждого вещества, входящего в эти лекарственные формы.
*(5) Здесь (п.2.5.) и далее по тексту (стр.7, 8, п.п.2.7 - 2.9) следует иметь в виду, что отклонения предусмотрены для жидких лекарственных форм при изготовлении с использованием как концентратов, так и сухих веществ.
*(6) В п.2.11. (приложение 2) указаны отклонения от концентрации (в процентах), допустимые в концентратах при приготовлении их как массо-объемным способом, так и способом по массе.
*(7) В п.2.12. (приложение 2) указаны отклонения от концентрации (в процентах), допустимые в гомеопатических тритурациях, растворах и разведениях жидких лекарственных средств при приготовлении их в виде концентратов и полуфабрикатов.
*(8) На фасовку поштучно таблеток, драже, капсул в индивидуальную упаковку допустимые отклонения не устанавливаются. Недовложенные единицы лекарственной формы считаются браком.
*(9) Измерения рН проводят в сравнении с водой очищенной или водой для инъекций
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 23 августа 2010 г. N 706н
ОБ УТВЕРЖДЕНИИ ПРАВИЛ ХРАНЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В соответствии со статьей 58 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; N 31, ст. 4161) приказываю:
1. Утвердить Правила хранения лекарственных средств согласно приложению.
2. Признать утратившими силу:
разделы 1 и 2, пункты 3.1 - 3.4, 3.6 и 3.7 раздела 3, разделы 4 - 7, 12 и 13 Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения, утвержденной Приказом Министерства здравоохранения Российской Федерации от 13 ноября 1996 г. N 377 "Об утверждении требований к организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения" (зарегистрирован Минюстом России 22 ноября 1996 г. N 1202).
Министр
Т.А.ГОЛИКОВА
Приложение
к Приказу
Министерства здравоохранения
и социального развития
Российской Федерации
от 23 августа 2010 г. N 706н
ПРАВИЛА
ХРАНЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
I. Общие положения
1. Настоящие Правила устанавливают требования к помещениям для хранения лекарственных средств для медицинского применения (далее - лекарственные средства), регламентируют условия хранения указанных лекарственных средств и распространяются на производителей лекарственных средств, организации оптовой торговли лекарственными средствами, аптечные организации, медицинские и иные организации, осуществляющие деятельность при обращении лекарственных средств, индивидуальных предпринимателей, имеющих лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность (далее соответственно - организации, индивидуальные предприниматели).
II. Общие требования к устройству и эксплуатации помещений хранения лекарственных средств
2. Устройство, состав, размеры площадей (для организаций оптовой торговли лекарственными средствами), эксплуатация и оборудование помещений для хранения лекарственных средств должны обеспечивать их сохранность.
3. В помещениях для хранения лекарственных средств должны поддерживаться определенные температура и влажность воздуха, позволяющие обеспечить хранение лекарственных средств в соответствии с указанными на первичной и вторичной (потребительской) упаковке требованиями производителей лекарственных средств.
4. Помещения для хранения лекарственных средств должны быть оборудованы кондиционерами и другим оборудованием, позволяющим обеспечить хранение лекарственных средств в соответствии с указанными на первичной и вторичной (потребительской) упаковке требованиями производителей лекарственных средств, либо помещения рекомендуется оборудовать форточками, фрамугами, вторыми решетчатыми дверьми.
5. Помещения для хранения лекарственных средств должны быть обеспечены стеллажами, шкафами, поддонами, подтоварниками.
6. Отделка помещений для хранения лекарственных средств (внутренние поверхности стен, потолков) должна быть гладкой и допускать возможность проведения влажной уборки.
III. Общие требования к помещениям для хранения лекарственных средств и организации их хранения
7. Помещения для хранения лекарственных средств должны быть оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или психрометрами). Измерительные части этих приборов должны размещаться на расстоянии не менее 3 м от дверей, окон и отопительных приборов. Приборы и (или) части приборов, с которых производится визуальное считывание показаний, должны располагаться в доступном для персонала месте на высоте 1,5 - 1,7 м от пола.
Показания этих приборов должны ежедневно регистрироваться в специальном журнале (карте) регистрации на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров), который ведется ответственным лицом. Журнал (карта) регистрации хранится в течение одного года, не считая текущего. Контролирующие приборы должны быть сертифицированы, калиброваны и подвергаться поверке в установленном порядке.
8. В помещениях для хранения лекарственные средства размещают в соответствии с требованиями нормативной документации, указанной на упаковке лекарственного препарата, с учетом:
физико-химических свойств лекарственных средств;
фармакологических групп (для аптечных и медицинских организаций);
способа применения (внутреннее, наружное);
агрегатного состояния фармацевтических субстанций (жидкие, сыпучие, газообразные).
При размещении лекарственных средств допускается использование компьютерных технологий (по алфавитному принципу, по кодам).
9. Отдельно, в технически укрепленных помещениях, соответствующих требованиям Федерального закона от 8 января 1998 г. N 3-ФЗ "О наркотических средствах и психотропных веществах" (Собрание законодательства Российской Федерации, 1998, N 2, ст. 219; 2002, N 30, ст. 3033; 2003, N 2, ст. 167, N 27 (ч. I), ст. 2700; 2005, N 19, ст. 1752; 2006, N 43, ст. 4412; 2007, N 30, ст. 3748, N 31, ст. 4011; 2008, N 52 (ч. I), ст. 6233; 2009, N 29, ст. 3614; 2010, N 21, ст. 2525, N 31, ст. 4192), хранятся:
наркотические и психотропные лекарственные средства;
сильнодействующие и ядовитые лекарственные средства, находящиеся под контролем в соответствии с международными правовыми нормами.
10. Стеллажи (шкафы) для хранения лекарственных средств в помещениях для хранения лекарственных средств должны быть установлены таким образом, чтобы обеспечить доступ к лекарственным средствам, свободный проход персонала и, при необходимости, погрузочных устройств, а также доступность стеллажей, стен, пола для уборки.
Стеллажи, шкафы, полки, предназначенные для хранения лекарственных средств, должны быть пронумерованы.
Хранящиеся лекарственные средства должны быть также идентифицированы с помощью стеллажной карты, содержащей информацию о хранящемся лекарственном средстве (наименование, форма выпуска и дозировка, номер серии, срок годности, производитель лекарственного средства). При использовании компьютерных технологий допускается идентификация при помощи кодов и электронных устройств.
11. В организациях и у индивидуальных предпринимателей необходимо вести учет лекарственных средств с ограниченным сроком годности на бумажном носителе или в электронном виде с архивацией. Контроль за своевременной реализацией лекарственных средств с ограниченным сроком годности должен осуществляться с использованием компьютерных технологий, стеллажных карт с указанием наименования лекарственного средства, серии, срока годности либо журналов учета сроков годности. Порядок ведения учета указанных лекарственных средств устанавливается руководителем организации или индивидуальным предпринимателем.
12. При выявлении лекарственных средств с истекшим сроком годности они должны храниться отдельно от других групп лекарственных средств в специально выделенной и обозначенной (карантинной) зоне.
IV. Требования к помещениям для хранения огнеопасных и взрывоопасных лекарственных средств и организации их хранения
13. Помещения для хранения огнеопасных и взрывоопасных лекарственных средств должны полностью соответствовать действующим нормативным документам.
14. С целью обеспечения хранения огнеопасных и взрывоопасных лекарственных средств по принципу однородности в соответствии с их физико-химическими, пожароопасными свойствами и характером упаковки, помещения для хранения организаций оптовой торговли лекарственными средствами и производителей лекарственных средств (далее - складские помещения) разбиваются на отдельные помещения (отсеки) с пределом огнестойкости строительных конструкций не менее 1 часа.
15. Необходимое для фасовки и изготовления лекарственных препаратов для медицинского применения на одну рабочую смену количество огнеопасных лекарственных средств допускается содержать в производственных и иных помещениях. Оставшееся количество огнеопасных лекарственных средств по окончании работы в конце смены передается следующей смене или возвращается на место основного хранения.
16. Полы складских помещений и разгрузочных площадок должны иметь твердое, ровное покрытие. Запрещается применять доски и железные листы для выравнивания полов. Полы должны обеспечивать удобное и безопасное передвижение людей, грузов и транспортных средств, обладать достаточной прочностью и выдерживать нагрузки от хранимых материалов, обеспечивать простоту и легкость уборки складского помещения.
17. Складские помещения для хранения огнеопасных и взрывоопасных лекарственных средств должны быть оборудованы несгораемыми и устойчивыми стеллажами и поддонами, рассчитанными на соответствующую нагрузку. Стеллажи устанавливаются на расстоянии 0,25 м от пола и стен, ширина стеллажей не должна превышать 1 м и иметь, в случае хранения фармацевтических субстанций, отбортовки не менее 0,25 м. Продольные проходы между стеллажами должны быть не менее 1,35 м.
18. Для хранения огнеопасных и взрывоопасных лекарственных средств в аптечных организациях и у индивидуальных предпринимателей выделяются изолированные помещения, оборудуемые средствами автоматической пожарной защиты и сигнализацией (далее - помещения для хранения огнеопасных и взрывоопасных лекарственных средств).
19. В аптечных организациях и у индивидуальных предпринимателей допускается хранение фармацевтических субстанций, обладающих легковоспламеняющимися и горючими свойствами, в объеме до 10 кг вне помещений для хранения огнеопасных и взрывоопасных лекарственных средств во встроенных несгораемых шкафах. Шкафы должны быть удалены от тепловыводящих поверхностей и проходов, с дверьми шириной не менее 0,7 м и высотой не менее 1,2 м. К ним должен быть организован свободный доступ.
Допускается хранение взрывоопасных лекарственных препаратов для медицинского применения (во вторичной (потребительской) упаковке) для использования на одну рабочую смену в металлических шкафах вне помещений для хранения огнеопасных и взрывоопасных лекарственных средств.
20. Количество огнеопасных лекарственных средств, допустимое для хранения в помещениях для хранения огнеопасных и взрывоопасных лекарственных средств, расположенных в зданиях другого назначения, не должно превышать 100 кг в нерасфасованном виде.
Помещения для хранения огнеопасных и взрывоопасных лекарственных средств, используемые для хранения легковоспламеняющихся фармацевтических субстанций в количестве свыше 100 кг, должны находиться в отдельно стоящем здании, а само хранение должно осуществляться в стеклянной или металлической таре изолированно от помещений для хранения огнеопасных лекарственных средств других групп.
21. В помещения для хранения огнеопасных и взрывоопасных лекарственных средств запрещается входить с открытыми источниками огня.
V. Особенности организации хранения лекарственных средств в складских помещениях
22. Лекарственные средства, хранящиеся в складских помещениях, должны размещаться на стеллажах или на подтоварниках (поддонах). Не допускается размещение лекарственных средств на полу без поддона.
Поддоны могут располагаться на полу в один ряд или на стеллажах в несколько ярусов, в зависимости от высоты стеллажа. Не допускается размещение поддонов с лекарственными средствами в несколько рядов по высоте без использования стеллажей.
23. При ручном способе разгрузочно-погрузочных работ высота укладки лекарственных средств не должна превышать 1,5 м.
При использовании механизированных устройств для проведения разгрузочно-погрузочных работ лекарственные средства должны храниться в несколько ярусов. При этом общая высота размещения лекарственных средств на стеллажах не должна превышать возможности механизированных погрузочно-разгрузочных средств (подъемники, автокары, тали).
VI. Особенности хранения отдельных групп лекарственных средств в зависимости от физических и физико-химических свойств, воздействия на них различных факторов внешней среды
Хранение лекарственных средств, требующих защиты от действия света
24. Лекарственные средства, требующие защиты от действия света, хранятся в помещениях или специально оборудованных местах, обеспечивающих защиту от естественного и искусственного освещения.
25. Фармацевтические субстанции, требующие защиты от действия света, следует хранить в таре из светозащитных материалов (стеклянной таре оранжевого стекла, металлической таре, упаковке из алюминиевой фольги или полимерных материалов, окрашенных в черный, коричневый или оранжевый цвета), в темном помещении или шкафах.
Для хранения особо чувствительных к свету фармацевтических субстанций (нитрат серебра, прозерин) стеклянную тару оклеивают черной светонепроницаемой бумагой.
26. Лекарственные препараты для медицинского применения, требующие защиты от действия света, упакованные в первичную и вторичную (потребительскую) упаковку, следует хранить в шкафах или на стеллажах при условии принятия мер для предотвращения попадания на указанные лекарственные препараты прямого солнечного света или иного яркого направленного света (использование светоотражающей пленки, жалюзи, козырьков и др.).
Хранение лекарственных средств, требующих защиты от воздействия влаги
27. Фармацевтические субстанции, требующие защиты от воздействия влаги, следует хранить в прохладном месте при температуре до +15 град. C (далее - прохладное место), в плотно укупоренной таре из материалов, непроницаемых для паров воды (стекла, металла, алюминиевой фольги, толстостенной пластмассовой таре) или в первичной и вторичной (потребительской) упаковке производителя.
28. Фармацевтические субстанции с выраженными гигроскопическими свойствами следует хранить в стеклянной таре с герметичной укупоркой, залитой сверху парафином.
29. Во избежание порчи и потери качества следует организовать хранение лекарственных средств в соответствии с требованиями, нанесенными в виде предупреждающих надписей на вторичной (потребительской) упаковке лекарственного средства.
Хранение лекарственных средств, требующих защиты от улетучивания и высыхания
30. Фармацевтические субстанции, требующие защиты от улетучивания и высыхания (собственно летучие лекарственные средства; лекарственные средства, содержащие летучий растворитель (спиртовые настойки, жидкие спиртовые концентраты, густые экстракты); растворы и смеси летучих веществ (эфирные масла, растворы аммиака, формальдегида, хлористого водорода свыше 13%, карболовой кислоты, этиловый спирт различной концентрации и др.); лекарственное растительное сырье, содержащее эфирные масла; лекарственные средства, содержащие кристаллизационную воду, - кристаллогидраты; лекарственные средства, разлагающиеся с образованием летучих продуктов (йодоформ, перекись водорода, гидрокарбонат натрия); лекарственные средства с определенным нижним пределом влагосодержания (сульфат магния, парааминосалицилат натрия, сульфат натрия)), следует хранить в прохладном месте, в герметически укупоренной таре из непроницаемых для улетучивающихся веществ материалов (стекла, металла, алюминиевой фольги) или в первичной и вторичной (потребительской) упаковке производителя. Применение полимерной тары, упаковки и укупорки допускается в соответствии с требованиями государственной фармакопеи и нормативной документации.
31. Фармацевтические субстанции - кристаллогидраты следует хранить в герметично укупоренной стеклянной, металлической и толстостенной пластмассовой таре или в первичной и вторичной (потребительской) упаковке производителя в условиях, соответствующих требованиям нормативной документации на данные лекарственные средства.
Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры
32. Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры (термолабильные лекарственные средства), организации и индивидуальные предприниматели должны осуществлять в соответствии с температурным режимом, указанным на первичной и вторичной (потребительской) упаковке лекарственного средства в соответствии с требованиями нормативной документации.
Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры
33. Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры (лекарственные средства, физико-химическое состояние которых после замерзания изменяется и при последующем согревании до комнатной температуры не восстанавливается (40% раствор формальдегида, растворы инсулина)), организации и индивидуальные предприниматели должны осуществлять в соответствии с температурным режимом, указанным на первичной и вторичной (потребительской) упаковке лекарственного средства в соответствии с требованиями нормативной документации.
34. Замерзание препаратов инсулина не допускается.
Хранение лекарственных средств, требующих защиты от воздействия газов, содержащихся в окружающей среде
35. Фармацевтические субстанции, требующие защиты от воздействия газов (вещества, реагирующие с кислородом воздуха: различные соединения алифатического ряда с непредельными межуглеродными связями, циклические с боковыми алифатическими группами с непредельными межуглеродными связями, фенольные и полифенольные, морфин и его производные с незамещенными гидроксильными группами; серосодержащие гетерогенные и гетероциклические соединения, ферменты и органопрепараты; вещества, реагирующие с углекислым газом воздуха: соли щелочных металлов и слабых органических кислот (барбитал натрий, гексенал), лекарственные препараты, содержащие многоатомные амины (эуфиллин), окись и перекись магния, едкий натрий, едкий калий), следует хранить в герметически укупоренной таре из материалов, непроницаемых для газов, по возможности заполненной доверху.
Хранение пахучих и красящих лекарственных средств
36. Пахучие лекарственные средства (фармацевтические субстанции как летучие, так и практически нелетучие, но обладающие сильным запахом) следует хранить в герметически закрытой таре, непроницаемой для запаха.
37. Красящие лекарственные средства (фармацевтические субстанции, которые оставляют окрашенный след, не смываемый обычной санитарно-гигиенической обработкой, на таре, укупорочных средствах, оборудовании и инвентаре (бриллиантовый зеленый, метиленовый синий, индигокармин)) следует хранить в специальном шкафу в плотно укупоренной таре.
38. Для работы с красящими лекарственными средствами для каждого наименования необходимо выделять специальные весы, ступку, шпатель и другой необходимый инвентарь.
Хранение дезинфицирующих лекарственных средств
39. Дезинфицирующие лекарственные средства следует хранить в герметично укупоренной таре в изолированном помещении вдали от помещений хранения пластмассовых, резиновых и металлических изделий и помещений получения дистиллированной воды.
Хранение лекарственных препаратов для медицинского применения
40. Хранение лекарственных препаратов для медицинского применения осуществляется в соответствии с требованиями государственной фармакопеи и нормативной документации, а также с учетом свойств веществ, входящих в их состав.
41. При хранении в шкафах, на стеллажах или полках лекарственные препараты для медицинского применения во вторичной (потребительской) упаковке должны быть размещены этикеткой (маркировкой) наружу.
42. Организации и индивидуальные предприниматели должны осуществлять хранение лекарственных препаратов для медицинского применения в соответствии с требованиями к их хранению, указанными на вторичной (потребительской) упаковке указанного лекарственного препарата.
Хранение лекарственного растительного сырья
43. Нерасфасованное лекарственное растительное сырье должно храниться в сухом (не более 50% влажности), хорошо проветриваемом помещении в плотно закрытой таре.
44. Нерасфасованное лекарственное растительное сырье, содержащее эфирные масла, хранится изолированно в хорошо укупоренной таре.
45. Нерасфасованное лекарственное растительное сырье должно подвергаться периодическому контролю в соответствии с требованиями государственной фармакопеи. Трава, корни, корневища, семена, плоды, утратившие нормальную окраску, запах и требуемое количество действующих веществ, а также пораженные плесенью, амбарными вредителями, бракуют.
46. Хранение лекарственного растительного сырья, содержащего сердечные гликозиды, осуществляется с соблюдением требований государственной фармакопеи, в частности, требования о повторном контроле на биологическую активность.
47. Нерасфасованное лекарственное растительное сырье, включенное в списки сильнодействующих и ядовитых веществ, утвержденные Постановлением Правительства Российской Федерации от 29 декабря 2007 г. N 964 "Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации" (Собрание законодательства Российской Федерации, 2008, N 2, ст. 89; 2010, N 28, ст. 3703), хранится в отдельном помещении или в отдельном шкафу под замком.
48. Расфасованное лекарственное растительное сырье хранится на стеллажах или в шкафах.
Хранение медицинских пиявок
49. Хранение медицинских пиявок осуществляется в светлом помещении без запаха лекарств, для которого устанавливается постоянный температурный режим.
50. Содержание пиявок осуществляется в установленном порядке.
Хранение огнеопасных лекарственных средств
51. Хранение огнеопасных лекарственных средств (лекарственные средства, обладающие легковоспламеняющимися свойствами (спирт и спиртовые растворы, спиртовые и эфирные настойки, спиртовые и эфирные экстракты, эфир, скипидар, молочная кислота, хлорэтил, коллодий, клеол, жидкость Новикова, органические масла); лекарственные средства, обладающие легкогорючими свойствами (сера, глицерин, растительные масла, лекарственное растительное сырье)) должно осуществляться отдельно от других лекарственных средств.
52. Легковоспламеняющиеся лекарственные средства хранят в плотно укупоренной прочной, стеклянной или металлической таре, чтобы предупредить испарение жидкостей из сосудов.
53. Бутыли, баллоны и другие крупные емкости с легковоспламеняющимися и легкогорючими лекарственными средствами должны храниться на полках стеллажей в один ряд по высоте. Запрещается их хранение в несколько рядов по высоте с использованием различных прокладочных материалов.
Не допускается хранение указанных лекарственных средств у отопительных приборов. Расстояние от стеллажа или штабеля до нагревательного элемента должно быть не менее 1 м.
54. Хранение бутылей с легковоспламеняющимися и легкогорючими фармацевтическими субстанциями должно осуществляться в таре, предохраняющей от ударов, или в баллоно-опрокидывателях в один ряд.
55. На рабочих местах производственных помещений, выделяемых в аптечных организациях и индивидуальными предпринимателями, легковоспламеняющиеся и легкогорючие лекарственные средства могут храниться в количествах, не превышающих сменную потребность. При этом емкости, в которых они хранятся, должны быть плотно закрыты.
56. Не допускается хранение легковоспламеняющихся и легкогорючих лекарственных средств в полностью заполненной таре. Степень заполнения должна быть не более 90% объема. Спирты в больших количествах хранятся в металлических емкостях, заполняемых не более чем на 75% объема.
57. Не допускается совместное хранение легковоспламеняющихся лекарственных средств с минеральными кислотами (особенно серной и азотной кислотами), сжатыми и сжиженными газами, легкогорючими веществами (растительными маслами, серой, перевязочным материалом), щелочами, а также с неорганическими солями, дающими с органическими веществами взрывоопасные смеси (калия хлорат, калия перманганат, калия хромат и др.).
58. Эфир медицинский и эфир для наркоза хранят в промышленной упаковке, в прохладном, защищенном от света месте, вдали от огня и нагревательных приборов.
Хранение взрывоопасных лекарственных средств
59. При хранении взрывоопасных лекарственных средств (лекарственные средства, обладающие взрывчатыми свойствами (нитроглицерин); лекарственные средства, обладающие взрывоопасными свойствами (калия перманганат, серебра нитрат)) следует принимать меры против загрязнения их пылью.
60. Емкости с взрывоопасными лекарственными средствами (штангласы, жестяные барабаны, склянки и др.) необходимо плотно закрывать во избежание попадания паров этих средств в воздух.
61. Хранение нерасфасованного калия перманганата допускается в специальном отсеке складских помещений (где он хранится в жестяных барабанах), в штангласах с притертыми пробками отдельно от других органических веществ - в аптечных организациях и у индивидуальных предпринимателей.
62. Нерасфасованный раствор нитроглицерина хранится в небольших хорошо укупоренных склянках или металлических сосудах в прохладном, защищенном от света месте, с соблюдением мер предосторожности от огня. Передвигать посуду с нитроглицерином и отвешивать этот препарат следует в условиях, исключающих пролив и испарение нитроглицерина, а также попадание его на кожу.
63. При работе с диэтиловым эфиром не допускается встряхивание, удары, трение.
64. Запрещается хранение взрывоопасных лекарственных средств с кислотами и щелочами.
Хранение наркотических и психотропных лекарственных средств
65. Наркотические и психотропные лекарственные средства хранятся в организациях в изолированных помещениях, специально оборудованных инженерными и техническими средствами охраны, и в местах временного хранения при соблюдении требований согласно Правилам хранения наркотических средств и психотропных веществ, установленных Постановлением Правительства Российской Федерации от 31 декабря 2009 г. N 1148 (Собрание законодательства Российской Федерации, 2010, N 4, ст. 394; N 25, ст. 3178).
Хранение сильнодействующих и ядовитых лекарственных средств, лекарственных средств, подлежащих предметно-количественному учету
66. В соответствии с Постановлением Правительства Российской Федерации от 29 декабря 2007 г. N 964 "Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации" к сильнодействующим и ядовитым лекарственным средствам относятся лекарственные средства, содержащие сильнодействующие и ядовитые вещества, включенные в списки сильнодействующих веществ и ядовитых веществ.
67. Хранение сильнодействующих и ядовитых лекарственных средств, находящихся под контролем в соответствии с международными правовыми нормами (далее - сильнодействующие и ядовитые лекарственные средства, находящиеся под международным контролем), осуществляется в помещениях, оборудованных инженерными и техническими средствами охраны, аналогичными предусмотренным для хранения наркотических и психотропных лекарственных средств.
68. Допускается хранение в одном технически укрепленном помещении сильнодействующих и ядовитых лекарственных средств, находящихся под международным контролем, и наркотических и психотропных лекарственных средств.
При этом хранение сильнодействующих и ядовитых лекарственных средств должно осуществляться (в зависимости от объема запасов) на разных полках сейфа (металлического шкафа) или в разных сейфах (металлических шкафах).
69. Хранение сильнодействующих и ядовитых лекарственных средств, не находящихся под международным контролем, осуществляется в металлических шкафах, опечатываемых или пломбируемых в конце рабочего дня.
70. Лекарственные средства, подлежащие предметно-количественному учету в соответствии с Приказом Министерства здравоохранения и социального развития Российской Федерации от 14 декабря 2005 г. N 785 "О порядке отпуска лекарственных средств" (зарегистрирован в Министерстве юстиции Российской Федерации 16 января 2006 г. N 7353), за исключением наркотических, психотропных, сильнодействующих и ядовитых лекарственных средств, хранятся в металлических или деревянных шкафах, опечатываемых или пломбируемых в конце рабочего дня.
Распоряжение Правительства Российской Федерации от 6 июля 2010 г. N 1141-р г. Москва
В целях повышения экономической доступности лекарственных средств для лечения наиболее распространенных заболеваний утвердить прилагаемый перечень стратегически значимых лекарственных средств, производство которых должно быть обеспечено на территории Российской Федерации.
Председатель Правительства Российской Федерации В. Путин
Перечень стратегически значимых лекарственных средств, производство которых должно быть обеспечено на территории Российской Федерации
1. Абакавир
2. Алтеплаза
3. Бевацизумаб
4. Бортезомиб
5. Бупивакаин
6. Бусульфан
7. Вакцина против полиомиелита инактивированная
8. Висмута трикалия дицитрат
9. Гадодиамид
10. Гидроксикарбамид
11. Гидроксихлорохин
12. Глатирамера ацетат
13. Дарунавир
14. Дорназа альфа
15. Зафирлукаст
16. Иматиниб
17. Имиглюцераза
18. Йогексол
19. Капецитабин
20. Кармустин
21. Ламивудин
22. Ламивудин + Зидовудин
23. Ломустин
24. Мелфалан
25. Микофеноловая кислота
26. Невирапин
27. Нелфинавир
28. Нимодипин
29. Порактант альфа
30. Прокарбазин
31. Пропофол
32. Пэгинтерферон альфа
33. Ралтитрексид
34. Ритонавир
35. Ритуксимаб
36. Рифамицин
37. Ропивакаин
38. Саквинавир
39. Севофлуран
40. Соталол
41. Сульфасалазин
42. Такролимус
43. Темозоломид
44. Тиотропия бромид
45. Тобрамицин
46. Трастузумаб
47. Третиноин
48. Трипторелин
49. Фактор свертывания крови VII
50. Факторы свертывания крови II, IX и X в комбинации
51. Фенспирид
52. Формотерол
53. Фулвестрант
54. Эноксапарин натрия
55. Энфувиртид
56. Эптаког альфа (активированный)
57. Эфавиренз
Приказ № 705н от 9.12.2008 Об утверждении порядка совершенствования профессиональных знаний медицинских и фармацевтических работников
Зарегистрирован в Минюсте РФ 3 марта 2009 г. № 13459
Вступает в силу 10 апреля 2009 г.
В соответствии с пунктом 5.2.24 Положения о Министерстве здравоохранения и социального развития Российской Федерации, утверждённого постановлением Правительства Российской Федерации от 30 июня 2004 г. № 321 (Собрание законодательства Российской Федерации, 2004, № 28, ст. 2898; 2005, № 2, ст. 162; 2006, № 19, ст. 2080, 2008, № 11, ст. 1036; № 15, ст. 1555; № 23, ст. 2713; № 42, ст. 4825; № 46, ст. 5337; № 48, ст. 5618)
ПРИКАЗЫВАЮ:
Утвердить Порядок совершенствования профессиональных знаний медицинских и фармацевтических работников согласно приложению.
Министр
Т.А. Голикова
ПРИЛОЖЕНИЕ
к Приказу
Минздравсоцразвития России
от 9 декабря 2008 г. № 705н
Порядок совершенствования профессиональных знаний медицинских и фармацевтических работников
1. Настоящий Порядок определяет правила организации совершенствования профессиональных знаний (профессиональной переподготовки и повышения квалификации) медицинских и фармацевтических работников, окончивших образовательные учреждения высшего профессионального образования по специальностям группы «Здравоохранение», занимающихся или претендующих на занятие медицинской или фармацевтической деятельностью (далее — специалисты, слушатели).
2. Профессиональная переподготовка и повышение квалификации специалистов осуществляется в целях получения дополнительных знаний, умений и практических навыков, необходимых для осуществления самостоятельной профессиональной деятельности.
Профессиональная переподготовка для выполнения нового вида профессиональной деятельности осуществляется на основании установленных квалификационных требований к конкретным должностям.
3. Задачи профессиональной переподготовки и повышения квалификации специалистов определяются в соответствии с Типовым положением об образовательном учреждении дополнительного профессионального образования (повышении квалификации) специалистов, утверждённым Постановлением Правительства Российской Федерации от 26 июня 1995 г. № 610 (Собрание законодательства Российской Федерации, 1995, № 27, ст. 2580; 2000, № 12, ст. 1291; 2002, № 52 (ч. II), ст. 5225; 2003, № 14, ст. 1276).
4. Профессиональная переподготовка и повышение квалификации специалистов проводится образовательными учреждениями высшего и дополнительного профессионального образования, имеющими государственную аккредитацию (далее — образовательное учреждение), по образовательным программам, учитывающим имеющийся по всем разделам специальности уровень знаний, умений, практических навыков и результаты вступительных испытаний. Вступительные испытания являются обязательными. Образовательное учреждение самостоятельно определяет содержание, процедуру и форму вступительных испытаний.
5. Профессиональная переподготовка и повышение квалификации специалистов проводится с отрывом от работы, без отрыва от работы, с частичным отрывом от работы и по индивидуальным формам обучения при наступлении очередного пятилетнего срока дополнительного профессионального образования.
6. Сроки, формы, содержание и технология обучения определяются образовательным учреждением, реализующим соответствующую образовательную программу, самостоятельно в соответствии с потребностями заказчика.
6.1. Для специалистов, имеющих стаж работы по специальности 10 лет и более, обучение проводится по образовательным программам повышения квалификации. Нормативный срок прохождения повышения квалификации при любой форме обучения составляет от 100 до 500 часов аудиторных занятий.
6.2. Для специалистов, имеющих стаж работы по специальности от 5 до 10 лет, обучение проводится по образовательным программам профессиональной переподготовки. Нормативный срок прохождения профессиональной переподготовки при любой форме обучения составляет свыше 500 часов аудиторных занятий.
6.3. Для специалистов, имеющих стаж работы менее 5 лет, профессиональная подготовка организуется в соответствии с требованиями, определёнными Приказом Минздравсоцразвития России от 11 марта 2008 г. «О номенклатуре специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации» (зарегистрирован Министерством юстиции Российской Федерации 20 марта 2008 г. № 11384).
7. В целях совершенствования практических навыков на базе научных и образовательных учреждений в качестве одного из разделов учебного плана образовательной программы повышения квалификации или профессиональной переподготовки может быть предусмотрена стажировка специалистов, продолжительность которой определяется учебным планом.
8. Уровень профессиональных знаний, умений и практических навыков специалистов, прошедших профессиональную переподготовку или повышение квалификации, оценивается образовательным учреждением по всем разделам соответствующей образовательной программы.
Освоение образовательных программ профессиональной переподготовки и повышения квалификации завершается обязательной государственной итоговой аттестацией.
9. Слушателям, освоившим образовательную программу повышения квалификации и успешно прошедшим государственную итоговую аттестацию, выдаётся свидетельство о повышении квалификации государственного образца.
Слушателям, освоившим образовательную программу профессиональной переподготовки и успешно прошедшим государственную итоговую аттестацию, выдаётся диплом о профессиональной переподготовке государственного образца.
10. Специалисты, освоившие образовательные программы повышения квалификации и профессиональной переподготовки, могут продолжать замещать в учреждениях здравоохранения врачебные и провизорские должности, соответствующие Номенклатуре специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации, утвержденной Приказом Минздравсоцразвития России от 11 марта 2008 г. № 112н (зарегистрирован Министерством юстиции Российской Федерации 20 марта 2008 г. № 11384).
Письмо Минздравсоцразвития РФ № 16-4/10/2-1797 от 19 марта 2009 г.
Министерство здравоохранения и социального развития Российской Федерации направляет Приказ от 9 декабря 2008 г. № 705н «Об утверждении Порядка совершенствования профессиональных знаний медицинских и фармацевтических работников», зарегистрированный в Министерстве юстиции Российской Федерации 3 марта 2009 г. № 13459, и сообщает, что в соответствии с Указом Президента Российской Федерации от 23 мая 1996 г. № 763 Приказ вступает в силу по истечении 10 дней после дня официального опубликования.
Приказ согласован с Министерством образования и науки Российской Федерации.
Порядок совершенствования профессиональных знаний медицинских и фармацевтических работников (далее — Порядок), утверждённый настоящим Приказом, распространяется на лиц (далее — медицинские специалисты, специалисты), имеющих высшее медицинское и фармацевтическое образование, не соответствующее занимаемым должностям в учреждениях здравоохранения, не получивших послевузовского и (или) дополнительного профессионального образования, установленного действующими нормативными правовыми актами, но имеющих опыт практической работы по врачебной (провизорской) специальности и осуществляющих непрерывную деятельность по соответствующим специальностям более 5 лет.
На основании документов, подтверждающих получение высшего, послевузовского и дополнительного профессионального образования, стаж профессиональной деятельности по специальности, и с учетом итогов проведенного вступительного испытания образовательное учреждение в соответствии с пунктом 6 Порядка самостоятельно определяет сроки, формы, содержание и технологии обучения.
Продолжительность обучения устанавливается образовательным учреждением с учётом продолжительности ранее освоенных учебных планов и программ, имеющегося уровня профессиональных знаний, умений и практических навыков у конкретного специалиста.
Кроме документов об образовании государственного (высшее и дополнительное профессиональное образование, аспирантура) и ведомственного (интернатура, ординатура) образца, могут учитываться документы, выданные образовательными и научно-исследовательскими учреждениями и учреждениями здравоохранения, подтверждающие прохождение стажировки.
Основным документом о трудовой деятельности и трудовом стаже является трудовая книжка.
В образовательных учреждениях, находящихся в ведении Минздравсоцразвития России, сложилась форма итогового контроля знаний — квалификационный экзамен, который предлагается сохранить до введения иных форм.
Наряду с документами о дополнительном профессиональном образовании государственного образца выдаётся (подтверждается) сертификат специалиста, предусмотренный статьей 54 Основ законодательства Российской Федерации об охране здоровья граждан, в качестве документа, подтверждающего право заниматься медицинской и фармацевтической деятельностью в Российской Федерации.
Лицам с высшим медицинским и фармацевтическим образованием, не получившим послевузовского и дополнительного профессионального образования, установленного действующими нормативными правовыми актами, но имеющим стаж работы по специальности более 5 лет, необходимо выдать в дополнение к сертификату справку на бланке учреждения согласно приложению.
Обращаем внимание на то, что в соответствии с Федеральным законом от 27 июля 2006 г. № 152-ФЗ «О персональных данных» персональные данные — это любая информация, относящаяся к определённому или определяемому лицу, в том числе фамилия, имя, отчество, год, месяц, дата и место рождения, адрес, образование, профессия и другая информация (статья 3). Обработка персональных данных может осуществляться с согласия субъектов персональных данных (статьи 6 и 9).
В.И. Скворцова
Приложение
к Сертификату №____
___________________________________________________________________________
(фамилия, имя, отчество)
прошел (прошла) повышение квалификации (профессиональную
переподготовку) в порядке, предусмотренном Приказом Минздравсоцразвития
России от 9 декабря 2008 г. № 705н "Об утверждении Порядка
совершенствования профессиональных знаний медицинских и фармацевтических
работников", по специальности _____________________________________________
___________________________________________________________________________
(наименование специальности)
в объеме ____________ часов очной части, _____________ часов заочной части,
завершил(а) стажировку ____________________________________________________
(наименование научного и образовательного
___________________________________________________________________________
учреждения, учебного плана и программы)
продолжительностью ________________ месяцев.
Итоги квалификационного экзамена (дата ____________________, протокол № __)
свидетельствуют о том, что дополнительное профессиональное образование,
полученное ________________________________________________________________
(фамилия, инициалы)
по объему и совокупности изученных дисциплин, соответствует требованиям,
предъявляемым к подготовке по специальности ______________________________,
(наименование специальности)
а профессиональные знания, умения и практические навыки достаточны для
выполнения самостоятельной профессиональной деятельности.
Ректор _____________ ___________________________
(подпись) (расшифровка подписи)
МП
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
ПРИКАЗ
30 августа 1991 г.
N 245
О НОРМАТИВАХ ПОТРЕБЛЕНИЯ ЭТИЛОВОГО СПИРТА ДЛЯ УЧРЕЖДЕНИЙ
ЗДРАВООХРАНЕНИЯ, ОБРАЗОВАНИЯ И СОЦИАЛЬНОГО ОБЕСПЕЧЕНИЯ
В целях улучшения качества медицинской помощи населению и более рационального использования спирта
Утверждаю:
1. Нормативы потребления этилового спирта для учреждений здравоохранения, образования и социального обеспечения (приложение 1).
2. Ориентировочные нормы расхода этилового спирта для подразделений лечебно-профилактических учреждений (приложение 2).
3. Ориентировочные нормы расхода этилового спирта на медицинские процедуры (приложение 3).
Приказываю:
1. Министерствам здравоохранения союзных и автономных республик, руководителям краевых, областных и городских органов здравоохранения, главных аптечных управлений и объединений "Фармация" минздравов союзных республик, краевых, областных и городских аптечных управлений (объединений "Фармация"):
1.1. При определении потребности учреждений здравоохранения, образования и социального обеспечения в этиловом спирте руководствоваться нормативами, утвержденными настоящим приказом (приложение 1).
1.2. Разрабатывать и утверждать при необходимости нормативы потребления этилового спирта для отдельных учреждений, отделений и кабинетов, а также нормы расхода на различные медицинские процедуры с учетом используемого оборудования, методик лечения и объема работы.
1.3. Предоставить право руководителям учреждений здравоохранения распределять этиловый спирт между отделениями и кабинетами в пределах общего объема спирта, выделенного учреждению, используя при необходимости нормы, приведенные в приложении 2 настоящего приказа.
1.4. При распределении потребности аптек в этиловом спирте расчет производить с учетом только экстемпоральной рецептуры.
1.5. Разрешить аптечным управлениям (объединениям "Фармация") общее количество спирта для изготовления лекарств распределять между аптеками с учетом специфики рецептуры, установив в случае необходимости индивидуальные нормативы.
1.6. Отпуск этилового спирта учреждениям здравоохранения производить на основании требований, подписанных руководителем учреждения (отделения) и заверенных печатью учреждения по отдельной доверенности, оформленной в установленном порядке и дающей право на получение спирта в течение одного месяца. Спирт отпускать в весовом измерении по цене, установленной для лечебно-профилактических учреждений.
1.7. Установить, что руководители учреждений здравоохранения несут персональную ответственность за правильность назначения, хранения, учета и отпуска этилового спирта и рациональность его использования.
2. Считать утратившими силу приказы Минздрава СССР от 16.09.69 N 675; от 28.09.73 N 774; от 15.07.76 N 693; от 17.08.77 N 762; от 24.04.72 N 325; от 11.10.83 N 1196; от 18.06.84 N 694; от 30.05.85 N 737.
3. Контроль за выполнением настоящего приказа возложить на Главное управление общественного здравоохранения и медико-социальных программ Минздрава СССР (т.Карпеев А.А.) и на В/О "Союзфармация" (т. Апазов А.Д.).
Разрешаю размножить приказ в необходимых количествах и довести до сведения учреждений здравоохранения.
Заместитель Министра
А.М.МОСКВИЧЕВ
Приложение N 1
к приказу Минздрава СССР
от 30 августа 1991 г. N 245
НОРМАТИВЫ
ПОТРЕБЛЕНИЯ ЭТИЛОВОГО СПИРТА ДЛЯ УЧРЕЖДЕНИЙ
ЗДРАВООХРАНЕНИЯ, ОБРАЗОВАНИЯ И СОЦИАЛЬНОГО ОБЕСПЕЧЕНИЯ
----T----------------------------T---------------------------T----------¬
¦ NN¦ ¦ ¦ Норматив ¦
¦ пп¦ Наименование учреждения ¦ Расчетные показатели ¦ в граммах¦
+---+----------------------------+---------------------------+----------+
¦ 1 ¦ 2 ¦ 3 ¦ 4 ¦
+---+----------------------------+---------------------------+----------+
¦ ¦I. Аптечные учреждения ¦ на 1000 экстемпоральных ¦ ¦
¦ ¦ ¦ рецептов ¦ 2800 ¦
¦ ¦II. Лечебно-профилактические¦ ¦ ¦
¦ ¦ учреждения: ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 1.¦Больничные учреждения ¦ на 1 пролеченного больного¦ ¦
¦ ¦ ¦ хирургического профиля ¦ 400 ¦
¦ ¦ ¦ на 1 пролеченного больного¦ ¦
¦ ¦ ¦ терапевтического профиля ¦ 170 ¦
¦ ¦ ¦ ¦ ¦
¦ 2.¦Амбулаторно-поликлинические ¦ на 1 прикрепленного жителя¦ ¦
¦ ¦учреждения ¦ в год ¦ 50<*> ¦
¦ ¦ ¦ ¦ ¦
¦ 3.¦Вспомогательные подразделе- ¦ на 1000 посещений ¦ 9500 ¦
¦ ¦ния лечебно-профилактических¦ ¦ ¦
¦ ¦учреждений ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 4.¦Клинико-диагностические ¦на 1000 анализов всех видов¦ 2000 ¦
¦ ¦лаборатории лечебно-профи- ¦ ¦ ¦
¦ ¦лактических учреждений ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 5.¦Лечебно-профилактические ¦ ¦ ¦
¦ ¦учреждения особого типа ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦5.1¦ Лепрозории ¦ на 1000 посещений в ¦ ¦
¦ ¦ ¦ поликлинике ¦ 800 ¦
¦5.2¦ Центры по профилактике и ¦ на 1 исследование ¦ 10 ¦
¦ ¦борьбе со СПИДом ¦ на 1 больного в стационаре¦ 200 ¦
¦ ¦ ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 6.¦Учреждения скорой и неот- ¦ ¦ ¦
¦ ¦ложной медицинской помощи ¦ ¦ ¦
¦ ¦и переливания крови ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦6.1¦ Станции скорой медицинс- ¦ на 1000 вызовов на линей- ¦ ¦
¦ ¦ кой помощи ¦ ной машине ¦ 2000 ¦
¦ ¦ ¦ на специально оборудо- ¦ ¦
¦ ¦ ¦ ванной машине ¦ 5000 ¦
¦6.2¦ Станции (отделения) ¦ Пользоваться действующими ¦ ¦
¦ ¦ переливания крови ¦ нормативами,утвержденными ¦ ¦
¦ ¦ ¦ МЗ СССР 24.11.89 г. ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 7.¦ Учреждения охраны мате- ¦ ¦ ¦
¦ ¦ ринства и детства ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦7.1¦ Дома ребенка ¦ на 1 место в год ¦ 140 ¦
¦ ¦ ¦ ¦ ¦
¦7.2¦ Молочные кухни ¦ на производство 1000 ¦ ¦
¦ ¦ ¦ порций ¦ 1,2 ¦
¦7.3¦ Родильный дом ¦ на 1 роженицу ¦ 110 ¦
¦ ¦ ¦ ¦ ¦
¦ 8.¦ Санаторно-курортные уч- ¦ ¦ ¦
¦ ¦ реждения ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦8.1¦ Санатории ¦ ¦ ¦
¦ ¦ - костно-туберкулезные ¦ на 1 койку в год ¦ 1500 ¦
¦ ¦ - легочно-туберкулезные ¦ - " - ¦ 900 ¦
¦ ¦ - других видов ¦ - " - ¦ 700 ¦
¦ ¦ ¦ ¦ ¦
¦8.2¦ Санатории-профилактории ¦ - " - ¦ 250 ¦
¦ ¦ ¦ ¦ ¦
¦8.3¦ Курортные поликлиники ¦ на 1000 посещений ¦ 700 ¦
¦ ¦ ¦ ¦ ¦
¦8.4¦ Бальнеологические лечеб- ¦ ¦ ¦
¦ ¦ ницы ¦ на 1000 посещений ¦ 1000 ¦
¦ ¦ ¦ ¦ ¦
¦8.5¦ Грязелечебницы ¦ на 1000 посещений ¦ 1000 ¦
¦ ¦ ¦ ¦ ¦
¦III¦ Санитарно-профилактические ¦ ¦ ¦
¦ ¦ учреждения ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 1.¦ Санитарно-эпидемиологичес- ¦ ¦ ¦
¦ ¦ кие учреждения ¦ ¦ ¦
¦1.1¦ Противочумные станции ¦ Пользоваться действующими ¦ ¦
¦ ¦ ¦ нормативами, утвержденными¦ ¦
¦ ¦ ¦ МЗ СССР 25.10.90. N 40 ¦ ¦
¦ ¦ ¦ ¦ ¦
¦1.2¦ Санитарно-эпидемиологи- ¦ Пользоваться действующими ¦ ¦
¦ ¦ ческие станции ¦ нормативами, утвержденными¦ ¦
¦ ¦ ¦ МЗ СССР 19.01.87 N 4244-87¦ ¦
¦ ¦ ¦ ¦ ¦
¦1.3¦ Дезинфекционные станции ¦ на 1000 смешанных анализов¦ 1300 ¦
¦ ¦ ¦ ¦ ¦
¦ IV¦ Бюро судебно-медицинской ¦ на полный анализ ¦ 500 ¦
¦ ¦ экспертизы ¦ (суд.-хим.) ¦ ¦
¦ ¦ ¦на 1 музейный макропрепарат¦ 150 ¦
¦ ¦ ¦на суд. гистологическое ис-¦ ¦
¦ ¦ ¦следование ¦ 150 ¦
¦ ¦ ¦для суд.-мед. исследования ¦ ¦
¦ ¦ ¦вещественных доказательств ¦ ¦
¦ ¦ ¦на 1 объект исследования ¦ 10 ¦
¦ ¦ ¦на обследование 1000 живых ¦ ¦
¦ ¦ ¦лиц ¦ 500 ¦
¦ ¦ ¦на суд.-мед. исследование ¦ ¦
¦ ¦ ¦(вскрытие) ¦ 50 ¦
¦ ¦ ¦на физико-техническое ¦ ¦
¦ ¦ ¦исследование на 1 ¦ ¦
¦ ¦ ¦эксперимент ¦ 100 ¦
¦ ¦ ¦на спектрографическое исс- ¦ ¦
¦ ¦ ¦ледование 1 объекта ¦ 5 ¦
¦ ¦ ¦на консервирование остатков¦ ¦
¦ ¦ ¦органов при суд.-хим. исс- ¦ ¦
¦ ¦ ¦ледовании (на 1 банку) ¦ 120 ¦
¦ ¦ ¦ ¦ ¦
¦ V.¦ Учреждения социального ¦ ¦ ¦
¦ ¦ обеспечения ¦ ¦ ¦
¦ 1.¦ Дома-интернаты ¦ на 1 место в год ¦ ¦
¦1.1¦ для престарелых и инва- ¦ ¦ ¦
¦ ¦ лидов ¦ - " - ¦ 800 ¦
¦1.2¦ для инвалидов от 18 до ¦ ¦ ¦
¦ ¦ 45 лет ¦ - " - ¦ 600 ¦
¦1.3¦ психоневрологические ¦ - " - ¦ 1000 ¦
¦1.4¦ детские психоневрологи- ¦ ¦ ¦
¦ ¦ ческие ¦ - " - ¦ 700 ¦
¦1.5¦ для детей с физическими ¦ ¦ ¦
¦ ¦ недостатками (физкалек) ¦ - " - ¦ 700 ¦
¦1.6¦ для глубоко умственно отс- ¦ ¦ ¦
¦ ¦ талых детей, способных к ¦ ¦ ¦
¦ ¦ обучению по специальным ¦ ¦ ¦
¦ ¦ программам и методикам ¦ на 1 место в год ¦ 500 ¦
¦1.7¦ для глубоко умственно отс- ¦ ¦ ¦
¦ ¦ талых детей, требующих ¦ ¦ ¦
¦ ¦ постоянного постороннего ¦ ¦ ¦
¦ ¦ ухода и надзора ¦ на 1 место в год ¦ 900 ¦
¦ ¦ ¦ ¦ ¦
¦ 2.¦ Протезно-ортопедические ¦ ¦ ¦
¦ ¦ предприятия ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦2.1¦ Стационары сложного про- ¦ ¦ ¦
¦ ¦ тезирования ¦ на 1 койку в год ¦ 2300 ¦
¦2.2¦ Отделения амбулаторного ¦ ¦ ¦
¦ ¦ протезирования ¦ на 1000 посещений ¦ 750 ¦
¦2.3¦ Вспомогательные кабинеты ¦ ¦ ¦
¦ ¦ стационаров протезно-орто- ¦ ¦ ¦
¦ ¦ педических предприятий и ¦ ¦ ¦
¦ ¦ отделений амбулаторного ¦ ¦ ¦
¦ ¦ протезирования ¦ ¦ ¦
¦ ¦ - рентгеновский кабинет ¦ на 1000 посещений ¦ 250 ¦
¦ ¦ - кабинет физиотерапии ¦ на 1000 посещений ¦ 1300 ¦
¦ ¦ - кабинет ЛФК, трудотерапии¦ ¦ ¦
¦ ¦ и массажа ¦ на 1000 посещений ¦ 1200 ¦
¦ ¦ ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦ 3.¦Школьные и дошкольные учреж-¦ ¦ ¦
¦ ¦дения ¦ ¦ ¦
¦ ¦ ¦ ¦ ¦
¦3.1¦школа ¦ на 1 ученика в год ¦ 2.0 ¦
¦3.2¦школа-интернат ¦ на 1 воспитанника в год ¦ 3,0 ¦
¦3.3¦детские сады и детские ¦ ¦ ¦
¦ ¦дома ¦ на 1 место в год ¦ 20 ¦
¦3.4¦детские ясли ¦ на 1 место в год ¦ 100 ¦
¦3.5¦детские ясли-сад ¦ на 1 место в год ¦ 35 ¦
¦3.6¦специализированные детские ¦ ¦ ¦
¦ ¦учреждения (ясли,ясли-сад, ¦ ¦ ¦
¦ ¦вспомогательные школы-интер-¦ ¦ ¦
¦ ¦наты для детей с нарушением ¦ ¦ ¦
¦ ¦интеллекта, зрения, слуха, ¦ ¦ ¦
¦ ¦речи, опорно-двигательного ¦ ¦ ¦
¦ ¦аппарата, для детей с ¦ ¦ ¦
¦ ¦последствиями полиомиелита и¦ ¦ ¦
¦ ¦детских церебральных пара- ¦ ¦ ¦
¦ ¦личей) ¦на 1 место в год ¦ 120 ¦
¦3.7¦детские ясли-сады туберку- ¦ ¦ ¦
¦ ¦лезного профиля ¦на 1 место в год ¦ 50 ¦
¦3.8¦санаторно-лесные школы ¦ ¦ ¦
¦ ¦туберкулезного профиля ¦на 1 воспитанника в год ¦ 10 ¦
L---+----------------------------+---------------------------+-----------
---------------------------------
<*> При выполнении учреждением функций по обслуживанию населения других территорий (консультирование, диагностика и т.п.), дополнительная потребность в спирте определяется по нормам, указанным в приложении 2.
Примечания:
1. Этиловый спирт в чистом виде отпускается из аптек лечебно-профилактическим учреждениям без учета колебаний концентрации (от 96 до 97%). Для обработки кожи перед инъекциями отпускается 70% этиловый спирт.
2. Отпуск учреждениям здравоохранения спирта в виде борного, салицилового, ментолового, муравьиного и другого, кроме камфорного, производить за счет нормативов чистого спирта.
3. Расход спирта для разведенного хлоргексидина биглюконата производится за счет общего количества спирта, выделенного отделению. Количественный учет раствора хлоргексидина биглюконата в отделениях не ведется.
4. Количество спирта, необходимое для проведения обучения студентов, выделяется базовому учреждению дополнительно по нормам, утвержденным минздравами союзных республик.
Начальник Главного
управления общественного
здравоохранения и медико
социальных программ
А.А.КАРПЕЕВ
Начальник Главного
управления охраны здоровья
матери и ребенка
И.А.ЛЕШКЕВИЧ
Приложение N 2
к приказу Министерства
здравоохранения СССР
от 30 августа 1991 г. N 245
ОРИЕНТИРОВОЧНЫЕ НОРМЫ РАСХОДА
ЭТИЛОВОГО СПИРТА В ПОДРАЗДЕЛЕНИЯХ ЛЕЧЕБНО -
ПРОФИЛАКТИЧЕСКИХ УЧРЕЖДЕНИЙ
-----T--------------------------T------------------------T-------------------------T------¬
¦ ¦ ¦ ¦ ¦Норма ¦
¦ NN ¦ ¦ Наименование отделений¦ Показатели ¦тив в ¦
¦ пп ¦ Наименование ¦ (палат), кабинетов ¦ обслуживания ¦грам- ¦
¦ ¦ учреждения ¦ ¦ ¦мах ¦
+----+--------------------------+------------------------+-------------------------+------+
¦ 1 ¦ 2 ¦ 3 ¦ 4 ¦ 5 ¦
+----+--------------------------+------------------------+-------------------------+------+
¦1. ¦Больничные учреждения, ¦аллергологическое ¦ на 1 пролеченного ¦ ¦
¦ ¦родильные дома, ¦ ¦ больного ¦60 ¦
¦ ¦диспансеры ¦гастроэнтерологическое ¦ - " - ¦50 ¦
¦ ¦ ¦гематологическое ¦ - " - ¦140 ¦
¦ ¦ ¦гинекологическое ¦ - " - ¦75 ¦
¦ ¦ ¦гнойное хирургическое ¦ - " - ¦280 ¦
¦ ¦ ¦кожно-венерологическое ¦ - " - ¦120 ¦
¦ ¦ ¦дневной стационар ¦ - " - ¦100 ¦
¦ ¦ ¦дневной стационар для ¦ ¦ ¦
¦ ¦ ¦психически больных ¦ - " - ¦100 ¦
¦ ¦ ¦дневной наркологический ¦ ¦ ¦
¦ ¦ ¦стационар ¦ - " - ¦70 ¦
¦ ¦ ¦интенсивной терапии ¦ - " - ¦200 ¦
¦ ¦ ¦инфекционное ¦ - " - ¦70 ¦
¦ ¦ ¦инфекционное для больных¦ ¦70 ¦
¦ ¦ ¦полиомиелитом ¦ - " - ¦90 ¦
¦ ¦ ¦кардиологическое ¦ - " - ¦170 ¦
¦ ¦ ¦отделение хирургического¦ ¦ ¦
¦ ¦ ¦лечения сложных наруше- ¦ ¦ ¦
¦ ¦ ¦ний ритма сердца и ¦ ¦ ¦
¦ ¦ ¦электрокардиостимуляции ¦ ¦ ¦
¦ ¦ ¦кардиохирургическое ¦ - " - ¦450 ¦
¦ ¦ ¦микрохирургическое ¦ - " - ¦450 ¦
¦ ¦ ¦неврологическое ¦ - " - ¦60 ¦
¦ ¦ ¦нейротравматологическое ¦ - " - ¦320 ¦
¦ ¦ ¦нейрохирургическое ¦ - " - ¦320 ¦
¦ ¦ ¦нефрологическое ¦ - " - ¦70 ¦
¦ ¦ ¦новорожденных ¦ - " - ¦60 ¦
¦ ¦ ¦наркологическое ¦ - " - ¦80 ¦
¦ ¦ ¦ ¦ дополнительно на 1 ¦ ¦
¦ ¦ ¦ ¦ сеанс условно-реф- ¦ ¦
¦ ¦ ¦ ¦ лекторной терапии ¦20 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦ ¦ожоговое ¦ на 1 пролеченного ¦250 ¦
¦ ¦ ¦ ¦ больного ¦ ¦
¦ ¦ ¦онкологическое ¦ - " - ¦170 ¦
¦ ¦ ¦оториноларингологическое¦ - " - ¦85 ¦
¦ ¦ ¦отделение для больных с ¦ на 1 пропелеченно- ¦ ¦
¦ ¦ ¦острыми отравлениями ¦ го больного ¦170 ¦
¦ ¦ ¦офтальмологическое ¦ - " - ¦100 ¦
¦ ¦ ¦патологии беременности ¦ - " - ¦50 ¦
¦ ¦ ¦педиатрическое ¦ - " - ¦70 ¦
¦ ¦ ¦педиатрическое новоро- ¦ - " - ¦170 ¦
¦ ¦ ¦жденных ¦ ¦ ¦
¦ ¦ ¦проктологическое ¦ - " - ¦290 ¦
¦ ¦ ¦приемное отделение ¦ - " - ¦1,5 ¦
¦ ¦ ¦психоневрологическое ¦ - " - ¦80 ¦
¦ ¦ ¦психиатрическое ¦ - " - ¦80 ¦
¦ ¦ ¦пульмонологическое ¦ - " - ¦100 ¦
¦ ¦ ¦радиологическое ¦ - " - ¦170 ¦
¦ ¦ ¦реанимации и интенсивной¦ ¦510 ¦
¦ ¦ ¦терапии ¦ - " - ¦ ¦
¦ ¦ ¦ ¦на 1 сеанс гипербо- ¦40 ¦
¦ ¦ ¦ ¦рической оксигенации ¦ ¦
¦ ¦ ¦ ¦в одноместной барокамере ¦ ¦
¦ ¦ ¦ревматологическое ¦на 1-го пролеченного ¦100 ¦
¦ ¦ ¦ ¦больного ¦ ¦
¦ ¦ ¦родовое ¦ - " - ¦110 ¦
¦ ¦ ¦сердечно-сосудистое ¦ - " - ¦450 ¦
¦ ¦ ¦сосудистой хирургии ¦ - " - ¦380 ¦
¦ ¦ ¦стоматологическое ¦ - " - ¦200 ¦
¦ ¦ ¦терапевтическое ¦ - " - ¦80 ¦
¦ ¦ ¦травматологическое ¦ - " - ¦300 ¦
¦ ¦ ¦ортопедическое ¦ - " - ¦520 ¦
¦ ¦ ¦туберкулезное ¦ - " - ¦490 ¦
¦ ¦ ¦туберкулезное для ¦ - " - ¦490 ¦
¦ ¦ ¦больных менингитом ¦ ¦ ¦
¦ ¦ ¦туберкулезное легочно- ¦ - " - ¦720 ¦
¦ ¦ ¦хирургическое ¦ ¦ ¦
¦ ¦ ¦туберкулезное для боль- ¦ - " - ¦490 ¦
¦ ¦ ¦ных костно-суставным ¦ ¦ ¦
¦ ¦ ¦туберкулезом ¦ ¦ ¦
¦ ¦ ¦туберкулез для принуди- ¦ - " - ¦490 ¦
¦ ¦ ¦тельного лечения больных¦ ¦ ¦
¦ ¦ ¦алкоголизмом ¦ ¦ ¦
¦ ¦ ¦урологическое ¦ - " - ¦270 ¦
¦ ¦ ¦ ¦для лечения 1 больного с ¦1200 ¦
¦ ¦ ¦ ¦пересаженной почкой ¦ ¦
¦ ¦ ¦ ¦(первые 2 месяца после ¦ ¦
¦ ¦ ¦ ¦пересадки) ¦ ¦
¦ ¦ ¦хирургическое ¦на 1-го пролеченного ¦ ¦
¦ ¦ ¦ ¦больного ¦225 ¦
¦ ¦ ¦хирургическое тора- ¦ - " - ¦430 ¦
¦ ¦ ¦кальное ¦ ¦ ¦
¦ ¦ ¦гемодиализа ¦на 1 сеанс гемодиализа ¦200 ¦
¦ ¦ ¦ ¦на 1 сеанс гемосорбции ¦150 ¦
¦ ¦ ¦ ¦на 1 сеанс ультразвуко- ¦60 ¦
¦ ¦ ¦ ¦вого облучения крови ¦ ¦
¦ ¦ ¦эндокринологическое ¦ ¦20 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦ ¦Патологоанатомическое ¦ ¦ ¦
¦ ¦ ¦отделение ¦- на 1 объект биопсии ¦20 ¦
¦ ¦ ¦ ¦- на 1 вскрытие трупа ¦230 ¦
¦ ¦ ¦ ¦с гистологической ¦ ¦
¦ ¦ ¦ ¦обработкой взятых ку- ¦ ¦
¦ ¦ ¦ ¦сочков ¦ ¦
¦ ¦ ¦ ¦- на 1 музейный макро- ¦ ¦
¦ ¦ ¦ ¦препарат ¦150 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Противотуберкулезные ¦поликлиника ¦на 1000 посещений ¦800 ¦
¦ ¦диспансеры ¦стационар ¦на 1-го пролеченного ¦ ¦
¦ ¦ ¦ ¦больного ¦490 ¦
¦ ¦Кожно-венерологические ¦поликлиника ¦на 1000 посещений ¦800 ¦
¦ ¦диспансеры ¦стационар ¦на 1-го пролеченного ¦ ¦
¦ ¦ ¦ ¦больного ¦120 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Психоневрологические ¦поликлиника ¦на 1000 посещений ¦1000 ¦
¦ ¦диспансеры ¦стационар ¦на 1-го пролеченного ¦80 ¦
¦ ¦ ¦ ¦больного ¦ ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Онкологические диспансеры ¦поликлиника ¦на 1000 посещений ¦1300 ¦
¦ ¦ ¦стационар ¦на 1-го пролеченного ¦170 ¦
¦ ¦ ¦ ¦больного ¦ ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦ ¦ ¦дополнительно для онко- ¦ ¦
¦ ¦ ¦ ¦логических исследований: ¦ ¦
¦ ¦ ¦ ¦- при проведении эндоско-¦ ¦
¦ ¦ ¦ ¦пических исследований на ¦ ¦
¦ ¦ ¦ ¦1 процедуру ¦50 ¦
¦ ¦ ¦ ¦- при использовании мето-¦ ¦
¦ ¦ ¦ ¦да парентерального ¦ ¦
¦ ¦ ¦ ¦введения этилового ¦ ¦
¦ ¦ ¦ ¦спирта (питание) после- ¦ ¦
¦ ¦ ¦ ¦операционным больным ¦ ¦
¦ ¦ ¦ ¦после полостных операций ¦ ¦
¦ ¦ ¦ ¦на 1 процедуру ¦670 ¦
¦ ¦ ¦ ¦- при проведении радиои- ¦ ¦
¦ ¦ ¦ ¦зотопной диагностики ¦ ¦
¦ ¦ ¦ ¦на 1 процедуру ¦5 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Эндокринологические ¦поликлиника ¦на 1000 посещений ¦900 ¦
¦ ¦диспансеры ¦стационар ¦на 1 пролеченного ¦ ¦
¦ ¦ ¦ ¦больного ¦20 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Трахоматозные диспансеры ¦ ¦на 1000 посещений ¦500 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Врачебно-физкультурные ¦ ¦ ¦ ¦
¦ ¦диспансеры ¦ ¦на 1000 посещений ¦2500 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Наркологические диспан- ¦поликлиника ¦на 1000 посещений ¦800 ¦
¦ ¦серы ¦стационар ¦на 1-го пролеченного ¦ ¦
¦ ¦ ¦ ¦больного ¦80 ¦
¦ ¦ ¦ ¦- дополнительно на 1 ¦ ¦
¦ ¦ ¦ ¦сеанс условно-рефлек- ¦ ¦
¦ ¦ ¦ ¦торной терапии ¦20 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦Кардиологические диспан- ¦поликлиника ¦на 1000 посещений ¦800 ¦
¦ ¦серы ¦стационар ¦на 1-го пролеченного ¦90 ¦
¦ ¦ ¦ ¦больного ¦ ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦3. Амбулаторно-поликли- ¦аллергологический ¦на 1000 посещений ¦1100 ¦
¦ ¦ нические учреждения ¦акушерско-гинекологичес-¦ ¦ ¦
¦ ¦ (подразделения) ¦кий ¦ -"- ¦800 ¦
¦ ¦ ¦гастроэнтерологический ¦ -"- ¦1000 ¦
¦ ¦ ¦гельминтологический ¦ -"- ¦1000 ¦
¦ ¦ ¦гематологический ¦ -"- ¦900 ¦
¦ ¦ ¦детское отделение поли- ¦ ¦ ¦
¦ ¦ ¦клиник ¦ -"- ¦1000 ¦
¦ ¦ ¦дерматовенерологический ¦ -"- ¦700 ¦
¦ ¦ ¦инфекционных заболеваний¦ -"- ¦1500 ¦
¦ ¦ ¦кардиоревматологический ¦ -"- ¦800 ¦
¦ ¦ ¦логопедический ¦на 1-го первичного ¦ ¦
¦ ¦ ¦ ¦больного ¦20 ¦
¦ ¦ ¦наркологический ¦ ¦800 ¦
¦ ¦ ¦ ¦- дополнительно на 1 ¦ ¦
¦ ¦ ¦ ¦сеанс условно-рефлектор- ¦ ¦
¦ ¦ ¦ ¦ной терапии ¦20 ¦
¦ ¦ ¦неврологический ¦на 1000 посещений ¦500 ¦
¦ ¦ ¦нефрологический ¦ -"- ¦1000 ¦
¦ ¦ ¦онкологический ¦ -"- ¦1000 ¦
¦ ¦ ¦обслуживания подростков ¦ -"- ¦400 ¦
¦ ¦ ¦операционная ¦ -"- ¦3000 ¦
¦ ¦ ¦отоларингологический ¦ -"- ¦700 ¦
¦ ¦ ¦офтальмологический ¦ -"- ¦800 ¦
¦ ¦ ¦перевязочная ¦ -"- ¦1200 ¦
¦ ¦ ¦проктологический ¦ -"- ¦1200 ¦
¦ ¦ ¦процедурный ¦на 1000 процедур ¦1500 ¦
¦ ¦ ¦психиатрический ¦ ¦ ¦
¦ ¦ ¦(психотерапевтический) ¦на 1000 посещений ¦500 ¦
¦ ¦ ¦пульмонологический ¦ -"- ¦1100 ¦
¦ ¦ ¦радиологический ¦ -"- ¦800 ¦
¦ ¦ ¦рефлексотерапии ¦ -"- ¦3500 ¦
¦ ¦ ¦ ¦для хранения стерильных ¦ ¦
¦ ¦ ¦ ¦игл на 1 врача в месяц ¦100 ¦
¦ ¦ ¦сексологический ¦на 1000 посещений ¦500 ¦
¦ ¦ ¦смотровой женский ¦ ¦ ¦
¦ ¦ ¦кабинет ¦ -"- ¦800 ¦
¦ ¦ ¦сурдологический ¦ -"- ¦3000 ¦
¦ ¦ ¦слухопротезный ¦ -"- ¦2000 ¦
¦ ¦ ¦терапевтический ¦ -"- ¦900 ¦
¦ ¦ ¦травматологический ¦ -"- ¦1000 ¦
¦ ¦ ¦травмопункт ¦ -"- ¦1200 ¦
¦ ¦ ¦урологический ¦ -"- ¦1200 ¦
¦ ¦ ¦фониатрический ¦ -"- ¦600 ¦
¦ ¦ ¦противотуберкулезный ¦ -"- ¦800 ¦
¦ ¦ ¦хирургический ¦ -"- ¦1200 ¦
¦ ¦ ¦эндокринологический ¦ -"- ¦600 ¦
¦ ¦ ¦электрокардиографический¦на 1000 ЭКГ ¦1000 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦ ¦Лечебно-косметологи- ¦на 1000 посещений ¦1500 ¦
¦ ¦ ¦ческий (отделение) ¦ ¦ ¦
¦3.1 ¦ Амбулатории ¦ ¦ -"- ¦1000 ¦
¦3.2 ¦ Врачебные здравпункты ¦ ¦ -"- ¦650 ¦
¦3.3 ¦ Фельдшерские здравпункты ¦ ¦ -"- ¦500 ¦
¦3.4 ¦ Фельдшерско-акушерские ¦ ¦ -"- ¦800 ¦
¦ ¦ пункты ¦ ¦ ¦ ¦
¦3.5 ¦ Пункты медицинской помощи¦ ¦ ¦ ¦
¦ ¦ на дому ¦ ¦на 1000 выездов ¦2000 ¦
¦3.6 ¦ Стоматологические полик- ¦ ¦ ¦ ¦
¦ ¦линики (отделения, кабине-¦ ¦ ¦ ¦
¦ ¦ты) ¦стоматологический ка- ¦на 1 УЕТ ¦0,6 ¦
¦ ¦ ¦бинет ¦ ¦ ¦
¦ ¦ ¦стоматологический ¦на 1 УЕТ ¦1,6 ¦
¦ ¦ ¦хирургический ¦ ¦ ¦
¦ ¦ ¦ортопедический ¦на 1 УЕТ ¦1,3 ¦
¦ ¦ ¦зубопротезные лабора- ¦на 1 литой зуб ¦0,4 ¦
¦ ¦ ¦тории с использованием ¦на 1 бюгельный про- ¦ ¦
¦ ¦ ¦установок ¦тез ¦6,0 ¦
¦ ¦ ¦высококачественного ¦на 1 зуб литой ¦ ¦
¦ ¦ ¦литья ¦стальной или под ¦ ¦
¦ ¦ ¦ ¦пластмассовую фа- ¦ ¦
¦ ¦ ¦ ¦сетку ¦0,2 ¦
¦ ¦ ¦ ¦на 1 каркас при ¦ ¦
¦ ¦ ¦ ¦моделировании на гип- ¦ ¦
¦ ¦ ¦ ¦совой модели ¦2,0 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦ ¦ ¦анестезиологический ¦на 1000 посещений ¦700 ¦
¦ ¦ ¦кабинет ¦- на фарфоровую коронку ¦1,5 ¦
¦ ¦ ¦ ¦- на металлокерамическую ¦2,0 ¦
¦ ¦ ¦ ¦коронку или зуб ¦ ¦
¦ ¦ ¦ ¦- на 1 цельнолитую корон-¦ ¦
¦ ¦ ¦ ¦ку или зуб ¦1,0 ¦
¦ ¦ ¦ ¦на имплантацию: ¦ ¦
¦ ¦ ¦ ¦- эндоссальную ¦175,0 ¦
¦ ¦ ¦ ¦- субпериостальную ¦60,0 ¦
¦3.7 ¦ Физиотерапевтические ¦физиотерапевтическое ¦на 1000 процедур ¦1300 ¦
¦ ¦поликлиники ¦отделение ¦ ¦ ¦
¦3.8 ¦ Вспомогательные подразде-¦рентгеновский и флюо- ¦на 1000 флюорограмм ¦250 ¦
¦ ¦ления лечебно-профилак- ¦рографический кабинет ¦на 1000 рентгеноскопий ¦ ¦
¦ ¦тических учреждений ¦(диагностическая и ле- ¦и рентгенограмм ¦250 ¦
¦ ¦ ¦чебная работа) ¦на 1000 электрорентгено- ¦ ¦
¦ ¦ ¦ ¦грамм ¦500 ¦
¦ ¦ ¦ангиографические и ¦на 1 исследование ¦100 ¦
¦ ¦ ¦ангиокардиографические ¦ ¦ ¦
¦ ¦ ¦кабинеты рентгенологи- ¦ ¦ ¦
¦ ¦ ¦ческих отделений ¦ ¦ ¦
¦ ¦ ¦лечебной физкультуры ¦на 1000 посещений ¦600 ¦
¦ ¦ ¦функциональной диаг- ¦ ¦ ¦
¦ ¦ ¦ностики ¦ -"- ¦1000 ¦
¦ ¦ ¦электроэнцефалографии ¦на 1 исследование ¦50 ¦
¦ ¦ ¦электроэхоэнцефалографии¦на 1 исследование ¦4 ¦
¦ ¦ ¦зондирования ¦на 1 исследование ¦20 ¦
¦ ¦ ¦вакуум-аспирации ¦на 1 процедуру ¦30 ¦
¦ ¦ ¦эндоскопический ¦на 1 исследование (кроме ¦ ¦
¦ ¦ ¦ ¦ректоскопии) ¦50 ¦
¦ ¦ ¦ультразвуковой ¦ ¦ ¦
¦ ¦ ¦диагностики ¦на 1 исследование ¦1,5 ¦
¦ ¦ ¦кабинет пренатальной ¦ ¦100 ¦
¦ ¦ ¦диагностики: ¦ ¦ ¦
¦ ¦ ¦биопсия хориона ¦на 1 манипуляцию ¦ ¦
¦ ¦ ¦амниоцентез ¦на 1 манипуляцию ¦250 ¦
¦ ¦ ¦ ¦ ¦ ¦
¦3.9 ¦ Клинико-диагностические ¦клинические ¦на 1000 анализов ¦700 ¦
¦ ¦лаборатории лечебно-про- ¦биохимические ¦на 1000 анализов ¦1800 ¦
¦ ¦филактических учреждений ¦определение 17-кетос- ¦на 1000 анализов ¦2300 ¦
¦ ¦ ¦тероидов, 17-оксикето- ¦ ¦ ¦
¦ ¦ ¦стероидов, экстрогенов ¦ ¦ ¦
¦ ¦ ¦и др. гормонов ¦ ¦ ¦
¦ ¦ ¦бактериологические ¦ -"- ¦1800 ¦
¦ ¦ ¦бактериологические для ¦ ¦ ¦
¦ ¦ ¦противотуберкулезных ¦ ¦ ¦
¦ ¦ ¦учреждений ¦ -"- ¦3400 ¦
¦ ¦ ¦бактериоскопические ¦ -"- ¦6500 ¦
¦ ¦ ¦иммуносерологические ¦ -"- ¦850 ¦
¦ ¦ ¦цитологические ¦ -"- ¦1500 ¦
¦ ¦ ¦генетические ¦ -"- ¦300 ¦
¦ ¦ ¦радиоизотопные ¦на 1 анализ ¦5 ¦
¦ ¦ ¦ ¦чистка 1 микроскопа ¦5000 ¦
¦ ¦ ¦ ¦мл в год ¦ ¦
¦ ¦ ¦ ¦ ¦ ¦
¦3.10¦ Консультация "Брак и ¦ ¦ ¦ ¦
¦ ¦семья" ¦ ¦на 1000 посещений ¦600 ¦
¦3.10¦ Лаборатория контактной ¦ ¦ ¦ ¦
¦ ¦коррекции зрения ¦ ¦для изготовления 500 ¦ ¦
¦ ¦ ¦ ¦контактных линз ¦2700 ¦
¦ ¦ ¦ ¦ ¦ ¦
L----+--------------------------+------------------------+-------------------------+-------
Начальник Главного
управления общественного
здравоохранения и медико
социальных программ
А.А.КАРПЕЕВ
Начальник Главного
управления охраны здоровья
матери и ребенка
И.А.ЛЕШКЕВИЧ
Приложение N 3
к приказу Министерства
здравоохранения СССР
от 30 августа 1991 г. N 245
ОРИЕНТИРОВОЧНЫЕ НОРМЫ
РАСХОДА ЭТИЛОВОГО СПИРТА НА МЕДИЦИНСКИЕ
ПРОЦЕДУРЫ (В ГРАММАХ)
1. Внутривенные инъекции и взятие крови из вены 3,0
2. Внутримышечные и подкожные инъекции 1,5
3. Взятие крови из пальца 1,5
4. Постановка капельницы для переливания крови 5,0-10,0
5. Постановка банок:
для взрослых 20,0
для детей 10,0
6. Наложение компресса 20,0-30,0
7. Обработка фурункулов 1,5
8. Обработка ожогов 20,0-40,0
9. Профилактическая прививка безыгольным инъектором 0,5-1,0
10. Обработка ампул и флаконов 0,5
11. Обработка рук медицинского персонала перед процедурой 10,0
12. Инъекции и пункции внутрисуставные 10,0
13. Проведение гистероскопии 50,0
14. Наложение микротрахеостомы 10,0
15. Катетеризация подключичной вены 50,0
16. Плевральные пункции и парацентезы 20,0
17. Установление и удаление дренажей из плевральной и
брюшной полостей 20,0
18. Венесекция 10,0
19. Фибробронхоскопия 50,0
20. Радиоизотопное исследование 10,0
21. Переливание крови 10,0
22. Иглорефлексотерапия 5,0
23. Спинномозговая пункция 50,0
24. Наркоз 60,0
25. Постановка пиявок (на 1 пиявку) 1,0
26. Аутогемотерапия 5,0
27. Проведение тонометрии 1,5
Примечание: указанные нормы могут быть использованы при списании этилового спирта в расход в отделениях и кабинетах лечебно-профилактических учреждений. Для определения потребности в этиловом спирте на планируемый период не применяются.
Начальник Главного управления
общественного здравоохранения
и медико-социальных программ
А.А.КАРПЕЕВ
Приказ Минздрава РФ от 20 июля 2001 г. N 284 "Об утверждении норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности"
В целях снижения непроизводительных потерь и повышения ответственности за сохранность товарно-материальных ценностей в аптечных организациях независимо от организационно-правовой формы и формы собственности приказываю:
1. Утвердить:
1.1. Нормы естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности (Приложение N 1).
1.2. Инструкцию по применению норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности (Приложение N 2).
2. Руководителям органов управления здравоохранением и фармацевтическими организациями субъектов Российской Федерации принять к руководству и исполнению настоящий приказ.
3. Контроль за исполнением настоящего приказа возложить на заместителя Министра А.В.Катлинского.
Министр Ю.Л.Шевченко
Зарегистрировано в Минюсте РФ 26 октября 2001 г.
Регистрационный N 2997
Приложение N 1
к приказу Минздрава РФ
от 20 июля 2001 г. N 284
Нормы естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности
Комментарий ГАРАНТа
О нормах естественной убыли отдельных товаров при хранении см. справку
N п/п Показатель Нормы естественной убыли, %
1 2 3
1. Лекарственные средства:
1.1. Изготовление лекарственных средств по рецептам и требованиям учреждений здравоохранения, внутриаптечной заготовке и фасовке 1,80
1.2. Изготовление гомеопатических лекарственных средств 0,80
1.3. Отвешивание и отмеривание медикаментов в аптечную тару без дополнительных технологических операций (смешивание, растворение, разделение на дозы) 0,65
2. Наркотические средства, психотропные вещества и их прекурсоры, лекарственные средства списков ПККН, другие лекарственные средства, подлежащие предметно-количественному учету:
2.1. Индивидуальное изготовление лекарственных средств по рецептам и требованиям учреждений здравоохранения, в том числе по гомеопатическим прописям 0,95
2.2. Отвешивание и отмеривание их в аптечную тару без дополнительных технологических операций (смешивание, растворение, разделение на дозы) 0,4
3. Этиловый спирт:
3.1. Индивидуальное изготовление лекарственных средств, в том числе по гомеопатическим прописям 1,9
3.2. Отвешивание спирта в аптечную тару без дополнительных технологических операций (смешивание с другими медикаментами, разделение на дозы) 0,65
Приложение N 2
к приказу Минздрава РФ
от 20 июля 2001 г. N 284
Инструкция по применению норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности
1. Настоящие нормы естественной убыли установлены для возмещения стоимости потерь в пределах норм естественной убыли при изготовлении лекарственных средств по рецептам врачей и требованиям учреждений здравоохранения, внутриаптечной заготовке и фасовке в аптечных организациях независимо от организационно-правовой формы и формы собственности.
Нормы естественной убыли применяются только в случаях выявления недостачи товарно-материальных ценностей при проведении инвентаризации.
Списание естественной убыли лекарственных средств и изделий медицинского назначения при отсутствии потерь не допускается.
Нормы естественной убыли лекарственных средств, подлежащих предметно-количественному учету, должны применяться только по тому наименованию, по которому установлена недостача.
2. Нормы естественной убыли включают потери лекарственных средств, используемых при аптечном изготовлении лекарств. Они устанавливаются к стоимости индивидуально изготовленных лекарств по рецептам врачей и по требованиям учреждений здравоохранения, внутриаптечной заготовки и фасовки.
3. Нормы естественной убыли наркотических средств, психотропных веществ и их прекурсоров, внесенных в списки II, III, IV Перечня наркотических средств, психотропных веществ и их прекурсоров, утвержденного постановлением Правительства Российской Федерации от 30.06.98 г. N 681; сильнодействующих и ядовитых веществ списков Постоянного комитета по контролю наркотиков, этилового спирта и других лекарственных средств, подлежащих предметно-количественному учету, устанавливаются к их израсходованным количествам, и списание потерь производится за межинвентаризационный период.
4. Исчисление суммы потерь от естественной убыли в пределах установленных норм производится на основе данных первичных учетных документов по отпуску (реализации) лекарственных средств индивидуально изготовленных по рецептам и требованиям учреждений здравоохранения, внутриаптечной заготовки и фасовки, а также при отпуске в массе (ангро), с нарушением оригинальной упаковки.
5. К готовым лекарственным средствам промышленного производства и весовым медикаментам (в т.ч. этиловому спирту), реализованныv в оригинальной (заводской, фабричной, складской) упаковке, настоящие нормы естественной убыли не применяются.
6. Нормы естественной убыли применяются лишь к лекарственным средствам и изделиям медицинского назначения, реализованным за межинвентаризационный период. Размер естественной убыли определяется по форме "Расчет естественной убыли лекарственных средств и изделий медицинского назначения" (приложение к настоящей инструкции).
7. Бой, брак, порча, потери за счет истечения срока годности лекарственных средств не списываются по нормам естественной убыли.
8. Выявленные при инвентаризации расхождения между фактическим наличием лекарственных средств и данными бухгалтерского учета отражаются на счетах бухгалтерского учета в следующем порядке:
а) излишек лекарственного средства приходуется, и соответствующая сумма зачисляется на финансовые результаты организации, а у бюджетной организации - на увеличение финансирования (фондов);
б) недостача лекарственных средств в пределах норм естественной убыли относится на издержки производства или обращения, сверх норм - на счет виновных лиц. Если виновные лица не установлены или суд отказал во взыскании убытков с них, то убытки от недостачи лекарственных средств списываются на финансовые результаты организации, а у бюджетной организации - на уменьшение финансирования (фондов).
Приложение
к Инструкции
"Утверждаю"
Руководитель юридического лица
______________________________
подпись, фамилия, и.,о.
"__"___________200_ г.
Наименование организации_________________________________________________
Отдел ___________________________________________________________________
Расчет
естественной убыли лекарственных средств
и изделий медицинского назначения
за период с_______200 г. по_______200 г.
Материально ответственное лицо __________________________________________
_________________________________________________________________________
должность, фамилия, и.,о.
(сумма)
N п/п Наименование Единица измерения Оборот за межинвентаризационный период Норма естественной убыли, % Начислено по нормам естественной убыли Списано по нормам естественной убыли Недостача сверх норм естественной убыли
по нормам убыли________________________
сверх норм убыли_______________________
Расчет составил бухгалтер _______________________________________________
подпись фамилия, и.,о.
Материально ответственное лицо __________________________________________
подпись фамилия, и.,о.
"__" ___________200 г.
Приказ Министерства здравоохранения и coциального развития Российской Федерации (Минздравсоцразвития России) от 14 декабря 2005 г. N 785 г. Москва О порядке отпуска лекарственных средств
В соответствии со статьей 32 Федерального закона от 22 июня 1998 г. N 86-ФЗ "О лекарственных средствах" (Собрание законодательства Российской Федерации, 1998, N 26, ст. 3006; 2003, N 27, ст. 2700; 2004, N 35, ст. 3607) приказываю:
1. Утвердить прилагаемый Порядок отпуска лекарственных средств.
2. Признать утратившими силу приложение 3 "Перечень лекарственных средств, подлежащих предметно-количественному учету в аптечных учреждениях/организациях, предприятиях оптовой торговли лекарственными средствами, лечебно-профилактических учреждениях* и частнопрактикующими врачами**" и приложение 4 "Порядок отпуска лекарственных средств в аптечных учреждениях/организациях", утвержденные приказом Министерства здравоохранения Российской Федерации от 23 августа 1999 г. N 328 "О рациональном назначении лекарственных средств, правилах выписывания рецептов на них и порядке их отпуска аптечными учреждениями (организациями)" (зарегистрирован в Министерстве юстиции Российской Федерации 21 октября 1999 г. N 1944), с изменениями и дополнениями, внесенными приказом Министерства здравоохранения Российской Федерации от 16 мая 2003 г. N 206 (зарегистрирован в Министерстве юстиции Российской Федерации 5 июня 2003 г. N 4641) и приказом Министерства здравоохранения и социального развития Российской Федерации от 16 марта 2005 г. N 216 (зарегистрирован в Министерстве юстиции Российской Федерации 8 апреля 2005 г. N 6490).
Министр М. Зурабов
Порядок отпуска лекарственных средств
I. Общие положения
1.1. Настоящий Порядок определяет требования к отпуску лекарственных средств аптечными учреждениями (организациями)* независимо oт организационно-правовой формы, формы собственности и ведомственной принадлежности.
1.2. Отпуску аптечными учреждениями (организациями) подлежат лекарственные средства, в том числе наркотические средства, психотропные, сильнодействующие и ядовитые вещества, зарегистрированные в Российской Федерации в установленном порядке.
1.3. Отпуск лекарственных средств по рецепту врача и без рецепта врача осуществляется аптечными учреждениями (организациями), имеющими лицензию на фармацевтическую деятельность.
1.4. Выписанные по рецепту врача лекарственные средства подлежат отпуску аптеками и аптечными пунктами.
Лекарственные средства в соответствии с Перечнем лекарственных средств, отпускаемых без рецепта врача, утвержденным приказом Министерства здравоохранения и социального развития Российской Федерации от 13 сентября 2005 г. N 578 (зарегистрирован в Министерстве юстиции Российской Федерации 29 сентября 2005 г. N 7053) (далее - Перечень лекарственных средств, отпускаемых без рецепта врача), подлежат реализации всеми аптечными учреждениями (организациями)*.
1.5. Для бесперебойного обеспечения населения лекарственными средствами аптечные учреждения (организации) обязаны иметь в наличии минимальный ассортимент лекарственных средств, необходимых для оказания медицинской помощи, утвержденный приказом Министерства здравоохранения и социального развития Российской Федерации от 29 апреля 2005 г. N 312.
II. Общие требования к отпуску лекарственных средств
2.1. Все лекарственные средства, за исключением включенных в Перечень лекарственных средств, отпускаемых без рецепта врача, должны отпускаться аптечными учреждениями (организациями) только по рецептам, оформленным в установленном порядке на рецептурных бланках соответствующих учетных форм.
2.2. По рецептам, выписанным на рецептурных бланках, формы которых утверждены приказом Министерства здравоохранения Российской Федерации от 23 августа 1999 г. N 328 (зарегистрирован в Министерстве юстиции Российской Федерации 21 октября 1999 г. N 1944) аптечными учреждениями (организациями) отпускаются:
- наркотические средства и психотропные вещества, внесенные в Список II Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, утвержденного постановлением Правительства Российской Федерации от 30 июня 1998 г. N 681 (Собрание законодательства Российской Федерации, 1998, N 27, ст. 3198; 2004, N 8, ст. 663; N 47, ст. 4666) (далее - Перечень), выписанные на специальных рецептурных бланках на наркотическое лекарственное средство;
- психотропные вещества, внесенные в Список III Перечня, выписанные на рецептурных бланках формы N 148-1/у-88;
- лекарственные средства, подлежащие предметно-количественному учету в аптечных учреждениях (организациях), организациях оптовой торговли лекарственными средствами, лечебно-профилактических учреждениях и частнопрактикующими врачами, Перечень которых предусмотрен приложением N 1 к настоящему Порядку (далее - лекарственные средства, подлежащие предметно-количественному учету), выписанные на рецептурных бланках формы N 148-1/у-88;
- лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи, утвержденный приказом Министерства здравоохранения и социального развития Российской Федерации от 28 сентября 2005 г. N 601 (зарегистрирован в Министерстве юстиции Российской Федерации 29 сентября 2005 г. N 7052) (далее - лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иные лекарственные средства, отпускаемые бесплатно или со скидкой, выписанные на рецептурных бланках формы N 148-1/у-04 (л);
- анаболические стероиды, выписанные на рецептурных бланках формы N 148-1/у-88;
- остальные лекарственные средства, не включенные в Перечень лекарственных средств, отпускаемых без рецепта врача, выписанные на рецептурных бланках формы N 107/у.
2.3. Рецепты на наркотические средства и психотропные вещества, внесенные в Список II Перечня, действительны в течение пяти дней.
Рецепты на психотропные вещества, внесенные в Список III Перечня; лекарственные средства, подлежащие предметно-количественному учету; анаболические стероиды действительны в течение десяти дней.
Рецепты на лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иные лекарственные средства, отпускаемые бесплатно или со скидкой, за исключением рецептов на наркотические средства и психотропные вещества, внесенные в Список II Перечня, на психотропные вещества, внесенные в Список III Перечня, на лекарственные средства, подлежащие предметно-количественному учету, на анаболические стероиды действительны в течение одного месяца.
Рецепты на остальные лекарственные средства действительны в течение двух месяцев со дня выписки рецепта и до одного года в соответствии с пунктом 2.19 Инструкции о порядке назначения лекарственных средств и выписывания рецептов на них, утвержденной приказом Министерства здравоохранения Российской Федерации от 23 августа 1999 г. N 328 (далее -Инструкция).
2.4. Аптечным учреждениям (организациям) запрещается отпускать лекарственные средства по рецептам с истекшим сроком действия, за исключением лекарственных средств по рецептам, срок действия которых истек в период нахождения рецептов на отсроченном обслуживании.
2.5. Лекарственные средства отпускаются аптечными учреждениями (организациями) в количестве, указанном в рецепте, за исключением лекарственных средств, нормы отпуска которых указаны в приложениях 1 и 3 к Инструкции.
2.6. При отпуске лекарственных средств по рецепту врача работник аптечного учреждения (организации) делает отметку на рецепте об отпуске препарата (наименование или номер аптечного учреждения (организации), наименование и дозировка лекарственного средства, отпущенное количество, подпись отпустившего и дата отпуска).
2.7. При наличии в аптечном учреждении (организации) лекарственных средств с дозировкой, отличной от дозировки, выписанной в рецепте врача, работник аптечного учреждения (организации) может принять решение об отпуске больному имеющихся лекарственных средств в случае, если дозировка лекарственного средства меньше дозировки, указанной в рецепте врача, с учетом перерасчета на курсовую дозу.
В случае если дозировка имеющегося в аптечном учреждении (организации) лекарственного средства превышает дозировку, указанную в рецепте врача, решение об отпуске больному лекарственного средства принимает врач, выписавший рецепт.
Больному предоставляется информация об изменении разовой дозы приема лекарственного средства.
2.8. В исключительных случаях при невозможности аптечным учреждением (организацией) выполнить назначение врача (фельдшера), допускается нарушение вторичной заводской упаковки.
При этом лекарственное средство должно отпускаться в аптечной упаковке с обязательным указанием наименования, заводской серии, срока годности лекарственного средства, серии и даты по лабораторно-фасовочному журналу и предоставлением больному другой необходимой информации (инструкция, листок-вкладыш и т.д.).
Не допускается нарушение первичной заводской упаковки лекарственных средств.
2.9. При отпуске лекарственных средств по рецептам врача, действующим в течение одного года, рецепт возвращается больному с указанием на обороте наименования или номера аптечного учреждения (организации), подписи работника аптечного учреждения (организации), количества отпущенного препарата и даты отпуска.
При очередном обращении больного в аптечное учреждение (организацию) учитываются отметки о предыдущем получении лекарственного средства. По истечении срока действия рецепт гасится штампом "Рецепт недействителен" и оставляется в аптечном учреждении (организации).
2.10. В исключительных случаях (отъезд больного за город, невозможность регулярно посещать аптечное учреждение (организацию) и т.д.) фармацевтическим работникам аптечного учреждения (организации) разрешается производить единовременный отпуск назначенного врачом лекарственного средства по рецептам, действующим в течение одного года, в количестве, необходимом для лечения в течение двух месяцев, за исключением лекарственных средств, подлежащих предметно-количественному учету.
2.11. В случае отсутствия в аптечном учреждении (организации) выписанного врачом лекарственного средства, за исключением лекарственного средства, включенного в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иного лекарственного средства, отпускаемого бесплатно или со скидкой, работник аптечного учреждения (организации) может осуществлять его синонимическую замену с согласия пациента.
При отпуске лекарственного средства, включенного в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иного лекарственного средства, отпускаемого бесплатно или со скидкой, работник аптечного учреждения (организации) может осуществлять синонимическую замену лекарственного средства по согласованию с врачом, выписавшим рецепт.
2.12. Рецепты на лекарственные средства с пометкой "statim" (немедленно) обслуживаются в срок, не превышающий один рабочий день с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства с пометкой "cito" (срочно) обслуживаются в срок, не превышающий двух рабочих дней с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства, входящие в минимальный ассортимент лекарственных средств, обслуживаются в срок, не превышающий пяти рабочих дней с момента обращения больного в аптечное учреждение (организацию).
2.13. Рецепты на лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), и не вошедшие в минимальный ассортимент лекарственных средств, обслуживаются в срок, не превышающий десяти рабочих дней с момента обращения больного в аптечное учреждение (организацию).
Рецепты на лекарственные средства, назначаемые по решению врачебной комиссии, утвержденной главным врачом лечебно-профилактического учреждения, обслуживаются в срок, не превышающий пятнадцати рабочих дней с момента обращения больного в аптечное учреждение (организацию).
2.14. Рецепты на лекарственные средства, подлежащие предметно-количественному учету; лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иные лекарственные средства, отпускаемые бесплатно или со скидкой; анаболические стероиды остаются в аптечном учреждении (организации) для последующего раздельного хранения и уничтожения по истечении срока хранения.
2.15. В аптечном учреждении (организации) должны быть обеспечены условия сохранности оставленных на хранение рецептов на лекарственные средства, подлежащие предметно-количественному учету; лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иные лекарственные средства, отпускаемые бесплатно или со скидкой; анаболические стероиды.
2.16. Сроки хранения рецептов в аптечном учреждении (организации) составляют:
- на лекарственные средства, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иные лекарственные средства, отпускаемые бесплатно или со скидкой, - пять лет;
- на наркотические средства и психотропные вещества, внесенные в Список II Перечня, и психотропные вещества, внесенные в Список III Перечня, - десять лет;
- на лекарственные средства, подлежащие предметно-количественному учету, за исключением наркотических средств и психотропных веществ, внесенных в Список II Перечня, и психотропных веществ, внесенных в Список III Перечня; анаболические стероиды - три года.
По истечении срока хранения рецепты подлежат уничтожению в присутствии комиссии, о чем составляются акты, форма которых предусмотрена приложениями N 2 и N 3 к настоящему Порядку.
Порядок уничтожения рецептов, оставляемых в аптечном учреждении (организации) по истечении установленных сроков хранения, и состав комиссии по их уничтожению может определяться органами управления здравоохранением или фармацевтической деятельностью субъекта Российской Федерации.
2.17. Приобретенные гражданами лекарственные препараты надлежащего качества не подлежат возврату или обмену в соответствии с Перечнем непродовольственных товаров надлежащего качества, не подлежащих возврату или обмену на аналогичный товар других размера, формы, габарита, фасона, расцветки или комплектации, утвержденным постановлением Правительства Российской Федерации от 19 января 1998 г. N 55 (Собрание законодательства Российской Федерации, 1998, N 4, ст. 482; N 43, ст. 5357; 1999, N 41, ст. 4923; 2002, N 6, ст. 584; 2003, N 29, ст. 2998; 2005, N 7, ст. 560).
Не допускается повторный отпуск (реализация) лекарственных средств, признанных товаром ненадлежащего качества и возращенных гражданами по этой причине.
2.18. Рецепты на транквилизаторы, не подлежащие предметно-количественному учету; антидепрессивные, нейролептические средства; спиртосодержащие лекарственные средства промышленного производства погашаются штампом аптечного учреждения (организации) "Лекарство отпущено" и возвращаются больному на руки.
Для повторного отпуска лекарственного средства больному необходимо обратиться к врачу за новым рецептом.
2.19. Неправильно выписанные рецепты остаются в аптечном учреждении (организации), погашаются штампом "Рецепт недействителен" и регистрируются в журнале, форма которого предусмотрена приложением N 4 к настоящему Порядку, и возвращаются больному на руки.
Информация обо всех неправильно выписанных рецептах доводится до сведения руководителя соответствующего лечебно-профилактического учреждения.
2.20. Аптечные учреждения (организации) производят раздельный учет лекарственных средств, включенных в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), отпущенных гражданам, проживающим на территории соответствующего субъекта Российской Федерации, и гражданам, временно находящимся на территории данного субъекта Российской Федерации.
III. Требования к отпуску наркотических средств и психотропных веществ; лекарственных средств, подлежащих предметно-количественному учету; анаболических стероидов
3.1. Отпуску аптечными учреждениями (организациями) подлежат наркотические средства и психотропные вещества, внесенные в Список II Перечня, и психотропные вещества, внесенные в Список III Перечня.
3.2. Право работы с наркотическими средствами и психотропными веществами, внесенными в Список II Перечня, и психотропными веществами, внесенными в Список III Перечня, имеют только аптечные учреждения (организации), получившие соответствующие лицензии в установленном законодательством Российской Федерации порядке.
3.3. Отпуск больным наркотических средств и психотропных веществ. внесенных в Список II Перечня, и психотропных веществ, внесенных в Список III Перечня, осуществляется фармацевтическими работниками аптечных учреждений (организаций), имеющими на это право в соответствии с приказом Министерства здравоохранения и социального развития Российской Федерации от 13 мая 2005 г. N 330 (зарегистрирован в Министерстве юстиции Российской Федерации 10 июня 2005 г. N 6711).
3.4. В аптечном учреждении (организации) отпуск наркотических средств и психотропных веществ, внесенных в Список II Перечня, осуществляется больным, прикрепленным к конкретному амбулаторно-поликлиническому учреждению, которое закреплено за аптечным учреждением (организацией).
Закрепление амбулаторно-поликлинического учреждения за аптечным учреждением (организацией) может осуществляться органом управления здравоохранением или фармацевтической деятельностью субъекта Российской Федерации по согласованию с территориальным органом по контролю за оборотом наркотических средств и психотропных веществ.
3.5. Выписанные врачом наркотические средства и психотропные вещества, внесенные в Список II Перечня, отпускаются больному или лицу, его представляющему, при предъявлении выданного в установленном порядке документа, удостоверяющего личность.
3.6. Наркотические средства и психотропные вещества, внесенные в Список II Перечня и включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также отпускаемые бесплатно или со скидкой, отпускаются при предъявлении рецепта, выписанного на специальном рецептурном бланке на наркотическое лекарственное средство, и рецепта, выписанного на рецептурном бланке формы N 148-1/у-04 (л).
Психотропные вещества, внесенные в Список III Перечня, лекарственные средства, подлежащие предметно-количественному учету, анаболические стероиды, включенные в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также отпускаемые бесплатно или со скидкой отпускаются при предъявлении рецепта, выписанного на рецептурном бланке N 148-1/у-88, и рецепта, выписанного на рецептурном бланке формы N 148-1/у-04 (л).
3.7. Аптечным учреждениям (организациям) запрещается отпуск наркотических средств и психотропных веществ, внесенных в Список II Перечня; психотропных веществ, внесенных в Список III Перечня; лекарственных средств, подлежащих предметно-количественному учету; анаболических стероидов по рецептам ветеринарных лечебных организаций для лечения животных.
3.8. Не допускается раздельный отпуск лекарственных средств, подлежащих предметно-количественному учету, и других лекарственных средств, входящих в состав комбинированного лекарственного средства, изготовляемого по индивидуальной прописи (далее - экстемпоральный лекарственный препарат).
3.9. Фармацевтический работник аптечного учреждения (организации) при получении рецепта на лекарственную пропись индивидуального изготовления обязан отпустить лекарственное средство, подлежащее предметно-количественному учету, в половине высшей разовой дозы в случае несоблюдения врачом установленных правил оформления рецепта или в случае выписывания врачом лекарственных средств в дозе, превышающей высший однократный прием.
3.10. При изготовлении экстемпоральных лекарственных препаратов, содержащих лекарственные средства, подлежащие предметно-количественному учету, в соответствии с рецептами, выписанными врачом, провизор аптечного учреждения (организации) расписывается на рецепте о выдаче, а фармацевт аптечного учреждения (организации) - в получении требуемого количества лекарственных средств.
3.11. Отпуск этилового спирта производится:
- по рецептам, выписанным врачами с надписью "Для наложения компрессов" (с указанием необходимого разведения с водой) или "Для обработки кожи" - до 50 граммов в чистом виде;
- по рецептам, выписанным врачами на лекарственную пропись индивидуального изготовления, - до 50 граммов в смеси;
- по рецептам, выписанным врачами на лекарственную пропись индивидуального изготовления, с надписью "По специальному назначению", отдельно заверенной подписью врача и печатью лечебно-профилактического учреждения "Для рецептов", для больных с хроническим течением болезни - до 100 граммов в смеси.
3.12. При отпуске наркотических средств и психотропных веществ, внесенных в Список II Перечня; психотропных веществ, внесенных в Список III Перечня; экстемпоральных лекарственных препаратов, содержащих лекарственные средства, подлежащие предметно-количественному учету, больным вместо рецепта выдается сигнатура с желтой полосой в верхней части и надписью черным шрифтом на ней "Сигнатура", форма которой предусмотрена приложением N 5 к настоящему Порядку.
IV. Контроль за отпуском аптечными учреждениями (организациями) лекарственных средств
4.1. Внутренний контроль за соблюдением работниками аптечного учреждения (организации) порядка отпуска лекарственных средств (в том числе подлежащих предметно-количественному учету; лекарственных средств, включенных в Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера), а также иных лекарственных средств, отпускаемых бесплатно или со скидкой) осуществляет руководитель (заместитель руководителя) аптечного учреждения (организации) или уполномоченный им фармацевтический работник аптечного учреждения (организации).
4.2. Внешний контроль соблюдения аптечными учреждениями (организациями) порядка отпуска лекарственных средств осуществляется Федеральной службой по надзору в сфере здравоохранения и социального развития и органами по контролю за оборотом наркотических средств и психотропных веществ в пределах их компетенции.
________________
* Аптеки, аптечные пункты, аптечные киоски, аптечные магазины.
Приложения к приказу см. ниже



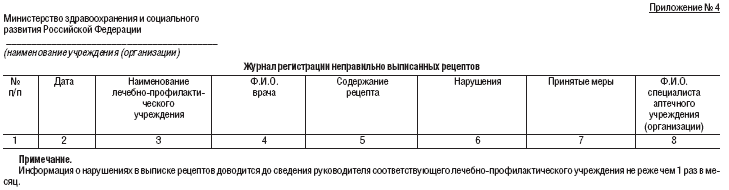
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 28 декабря 2010 г. N 1222н
ОБ УТВЕРЖДЕНИИ ПРАВИЛ
ОПТОВОЙ ТОРГОВЛИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
В соответствии со статьей 54Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; N 31, ст. 4161; N 42, ст. 5293) приказываю:
1. Утвердить прилагаемые Правилаоптовой торговли лекарственными средствами для медицинского применения.
2. Признать утратившими силу:
ПриказМинистерства здравоохранения Российской Федерации от 15 марта 2002 г. N 80 "Об утверждении Отраслевого стандарта "Правила оптовой торговли лекарственными средствами. Основные положения" (зарегистрирован Министерством юстиции Российской Федерации 19 марта 2002 г. N 3302);
ПриказМинистерства здравоохранения Российской Федерации от 21 марта 2003 г. N 122 "О внесении изменений в Приказ Минздрава России от 15 марта 2002 г. N 80" (зарегистрирован Министерством юстиции Российской Федерации 4 апреля 2003 г. N 4377);
ПриказМинистерства здравоохранения Российской Федерации от 28 марта 2003 г. N 130 "О внесении изменений в Приказ Министерства здравоохранения Российской Федерации от 15 марта 2002 г. N 80" (зарегистрирован Министерством юстиции Российской Федерации 11 апреля 2003 г. N 4414).
Министр
Т.А.ГОЛИКОВА
Утверждены
Приказом
Министерства здравоохранения
и социального развития
Российской Федерации
от 28 декабря 2010 г. N 1222н
ПРАВИЛА
ОПТОВОЙ ТОРГОВЛИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
1. Правила оптовой торговли лекарственными средствами для медицинского применения (далее - Правила) определяют порядок оптовой торговли лекарственными средствами для медицинского применения производителями лекарственных средств и организациями оптовой торговли лекарственными средствами для медицинского применения (далее - организации).
2. Правила являются обязательными для всех организаций независимо от их организационно-правовой формы и формы собственности при осуществлении ими оптовой торговли лекарственными средствами для медицинского применения (далее - лекарственные средства).
3. В целях Правил используются основные понятия, установленные Федеральным закономот 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств".
4. Организации могут осуществлять продажу лекарственных средств или передавать их в установленном законодательством Российской Федерации порядке:
организациям оптовой торговли лекарственными средствами;
производителям лекарственных средств для целей производства лекарственных средств;
аптечным организациям;
научно-исследовательским организациям для научно-исследовательской работы;
индивидуальным предпринимателям, имеющим лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность;
медицинским организациям.
5. Оптовой торговле подлежат лекарственные средства, зарегистрированные в Российской Федерации в установленном порядке.
6. Запрещается оптовая торговля фальсифицированными лекарственными средствами, недоброкачественными лекарственными средствами, контрафактными лекарственными средствами.
7. Оптовая торговля лекарственными средствами осуществляется при наличии лицензии на фармацевтическую деятельность (с указанием "оптовая торговля лекарственными средствами"), выданной в установленном законодательством Российской Федерации порядке.
Организация обязана разместить в удобном для ознакомления месте копию лицензии на фармацевтическую деятельность.
8. На лекарственные средства оформляется сопроводительный документ, содержащий информацию:
о дате оформления сопроводительного документа;
о наименовании лекарственного средства (международное непатентованное наименование лекарственного средства и торговое наименование лекарственного средства), сроке годности и номере серии;
о производителе лекарственного средства с указанием наименования и местонахождения производителя;
о количестве упаковок;
о поставщике (идентификационный номер налогоплательщика, полное наименование поставщика, его местонахождение);
о покупателе (идентификационный номер налогоплательщика, полное наименование покупателя, его местонахождение);
о должностном лице, составившем сопроводительный документ (должность, Ф.И.О.).
Документ заверяется подписью должностного лица, составившего сопроводительный документ, печатью организации или информационным штрих-кодом и печатью организации.
9. Прием лекарственных средств осуществляется приемным отделом организации.
Лица, ответственные за проведение погрузочно-разгрузочных работ лекарственных средств:
обеспечивают каждую партию лекарственных средств сопроводительными документами;
контролируют наличие необходимой информации в сопроводительных документах.
Зона приемки лекарственных средств должна быть отделена от зоны их хранения.
10. При проведении погрузочно-разгрузочных работ должна быть обеспечена защита поступающих лекарственных средств от атмосферных осадков, воздействия низких и высоких температур.
11. Лекарственные средства в поврежденной упаковке или не соответствующие заявленным в сопроводительном документе наименованиям и количеству, не имеющие сопроводительного документа, а также подлежащие изъятию из гражданского оборота, должны быть промаркированы и помещены в специально выделенную (карантинную) зону отдельно от других лекарственных средств до их идентификации, возврата поставщику или уничтожения в установленном порядке.
12. Возвращенные получателем лекарственные средства могут быть переданы в зону для основного хранения лекарственных средств организации при соблюдении следующих условий:
оптовая торговля лекарственными средствами не противоречит требованиям действующего законодательства Российской Федерации и Правил;
лекарственные средства находятся в своих первоначальных невскрытых и неповрежденных упаковках;
лекарственное средство соответствует требованиям к его качеству, что подтверждено соответствующими документами.
13. Лекарственные средства, возвращенные в организацию, должны быть изолированы в специально выделенную (карантинную) зону до принятия по ним решения.
14. Руководитель организации должен обеспечить организацию системы внутреннего контроля за соблюдением Правил.
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ от 3 сентября 2010 г. N 674
ОБ УТВЕРЖДЕНИИ ПРАВИЛ УНИЧТОЖЕНИЯ НЕДОБРОКАЧЕСТВЕННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ФАЛЬСИФИЦИРОВАННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И КОНТРАФАКТНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В соответствии со статьями 47и59Федерального закона "Об обращении лекарственных средств" Правительство Российской Федерации постановляет: Утвердить прилагаемые Правила уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств.
Председатель Правительства Российской Федерации В.ПУТИН
УТВЕРЖДЕНЫ постановлением Правительства Российской Федерации от 3 сентября 2010 г. N 674
ПРАВИЛА УНИЧТОЖЕНИЯ НЕДОБРОКАЧЕСТВЕННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ФАЛЬСИФИЦИРОВАННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И КОНТРАФАКТНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
1. Настоящие Правила определяют порядок уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств, за исключением вопросов, связанных с уничтожением наркотических лекарственных средств и их прекурсоров, психотропных лекарственных средств и радиофармацевтических лекарственных средств. 2. Недоброкачественные лекарственные средства и (или) фальсифицированные лекарственные средства подлежат изъятию и уничтожению по решению владельца указанных лекарственных средств, решению Федеральной службы по надзору в сфере здравоохранения и социального развития или решению суда. 3. Федеральная служба по надзору в сфере здравоохранения и социального развития в случае выявления фактов ввоза на территорию Российской Федерации или фактов обращения на территории Российской Федерации недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств принимает решение, обязывающее владельца указанных лекарственных средств осуществить их изъятие, уничтожение и вывоз в полном объеме с территории Российской Федерации. Указанное решение должно содержать: а) сведения о лекарственных средствах; б) основания изъятия и уничтожения лекарственных средств; в) срок изъятия и уничтожения лекарственных средств; г) сведения о владельце лекарственных средств; д) сведения о производителе лекарственных средств. 4. Владелец недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств в срок, не превышающий 30 дней со дня вынесения Федеральной службой по надзору в сфере здравоохранения и социального развития решения об их изъятии, уничтожении и вывозе, обязан исполнить это решение или сообщить о своем несогласии с ним. 5. В случае если владелец недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств не согласен с решением об изъятии, уничтожении и вывозе указанных лекарственных средств, а также если он не выполнил это решение и не сообщил о принятых мерах, Федеральная служба по надзору в сфере здравоохранения и социального развития обращается в суд. 6. Недоброкачественные лекарственные средства и фальсифицированные лекарственные средства, находящиеся под таможенным режимом уничтожения, подлежат уничтожению в порядке, установленном таможенным законодательством. 7. Недоброкачественные лекарственные средства, фальсифицированные лекарственные средства и контрафактные лекарственные средства подлежат уничтожению на основании решения суда. 8. Уничтожение недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств осуществляется организацией, имеющей лицензию на деятельность по сбору, использованию, обезвреживанию, транспортировке и размещению отходов I-IV класса опасности (далее - организация, осуществляющая уничтожение лекарственных средств), на специально оборудованных площадках, полигонах и в специально оборудованных помещениях с соблюдением требований по охране окружающей среды в соответствии с законодательством Российской Федерации. 9. Расходы, связанные с уничтожением недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств, возмещаются их владельцем. 10. Владелец недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств, принявший решение об их изъятии, уничтожении и вывозе, передает указанные лекарственные средства организации, осуществляющей уничтожение лекарственных средств, на основании соответствующего договора. 11. Организация, осуществляющая уничтожение лекарственных средств, составляет акт об уничтожении лекарственных средств, в котором указываются: а) дата и место уничтожения лекарственных средств; б) фамилия, имя, отчество лиц, принимавших участие в уничтожении лекарственных средств, их место работы и должность; в) обоснование уничтожения лекарственных средств; г) сведения об уничтоженных лекарственных средствах (наименование, лекарственная форма, дозировка, единицы измерения, серия) и их количестве, а также о таре или упаковке; д) наименование производителя лекарственных средств; е) сведения о владельце лекарственных средств; ж) способ уничтожения лекарственных средств. 12. Акт об уничтожении лекарственных средств составляется в день уничтожения недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств. Количество экземпляров этого акта определяется по числу сторон, принимавших участие в уничтожении указанных лекарственных средств, подписывается всеми лицами, принимавшими участие в уничтожении указанных лекарственных средств, и заверяется печатью организации, осуществляющей уничтожение лекарственных средств. 13. Акт об уничтожении лекарственных средств или его копия, заверенная в установленном порядке, в течение 5 рабочих дней со дня его составления направляется владельцем уничтоженных лекарственных средств в Федеральную службу по надзору в сфере здравоохранения и социального развития. В случае если уничтожение недоброкачественных лекарственных средств и (или) фальсифицированных лекарственных средств осуществлялось в отсутствие владельца уничтоженных лекарственных средств, акт об уничтожении лекарственных средств или его копия, заверенная в установленном порядке, в течение 5 рабочих дней со дня его составления направляется организацией, осуществляющей уничтожение лекарственных средств, их владельцу. 14. Контроль за уничтожением недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств осуществляет Федеральная служба по надзору в сфере здравоохранения и социального развития.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
