
- •Тема 17. Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
- •Реакции дезаминирования
- •Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
- •Реакции декарбоксилирования
- •Тема 18. Химия нуклеопротеинов Нуклеиновые кислоты — биополимеры, мономерами которых являются нуклеотиды.
- •Номенклатура нуклеозидов и нуклеотидов
- •Строение днк
- •Строение рнк
- •Тема 19. Обмен нуклеопротеинов
- •Биосинтез нуклеотидов
- •De novo синтез пуриновых нуклеотидов
- •Фосфорибозиламин
- •Инозинмонофосфат
- •De novo синтез пиримидиновых нуклеотидов
- •ДТмф дУмф умф
- •Образование дезоксирибонуклеотидов
- •Тема 20. Биосинтез днк, рнк и белка
- •Биосинтез днк
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
Тема 17. Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
Распад большинства аминокислот начинается с переаминирования. Эти реакции не высвобождают аммиак, а переносят аминогруппу с аминокислоты на кетокислотный акцептор. Трансаминазы используют пиридоксальфосфат в качестве коэнзима. Это главный путь удаления азота у аминокислот. Существуют трансаминазы для большинства аминокислот. После поступления пищевых аминокислот из воротной вены печень трансаминирует значительную часть аминокислот. Исключением являются аминокислоты с разветвленным углеводородным радикалом, для них в печени нет соответствующей трансаминазы. Концентрация таких аминокислот в крови, оттекающей от печени, выше, чем в системе воротной вены.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число -кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует -кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров:
Аспарагиновая
трансаминаза (АСТ)
АСП + α-КГ
Оксалоацетат + ГЛУ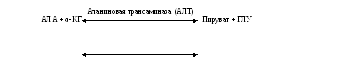
Акцептором аминогруппы для большинства трансаминаз является -кетоглутаровая кислота. Однако оксалоацетат и ПВК также можно рассматривать в качестве важных акцепторов аминогрупп.
Реакции дезаминирования
Отщепление аминогруппы у аминокислоты называют дезаминированием. Различают два типа реакций: прямое и непрямое дезаминирование. Имеется несколько типов прямого дезаминирования. Эти реакции генерируют свободный аммиак — токсичное соединение, подлежащее связыванию и обезвреживанию.
Прямое дезаминирование:

Выделены ферменты, катализирующие окислительное дезаминирование с участием флавиновых коферментов. Эти ферменты обладают выраженной специфичностью к D- и L-аминокислотам. Они получили название оксидаз аминокислот из-за их способности взаимодействовать с молекулярным кислородом с образованием пероксида водорода. Особо высокой активностью в клетках обладают оксидазы D-аминокислот. Окислительное дезаминирование L-аминокислот при помощи оксидаз аминокислот у большинства млекопитающих обнаружено только в печени и почках. Некоторые из этих реакций не играют важной роли у человека, а некоторые аминокислоты дезаминируются при помощи специальных реакций.
Окислительное дезаминирование глутаминовой кислоты с образованием -кето-глутарата и аммиака:
![]()
Эта реакция протекает с участием НАД+ или НАДФ+. Фермент — глутаматдегидрогеназа присутствует в митохондриальном матриксе в высоких концентрациях и обладает высокой активностью. Аммиак, полученный в печеночных митохондриях, используется для синтеза мочевины.
Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
С
 интез
глутамина.
Реакция
катализируется глутаминсинтетазой:
интез
глутамина.
Реакция
катализируется глутаминсинтетазой:
Распределение и субклеточная локализация. Реакция протекает в цитозоле клеток всех тканей, но особенно выражена в мозге, где аммиак наиболее токсичен, и мышцах, где обмен белков мышц сопровождается образованием значительных количеств аммиака.
Функции глутамина:
a) во всех тканях глутамин является донором азота для синтеза важных молекул, в частности, для пуринового и пиримидинового синтеза;
б) является нетоксичной формой транспорта аммиака из разных тканей к клеткам печени, где он превращается в мочевину;
в) в кишечнике служит источником энергии для энтероцитов;
г) в почках участвует в поддержании кислотно-щелочного равновесия. Гидролиз амидной группы в боковой цепи глутамина глутаминазой позволяет связывать протоны. Это особенно важно в условиях метаболического ацидоза.
2. Синтез мочевины. Печень — единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом ее синтеза. Участвуют митохондриальные ферменты и ферменты цитозоля (рис. 17.1).
Суммарная реакция синтеза мочевины:
Аспартат + NH3 + CO2 + 3АТФ + 2 H2O → Мочевина + Фумарат + 2АДФ + АМФ + 2Фн + ФФн
Энергетический баланс. 3 молекулы АТФ расходуется на синтез каждой молекулы мочевины.
Синтез карбамоилфосфата (происходит в митохондриях):
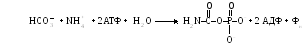
2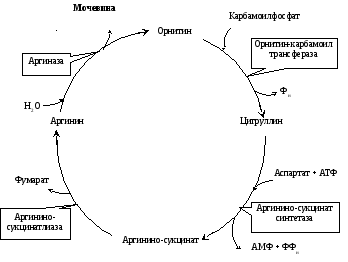 .Образование
мочевины:
.Образование
мочевины:
Рис. 17.1. Орнитиновый цикл мочевинообразования
