
- •Тема №7: «коррозия металлов и сплавов»
- •Классификация коррозионных сред, разрушений и процессов. Показатели скорости коррозии.
- •Химическая коррозия: виды и разновидности.
- •Электрохимическая коррозия: причины и механизм возникновения.
- •3. Термодинамика и кинетика газовой и электрохимической коррозии
- •Термодинамика и кинетика газовой коррозии.
-
Химическая коррозия: виды и разновидности.
Химическая коррозия характерна для сред, преимущественно не проводящих электрический ток (иключение: опыт №1 из лабораторной работы — там химическая коррозия протекает в растворе HCl). В зависимости от вида этих сред различают:
-
Химическую коррозию в жидкостях-неэлектролитах — неэлектропроводных жидких средах, обычно органического происхождения (сернистая нефть, керосин, бензол);
-
Химическую газовую коррозию (в дальнейшем газовую), протекающую обычно при высоких температурах.
Эти два вида химической коррозии не сопровождаются возникновением электрического тока, т.е. представляют собой обычное окислительно-восстановительное (химическое) взаимодействие металла с окружающей средой.
Газовая коррозия является наиболее часто встречающимся видом химической коррозии и обычно протекает при высоких температурах в газах и парах агрессивных веществ, когда исключена возможность их конденсации на поверхности металла, поэтому ее называют высокотемпературной коррозией. Это коррозия сопел ракетных двигателей, лопаток газовых турбин, элементов электронагревателей и др. К газовым коррозионным агентам относятся О2, СО2, SO2, H2O, H2S, Cl2. Их агрессивность по отношению к различным металлам не является одинаковой, следовательно, и скорость коррозии различается.
Рассмотрим пример наиболее часто встречающейся на практике газовой коррозии:— коррозия железа, чугуна и сталей в атмосфере О2,, СО2, и H2O:
При нагревании этих материалов происходит их окисление:
Fe + H2O → FeO + H2
Fe + CO2 → FeO + CO
2Fe + O2 → 2FeO
Состав продуктов окисления определяется главным образом температурой газовой коррозионной среды.
Наряду с окислением, в сталях и чугуне протекает процесс обезуглероживания — обеднения поверхностного слоя углеродом вследствие взаимодействия карбида железа, содержащегося в них, с кислородом и кислородсодержащими реагентами:
Fe3C + O2 → 3Fe + CO2
Fe3C + CO2 → 3Fe + 2CO
Fe3C + H2O → 3Fe + CO + H2
При этом ухудшаются их механические и антикоррозионные свойства.
Обезуглероживание может происходить и в атмосфере водорода:
Fe3C + 2H2 → 3Fe + CН4 ↑
Этот вид газовой коррозии называют водородной. Наряду с обезуглероживанием одновременно осуществляется и наводороживание — проникновение атомарного водорода в материал и последующее его растворение в нем, что ведет к резкому снижению пластичности металла.
-
Электрохимическая коррозия: причины и механизм возникновения.
На практике чаще всего приходится иметь дело с электрохимической коррозией. Она, в отличие от химической, сопровождается возникновением электрического тока и протекает, как правило, в средах с хорошей ионной проводимостью.
По условиям осуществления различают:
— коррозию в электролитах;
— атмосферную коррозию;
— электрокоррозию;
— коррозию под напряжением и др.
Причинами возникновения электрохимической коррозии служат различные виды неоднородностей как самой поверхности металла или сплава, так и коррозионной среды. В результате вся поверхность, соприкасающаяся с токопроводящей коррозионной средой, разделяется на катодные и анодные участки, которые имеют очень малые размеры и чередуются друг с другом. В такой среде они представляют собой совокупность огромного числа короткозамкнутых коррозионных гальванических элементов, вследствие чего электрохимическую коррозию часто называют гальванической коррозией.
В СИСТЕМАХ ВОЗМОЖНО ВОЗНИКНОВЕНИЕ КОРРОЗИОННЫХ НЕ ТОЛЬКО МИКРО-, НО И МАКРОЭЛЕМЕНТОВ, НАПРИМЕР, ПРИ КОНТАКТЕ С ЭЛЕКТРОЛИТОМ ДВУХ СОПРИКАСАЮЩИХСЯ ДЕТАЛЕЙ, ИЗГОТОВЛЕННЫХ ИЗ МЕТАЛЛОВ РАЗЛИЧНОЙ АКТИВНОСТИ (ТАК НАЗЫВАЕТАЯ КОНТАКТНАЯ КОРРОЗИЯ).
Механизм электрохимической коррозии сводится к возникновению и функционированию коррозионных гальванических макро- и микро-элементов., поэтому ее процессы аналогичны процессам, протекающим в химических источниках тока: гальванических и топливных элементах, аккумуляторах. Основное отличие коррозионных процессов — отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а перемещаются внутри него от анодных участков к катодным.
Процесс электрохимической коррозии представляет собой совокупность двух взаимосвязанных полуреакций., одновременно протекающих на поверхности металла:
а) анодной, сопровождающейся окислением атомов металла на анодных участках поверхности:
(–) А: Ме – ne → Меn+
б) катодной, сопровождающейся восстановлением окислителя (окисленной формы компонента Оф) коррозионной среды (электролита) на катодных участках поверхности:
(+) К: Оф + ne → Вф
Окислители электрохимической коррозии называют деполяризаторами. К наиболее часто встречающимся деполяризаторам относятся молекулы О2, Н2О и ионы водорода Н+. Основными катодными реакциями с их участием при электрохимической коррозии являются:
-
в аэрированных (насыщенных кислородом) коррозионных средах:
нейтральных и щелочных (рН ≥ 7)
(+) К: О2 + 2Н2О + 4е → 4ОН– (φ0 = 0,401 В);
в кислотных (рН < 7)
(+) К: О2 + 4Н+ + 4е→ 2Н2О (φ0 = 1,229 В);
-
в деарированных (несодержащих растворенный кислород) коррозионных средах:
нейтральных и щелочных (рН ≥ 7)
(+) К: 2Н2О + 2е → Н2 ↑ + 2ОН– (φ0 = –0,828 В);
в кислотных (рН < 7)
(+) К: 2Н+ + 2е→ Н2 (φ0 = 0 В);
Коррозию, сопровождающуюся восстановлением молекул кислорода (в аэрированных средах) называют коррозией с поглощением кислорода или коррозией с кислородной деполяризацией.
C кислородной деполяризацией протекают следующие виды электрохимической коррозии: атмосферная, подземная, в воде (пресной и морской), растворах солей. Коррозию, сопровождающуюся восстановлением молекул воды и ионов водорода называют коррозией с выделением водорода, или коррозией с водородной деполяризацией. В некоторых условиях электрохимическая коррозия может протекать одновременно и с водородной, и с кислородной деполяризацией — так называемый смешанный вид деполяризации.
Процессы, описываемые записанными выше уравнениями, называют первичными процессами, а их продукты — первичными продуктами коррозии. Кроме первичных при электрохимической коррозии протекают еще и вторичные процессы — химические взаимодействия первичных продуктов друг с другом, с компонентами электролитной коррозионной среды, с растворенными в ней газами и др. При этом образуются пленки малорастворимых вторичных продуктов, например, гидроксидов, фосфатов металлов, которые затрудняют доступ электролита к поверхности металла. В результате снижается скорость электрохимической коррозии, а иногда коррозия и совсем прекращается.
Рассмотрим наиболее характерные и часто встречающиеся на практике случаи электрохимической коррозии.
— Коррозионное разрушение сплава обусловлено его неоднородностью по химическому составу (пример из лабораторной работы, либо из контрольной работы).
Рис. 1 Схема контактной коррозии
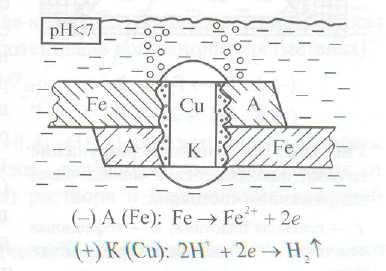
Скорость этой разновидности электрохимической коррозии в целом тем больше, чем дальше отстоят друг от друга в ряду напряжений металлы, из которых изготовлены детали, образующие макрогальваноэлемент.
— Коррозия под напряжением — разрушение деталей, находящихся в электролитной среде в механически напряженном состоянии. Механические напряжения изменяют потенциал металла: потенциал металла растянутой поверхности будет меньше потенциала металла без напряжения, а потенциал металла сжатой, наоборот, больше потенциала металла без напряжения. В связи с этим растянутая поверхность будет являться анодной, сжатая — катодной. Поэтому если пластину из стали, дюраля или титанового сплава согнуть и в таком состоянии поместить, например, в коррозионную среду с рН < 7, то растянутая поверхность начнет корродировать и на ней через короткое время появятся трещины, а сжатая будет оставаться без изменений (рис.2).
Рис.2 Коррозионное разрушение детали,
находящейся в механически напряженном
состоянии:
1– стальная пластина; 2– тефлоновая
подставка; 3 – кислотная коррозионная
среда.

— Коррозия под действием блуждающих токов (электрокоррозия). Блуждающими называют токи, ответвляющиеся от своего основного пути. Это токи утечки из электрических цепей или любые токи, попадающие в землю от внешних источников (пути электропоездов, заземления линий тока, электрические кабели и т.п.).
Блуждающие токи вызывают коррозию газо– и нефтепроводов, электрокабелей, различных металлических подземных сооружений. Радиус их действия исчисляется десятками километров. Обычно коррозионные разрушения бывают локального типа и располагаются в местах выхода токов в землю или воду. Для подземных трубопроводов и путей электропоездов это, как правило, места изолированных сочленений и плохого контакта рельсов на стыках соответственно, а также места с недостаточной изоляцией от земли. Они являются анодными зонами и подвергаются усиленной коррозии (рис. 3).
Рассмотренные случаи не исчерпывают всего многообразия электрохимических коррозионных процессов, но дают представления об основных видах неоднородностей, характере взаимодействия изделий с коррозионной средой и причинах возникновения потенциалов в коррозионных средах.
Рис. 3. Схема возникновения блуждающих
токов от трамвайной линии и механизм
коррозионного разрушения ими рельсов
и трубопровода.

