
Тема №4: «растворы»
Вопросы лекции:
Основные понятия и определения.
Идеальные растворы. Физико-химические свойства разбавленных растворов неэлектролитов и электролитов. Законы Рауля, Вант-Гоффа.
Электролитическая диссоциация. Слабые и сильные электролиты. Степень и константа диссоциации. Активность.
Электролитическая диссоциация воды. Водородный показатель. Ионное произведение воды.
Гидролиз солей.
Химически чистое вещество представляет собой предельное состояние, которое практически не достигается. Даже особо чистые металлы, получаемые методами вакуумной или зонной плавки, содержат определенное количество примесей, около 10–6% (масс.) и по существу являются твердыми растворами. Образование растворов — систем, не подчиняющихся стехиометрическим законам (сохранения массы, постоянства состава, кратных и объемных отношений, эквивалентов), и обладающих переменным составом, существенно изменяет условия протекания химических реакций между компонентами. Растворы широко распространены в природе (особенно водные) и играют важную роль во многих отраслях промышленности и техники.
Изучение физико–химических свойств растворов, условий их образования обогащает и углубляет представления о механизме и закономерностях протекания химических процессов.
Вопрос 1. Раствор — гомогенная физико–химическая система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия.
По агрегатному состоянию растворы разделяют на жидкие, твердые и газообразные (рис.1). Наиболее значительную роль в химии и особенно в биохимии играют жидкие растворы.
Компонентами раствора являются растворитель (среда) и растворенное вещество, равномерно распределенное в растворителе в виде молекул или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, как и раствор в целом. Если вещества, составляющие раствор, имеют одинаковое агрегатное состояние (например, спирт и вода), то растворителем называют то из веществ, которое имеется в бόльшем количестве.
Рис.1. Классификация
растворов.
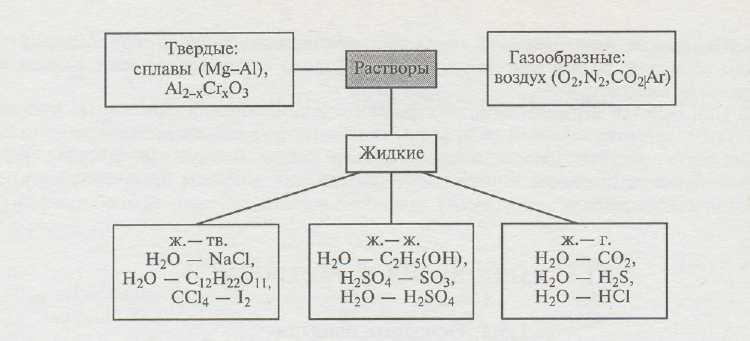
Относительные количества компонентов раствора можно изменять в довольно широких пределах.
Процесс растворения вещества нельзя считать чисто физическим явлением. При растворении происходит химическое взаимодействие частиц растворенного вещества с молекулами растворителя, в результате чего образуются соединения, называемые сольватами. Если растворителем является вода, то эти соединения называют гидратами.
Как правило, гидраты — соединения менее прочные, чем обычные химические соединения. Однако часто гидратная вода настолько прочно связывается с молекулами растворенного вещества, что при кристаллизации входит в состав твердой фазы. Эту воду называют кристаллизационной водой, а сами кристаллические образования — кристаллогидратами, состав которых выражают формулами CuSO4·5H2O, FeSO4·7H2O, Na2SO4·10H2O и т.п.
Процесс растворения кристаллических веществ в воде состоит из двух последовательных стадий, каждая из которых сопровождается тепловым эффектом:
1 стадия — разрушение кристаллической решетки растворяемого вещества на отдельные частицы — идет с поглощением теплоты (∆Н1 > 0).
2 стадия — взаимодействие частиц растворенного вещества с молекулами воды (гидратация) — идет с выделением теплоты (∆Н2 < 0).
Таким образом, тепловой эффект растворения ∆Н является алгебраической суммой двух тепловых эффектов: ∆Н = ∆Н1 + ∆Н2.
Растворимостью называют способность данного вещества растворяться в том или ином растворителе. Количественно растворимость характеризуется массой вещества или количеством вещества, которое может раствориться при данной температуре в определенном количестве растворителя.
Раствор, в котором при данной температуре вещество больше растворяться не может, называют насыщенным.
Если вещество еще может растворяться в данном растворе, то оно называется ненасыщенным.
Из сказанного следует, что концентрация вещества в насыщенном растворе равна его растворимости, концентрация ненасыщенного раствора всегда меньше величины растворимости.
Растворимость веществ обычно зависит от температуры — самостоятельное изучение.
Часто растворы подразделяют на разбавленные и концентрированные.— самостоятельное изучение.
Коллигативные свойства растворов.
Коллигативными называют такие свойства раствора, которые зависят только от концентрации растворенного вещества и природы растворителя, но не зависят от природы растворенного вещества.
К этим свойствам относятся: 1) понижение давления насыщенного пара над раствором; 2) понижение температуры замерзания; 3) повышение температуры кипения; 4) осмотическое давление. Далее мы будем рассматривать их в применении к растворам нелетучих веществ, т.е. давление пара которых над раствором пренебрежимо мало.
Коллигативные свойства раствора — это свойства идеального раствора.
Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а сила межмолекулярного взаимодействия однородных и разнородных частиц одинакова.
Соответственно, образование этих растворов не сопровождается тепловым эффектом (∆Н = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.
Понижение давления насыщенного пара над раствором.
Одно из важнейших явлений, характерных для жидких растворов, — понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара чистого растворителя.
Давление насыщенного пара при данной температуре характеризует равновесие между жидким и газообразным состоянием вещества в закрытой системе, возникающее на границе раздела фаз вследствие выравнивания скоростей эндотермического процесса испарения и экзотермического процесса конденсации. В растворе концентрация молекул растворителя в поверхностном слое меньше, чем в чистом растворителе (молекулы растворенного вещества сольватируясь (гидратируясь) занимают часть поверхности раствора), поэтому равновесие достигается при меньшем давлении насыщенного пара.
Выражение Р0А–РА = ∆РА = Р0А· Nв
количественно выражает связь между концентрацией растворенного вещества в растворе и давлением насыщенного пара растворителя над раствором. Его называют законом Рауля: понижение давления насыщенного пара растворителя А над раствором ∆РА пропорционально мольной доле растворенного нелетучего вещества ·Nв.
Здесь Р0А и РА — давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ∆РА – разность между давлениями насыщенного пара растворителя над раствором РА и растворителем Р0А.
Из выражения закона Рауля следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
Повышение температуры кипения ∆Ткип. пропорционально моляльности раствора.
∆Ткип. = Кэ ·Сm ,
где Кэ — эбуллиоскопическая постоянная (ebullir — выкипать, skopeo — смотрю). Она означает повышение температуры кипения раствора при его моляльной концентрации, равной 1.
Вспомнив определение моляльности раствора можно записать:
∆Ткип. = Кэ mр.в.·1000/М·mр-ля
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Раствор замерзает при более низкой температуре, чем растворитель, так как молекулы растворенного вещества при понижении температуры препятствуют формированию кристаллической решетки при затвердевании раствора.
Понижение температуры замерзания (кристаллизации) ∆Тзам. пропорционально моляльности раствора:
∆Тзам. = Кк ·Сm
или ∆Тзам. = Кк mр.в.·1000/М·mр-ля
где Кк — криоскопическая постоянная (kryos — лед, холод). Она означает понижение температуры затвердевания раствора при его моляльной концентрации, равной 1.
Значения Кэ и Кк зависят от природы растворителя и не зависят от природы растворенного вещества и его концентрации.
Значения Кэ и Кк — справочные величины.
Осмотическое давление —
