
- •Утверждаю
- •Предисловие
- •Введение
- •1. Важнейшие классы и названия неорганических веществ
- •Простые вещества
- •Сложные вещества
- •Соединения элементов с кислородом
- •Химические свойства оснований
- •Классификация кислот
- •Классификация солей
- •Удовенко елена васильевна
- •Научный редактор о.Г. Казаков
- •Темплан 2007 г., п.517
Химические свойства оснований
1.
Основание + кислота
![]() соль + вода
соль + вода
КОН
+ HCl
![]() KCl + H2O.
KCl + H2O.
2.
Основание + кислотный оксид
![]() соль + вода
соль + вода
2KOH
+ SO2
![]() K2SO3
+ H2O.
K2SO3
+ H2O.
3.
Щелочь + амфотерный оксид/гидроксид
![]() соль
+ вода
соль
+ вода
2NaOH(тв)
+ Al2O3
![]() 2NaAlO2
+ H2O;
2NaAlO2
+ H2O;
NaOH(тв)
+ Al(OH)3
![]() NaAlO2
+ 2H2O.
NaAlO2
+ 2H2O.
Основание + соль
 соль + основание.
соль + основание.
Реакция обмена между основанием и солью протекает только в растворе (и основание, и соль должны быть растворимы) и только в том случае, если хотя бы один из продуктов – осадок или слабый электролит (NH4OH, H2O)
Ba(OH)2
+ Na2SO4
![]() BaSO4
BaSO4![]() +
2NaOH;
+
2NaOH;
Ba(OH)2
+ NH4Cl
![]() BaCl2
+ NH4OH.
BaCl2
+ NH4OH.
Основание
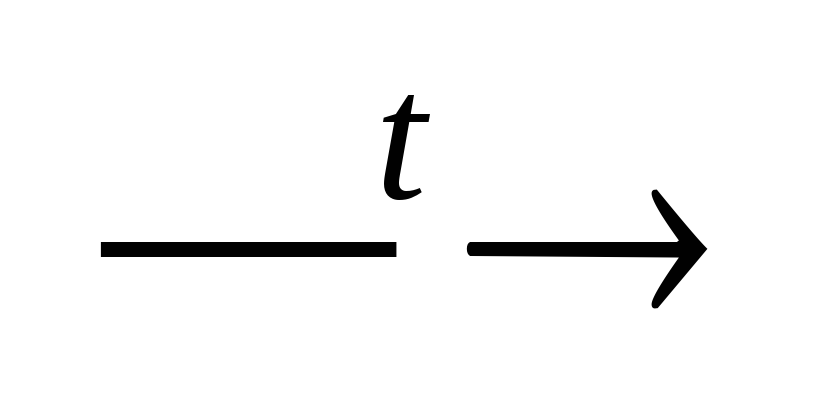 основной
оксид + вода.
основной
оксид + вода.
Термостойки только основания щелочных металлов за исключением LiOH
Ca(OH)2
![]() CaO
+ H2O;
CaO
+ H2O;
NaOH
![]() ;
;
NH4OH
![]() NH3
+ H2O.
NH3
+ H2O.
Щелочь + металл (образующий амфотерный оксид)
 соль + Н2
соль + Н2
2NaOH(тв)
+ Zn
![]() Na2ZnO2
+ H2.
Na2ZnO2
+ H2.
КИСЛОТЫ
Кислотами
с позиции ТЭД называются сложные
вещества, диссоциирующие в растворах
с образованием иона водорода Н+.
Классификация кислот
1. По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (HF, HNO2), двухосновные (H2CO3, H2SO4), трехосновные (H3PO4).
2. По составу кислоты делят на бескислородные (HCl, H2S) и кислородсодержащие (HClO4, HNO3).
3. По способности кислот диссоциировать в водных растворах их делят на слабые и сильные. Молекулы сильных кислот в водных растворах распадаются на ионы полностью и их диссоциация необратима.
Например,
HCl
![]() H+
+ Cl-;
H+
+ Cl-;
H2SO4
![]() H+
+ HSO
H+
+ HSO![]() .
.
Слабые кислоты диссоциируют обратимо, т.е. их молекулы в водных растворах распадаются на ионы частично, а многоосновные - ступенчато.
СН3СООН
![]() СН3СОО-
+ Н+;
СН3СОО-
+ Н+;
1)
H2S
![]() HS-
+
H+,
2)
HS-
HS-
+
H+,
2)
HS-
![]() H+
+ S2-.
H+
+ S2-.
Часть
молекулы кислоты без одного или нескольких
ионов водорода Н+
называется кислотным
остатком.
Заряд кислотного остатка всегда
отрицательный и определяется числом
ионов Н+,
отнятых от молекулы кислоты. Например,
ортофосфорная кислота H3PO4
может
образовать три кислотных остатка: H2PO![]() -
дигидрофосфат-ион, HPO
-
дигидрофосфат-ион, HPO![]() -
гидрофосфат-ион, PO
-
гидрофосфат-ион, PO![]() -
фосфат-ион.
-
фосфат-ион.
Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN- - циан) окончание - водородная: HCl – хлороводородная кислота (соляная кислота), H2S – сероводородная кислота, HCN – циановодородная кислота (синильная кислота).
Названия кислородсодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на «…ная» или «…овая», например, H2SO4 – серная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: «…ная» (HClO4 – хлорная кислота), «…оватая» (HClO3 – хлорноватая кислота), «…истая» (HClO2 – хлористая кислота), «…оватистая» (HClO- хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающей низшей степени окисления элемента, получает окончание «…истая» (HNO3 – азотная кислота, HNO2 – азотистая кислота).
Одному и тому же кислотному оксиду (например, Р2О5) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например, HPO3 и H3PO4). В подобных случаях к названию кислоты, содержащей наименьшее число атомов кислорода в молекуле, добавляется приставка «мета…», а к названию кислоты, содержащей в молекуле наибольшее число атомов кислорода – приставка «орто…» (HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота).
Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, то к ее названию добавляется числительная приставка, например, Н4Р2О7 – двуфосфорная кислота, Н2В4О7 – четырехборная кислота.
Кислоты, содержащие в своем составе группировки атомов –О-О-, можно рассматривать как производные перекиси водорода. В случае необходимости после приставки «пероксо…» в название кислоты помещают числительную добавку, указывающую на число атомов кислотообразующего элемента, входящего в состав молекулы, например,
Н2SO5 H2S2O8


 H
- O O
O
O
H
- O O
O
O


 S
H
– O – S
–O – O – S – O - H
S
H
– O – S
–O – O – S – O - H
H
- O - O
![]() O
O
O
O
O
O
Пероксосерная кислота Пероксодвусерная кислота
Химические свойства кислот
Кислота + основание
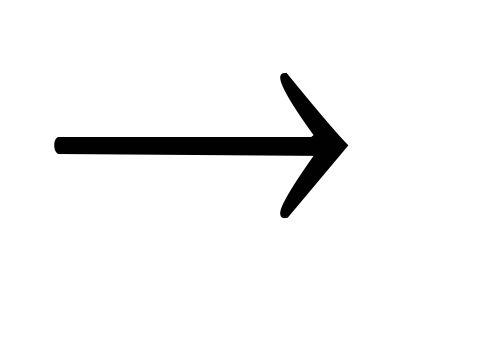 соль + вода
соль + вода
HF
+ KOH
![]() KF + H2O.
KF + H2O.
Кислота + основной оксид
 соль + вода
соль + вода
H2SO4
+ CuO
![]() CuSO4
+ H2O.
CuSO4
+ H2O.
Кислота + амфотерный оксид/гидроксид
 соль + вода
соль + вода
2HCl
+ BeO
![]() BeCl2
+ H2O.
BeCl2
+ H2O.
Кислота + соль
 соль + кислота.
соль + кислота.
Кислоты взаимодействуют с растворами солей, если при этом образуется нерастворимая в кислотах соль или более слабая (летучая) по сравнению с исходной кислота
H2SO4
+ BaCl2
![]() BaSO4
BaSO4
![]() +2HCl;
+2HCl;
2HNO3
+ Na2CO3
![]() 2NaNO3
+ H2O
+
CO2
2NaNO3
+ H2O
+
CO2![]() .
.
Кислота
 кислотный
оксид + вода
кислотный
оксид + вода
Н2СО3
![]() Н2О
+ СО2.
Н2О
+ СО2.
Кислота + металл (в ряду напряжений до Н2)
 соль + Н2
соль + Н2
H2SO4(разб)
+ Fe
![]() FeSO4
+ H2;
FeSO4
+ H2;
HCl
+ Cu
![]() .
.
На рисунке 2 показано взаимодействие кислот с металлами.
КИСЛОТА
- ОКИСЛИТЕЛЬ Металл
в ряду напряжения после Н2![]() реакция не идет
реакция не идет
Металл
в ряду напряжения до Н2
+ ![]() соль металла
+ Н2
соль металла
+ Н2![]()
в min степени
H2SO4
концентриро- ванная Au,
Pt, Ir, Rh, Ta
+
![]() реакция
не идет
реакция
не идет
Металл
щелочной/ щелочноземельный/Mq/Zn H2S/SO2/S от
условий Сульфат
металла в max с.о.
Н2О
+
![]() + +
+ +
+
Металл
(остальные) SO2
+
![]() +
+
+
+
HNO3
концентриро- ванная Au,
Pt, Ir, Rh, Ta
+ ![]() реакция не идет
реакция не идет
Металл
щелочной/ щелочноземельный N2O Нитрат
металла в max с.о.
Н2О
Металл
(остальные; Al,Cr, Fe, Co, Ni при
нагревании) NO2![]()
![]()
+
![]()
![]() +
+
+
HNO3
разбавленная Au,
Pt, Ir, Rh, Ta
+ ![]() реакция
не идет
реакция
не идет
Металл
щелочной/ щелочноземельный NH3
(NH4NO3)
Нитратметал ла
в max с.о.
Н2О
+ ![]() +
+
Металл
(остальные в ярду напряжений до Н2) NO/N2O/N2/NH3(NH4NO3) от
условий
+
![]()
Металл
(остальные в ряду напряжений после Н2) NO
+ +
![]()
Рис.2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ
СОЛИ
Соли – это сложные вещества, диссоциирующие в растворах с образованием положителльно заряженных ионов (катионов – основных остатков), за исключением ионов водорода, и отрицательно заряженных ионов (анионов – кислотных остатков), отличных от гидрокисид – ионов.
