
- •1. Цель работы
- •2.Теоретическая часть
- •2.1. Основные классы дисперсных систем
- •2.2. Поверхностные свойства коллоидно-дисперсных систем
- •2.3. Получение коллоидных растворов
- •2.4. Молекулярно-кинетические свойства коллоидных систем
- •2.5. Оптические свойства коллоидных систем
- •2.6. Строение коллоидных частиц
- •2.7. Электрокинетические явления
- •Коагуляция и седиментация коллоидных систем электролитами
- •Экспериментальная часть
- •Техника безопасности
- •Карта самоконтроля
- •Вопросы и упражнения
- •Список рекомендуемой литературы
- •Темплан 2008 г., п. 87
2.5. Оптические свойства коллоидных систем
Размер коллоидных частиц лежит в пределах 10-9-10-7м и именно в связи с такой высокой степенью дисперсности гетерогенность коллоидных растворов нельзя обнаружить с помощью обычного микроскопа. Если наблюдать коллоидные растворы в проходящем свете, то они окажутся совершенно прозрачными, но при боковом освещении они оставляют на пути прохождения пучка света на темном фоне световой след. Образующийся световой конус получил название конуса Тиндаля, а само явление – эффект Фарадея–Тиндаля (рис. 2).
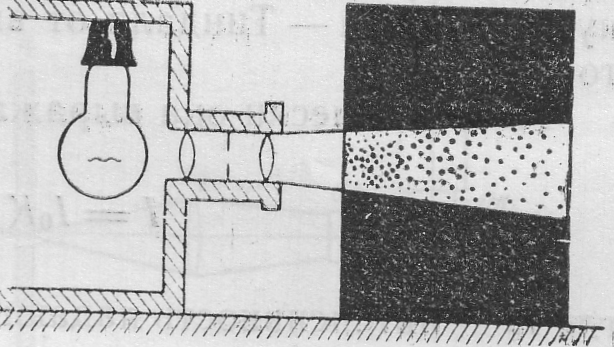
Рис.2. Эффект Фарадея-Тиндаля.
Образование расходящегося светового конуса можно также увидеть на темном фоне неба, от луча солнечного света, проникшего в темную запыленную комнату.
В истинных растворах низкомолекулярных веществ рассеяние света ничтожно мало, поэтому при освещении их световой конус не наблюдается. Эффект Фарадея-Тиндаля позволяет решить вопрос, является ли данный раствор коллоидным или истинным.
2.6. Строение коллоидных частиц
Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель.
Рассмотрим процесс образования гидрозоля и строение его дисперсных частиц на примере гидрозоля AgCl.
Этот гидрозоль образуется при медленном приливании водного раствора NaCl к водному раствору AgNO3, взятому в избытке. Если ввести сразу большую порцию раствора NaCl, то мгновенно выпадает осадок AgCl и золь не получится. При постепенном введении раствора NaCl в раствор AgNO3 в системе в первый момент образуются кристаллические агрегаты (AgCl)n из ионов Ag+ и Cl-. Агрегаты (AgCl)n адсорбируют на своей поверхности те ионы, которые составляют кристаллическую решетку и находятся в растворе в избытке. Этим условиям отвечают ионы Ag+. В результате адсорбции ионов Ag+ кристаллические агрегаты хлорида серебра приобретают положительный заряд.
Ионы, адсорбирующиеся на поверхности кристаллического агрегата, называют потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристаллов AgCl. Агрегаты AgCl с адсорбированными на их поверхности ионами приобретают состояние агрегативной устойчивости.
Кристаллический
агрегат (AgCl)n
вместе с потенциал- определяющими ионами
Ag+
составляет ядро.
К
заряженному ядру притягиваются ионы
противоположного заряда
–
противоионы.
Для данной системы раствор AgNO3
- кристалл AgCl
противоионами будут нитрат-ионы NO![]() .
Противоионы, непосредственно примыкающие
к ядру, образуют адсорбционный
слой
противоионов. За этим слоем следует
диффузный
слой
тех же противоионов.
.
Противоионы, непосредственно примыкающие
к ядру, образуют адсорбционный
слой
противоионов. За этим слоем следует
диффузный
слой
тех же противоионов.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Коллоидная частица совместно с противоионами диффузного слоя называется мицеллой. Коллоидная частица всегда заряжена, знак заряда соответствует знаку заряда потенциалопределяющих ионов; мицелла в отличие от гранулы электронейтральна.
Строение
мицеллы гидрозоля хлорида серебра
представлена на рис.3. Формула мицеллы
гидрозоля хлорида серебра записывается
так:
![]()
(в фигурные скобки заключена гранула). Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Эти ионы под действием электрического поля отрываются от мицеллы, и к отрицательно заряженному электроду будет передвигаться гранула, заряд которой определяется ионами серебра, входящими в ядро.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если взять избыток NaCl, то на поверхности агрегата будут адсорбироваться хлорид-ионы, имеющиеся в растворе, а в качестве противоионов адсорбционного и диффузного слоев будут выступать ионы натрия
![]() .
.
Во внешнем электрическом поле отрицательно заряженная гранула перемещается к положительно заряженному электроду.

















![]()
агрегат ионы,ад- противо противо-
сорбиро- ионы ионы
 ванные
адсорб- диффузного
ванные
адсорб- диффузного
агрегатом ционого слоя
 слоя
слоя
 адсорбционный
адсорбционный
 слой
слой

 коллоидная
частица
коллоидная
частица
 мицелла
мицелла
Рис. 3. Строение мицеллы золя хлорида серебра.
